서 론
근감소증(sarcopenia)은 노화, 만성질환, 장기간의 약물 투여 등 다양한 원인에 의해 발생하는 질환으로 근육량과 근력이 점진적으로 감소하는 상태를 의미하며 신체 기능 저하와 더불어 질병들이 동반될 수 있다[1]. 노화로 인한 근감소증은 보행 능력 저하, 낙상 위험 증가, 대사 건강 악화 및 삶의 질 저하 등 다양한 부정적 결과를 초래할 수 있어 건강 관리 측면에서 중요한 문제로 인식되고 있다[2]. 특히 고령 인구의 증가에 따라 근감소증에 대한 문제가 더욱 부각되고 있으며 노인의 자립적인 일상생활 유지 및 전반적인 건강 증진을 위해 근육량 감소를 예방하고 체계적으로 관리하는 것이 필수적이다[3].
노화로 인한 근감소증은 근육 단백질 합성이 감소하면서 단백질 분해가 촉진되어 근육량 감소가 가속화되는데 이는 주로 ubiquitin-proteasome system(UPS)과 같은 단백질 분해 경로의 활성화와 관련이 있다[4]. 또한, 근육 세포의 증식과 분화에 중요한 전사인자인 myoblast determination protein(MyoD)과 myogenin 등 근육 생성 조절 인자(myogenic regulatory factors)의 발현 감소는 근육량 및 근력의 저하로 이어질 수 있다[5]. 따라서 근육 단백질 합성을 촉진하고 단백질 분해를 억제할 수 있는 기능성 소재의 개발은 근감소증 예방 및 개선을 위한 효과적인 접근 전략이 될 수 있다.
기능성 소재 개발 분야에서 단백질의 생리활성을 강화하고 활용도를 높이기 위해 효소적 단백질 가수분해 방법이 주목받고 있다[6]. 단백질 가수분해 효소는 원료 단백질에 대한 절단 부위(cleavage site)가 서로 다르므로 사용되는 효소의 종류에 따라 최종 생성물의 특성이 변화될 수 있다[7]. 효소적 단백질 가수분해는 고분자 단백질을 저분자 펩타이드(peptide)로 분해하여 용해도를 향상시키고 제품 가공성을 개선할 뿐만 아니라 단백질의 소화흡수율을 증가시킬 수 있다[8]. 이러한 장점에도 불구하고 근육량 및 근력 개선을 목적으로 한 기능성 소재는 주로 추출물 또는 단순 분말 형태로 사용되고 있으며 효소를 활용한 단백질 가수분해물에 대한 연구는 상대적으로 부족한 실정이다[9].
최근 천연 유래 단백질 소재가 근감소증 예방 및 개선에 도움을 줄 수 있다는 연구결과들이 보고되고 있다. 예를 들어 발효 유청 단백질은 Akt/Foxo3a 신호전달 경로를 조절하여 근감소증 관련 유전자의 발현을 억제하고 근육세포의 생존율을 향상시켰으며 누에(silkworm) 유래 단백질은 mTOR 신호전달 경로를 활성화하여 노령 실험쥐의 근감소증을 개선한 바 있다[10,11]. 특히, 누에 유래 단백질은 소화흡수율이 높고 필수 아미노산 함량이 풍부하여 단백질 급원으로서의 활용 가능성이 높은 것으로 알려져 있으며 누에를 특정 식물의 잎으로 사육할 경우 영양학적 가치가 향상될 수 있음이 보고된 바 있다[12]. 꾸지뽕(Cudrania tricuspidata)은 뽕나무과(Moraceae)에 속하는 낙엽 활엽수로 다양한 생리활성물질을 함유하고 있으며 꾸지뽕잎에 다량 함유된 감마-아미노뷰티르산(γ-aminobutyric acid) 등의 성분은 Akt/mTOR 신호전달 경로를 활성화하여 골격근 대사 조절에 긍정적인 영향을 미칠 가능성이 있다[13].
따라서 본 연구에서는 꾸지뽕잎을 급여한 누에 분말에 효소를 처리하여 단백질 가수분해물 소재를 개발하고자 하였다. 또한, 생체내․외 실험을 통해 개발된 소재가 근감소증 개선에 미치는 영향을 평가하여 근감소증 예방 및 개선을 위한 건강기능식품 소재로서의 활용 가능성을 탐구하기 위해 수행되었다.
재료 및 방법
Cudrania tricuspidata silkworms fibroin protein(CSFP)의 제조를 위해 ㈜뉴트리케어(Korea)에서 꾸지뽕 누에 분말을 공급받아 사용하였다. 꾸지뽕 누에 분말의 중량이 20%가 되도록 증류수를 첨가하여 pH를 7.0으로 조정한 뒤 단질 가수분해효소인 bromelain 1.5%와 alcalase 0.5%를 첨가하여 50℃에서 5시간 동안 가수분해하였다. 이후 효소의 활성을 불활성화하기 위하여 100℃에서 15분간 가열 처리하고, 감압 농축 과정을 거친 후 분무 건조하여 CSFP를 제조하였다.
실험에 사용된 C2C12 세포는 마우스 골격근 세포주(mouse skeletal muscle cell line)로 American Type Culture Collection(Manassas, USA)로부터 분양받아 사용하였다. C2C12 세포는 10% fetal bovine serum(FBS; GenDEPOT, USA) 및 1% penicillin-streptomycin(Gibco, USA)이 첨가된 Dulbecco’s modified Eagle’s medium(DMEM; GenDPOT)을 사용하여 37℃, 5% CO2 조건이 유지되는 배양기에서 배양하였다. Cell culture flask의 바닥에 세포가 충분히 배양되면 phosphate buffered saline(Gibco)으로 세척한 후 0.25% trypsin-EDTA(Thermo Fisher Scientific, USA)를 처리하여 37℃가 유지되는 배양기에서 2분간 반응시켜 세포를 탈착시켰다. 이후 세포를 1:3의 비율로 분할하여 새로운 cell culture dish에 옮긴 뒤 37℃, 5% CO2 환경이 유지되는 배양기에서 배양하여 실험에 사용하였다. 또한, C2C12 세포의 근관세포(myotube)로의 분화를 유도하기 위해 2% horse serum(GenDEPOT)이 첨가된 DMEM 배지를 사용하였다.
덱사메타손(dexamethasone) 처리에 의해 유도된 C2C12 세포 손상으로부터 CSFP의 세포 보호 효과를 평가하기 위해, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide (MTT) 기법을 이용하여 세포 생존율을 측정하였다. C2C12 세포는 24-well plate에 1×104 cells/mL의 농도로 분주한 후 37℃, 5% CO2 조건이 유지되는 배양기에서 24시간 동안 배양하였다. 이후 각 well에 100 μM의 덱사메타손과 CSFP를 농도별(5, 10, 25, 50, 100, 250, 500 μg/mL)로 처리한 후 동일한 조건에서 24시간 동안 배양하였다. 그 다음 각 well에 2.5 μg/mL의 MTT 시약을 1 mL씩 처리하고 37℃, 5% CO2 조건에서 3시간 동안 반응시켰다. 반응 종료 후 상등액을 제거하고 각 well에 1 mL의 dimethyl sulfoxide를 첨가하여 생성된 formazan 결정을 용해시킨 후 570 nm에서 흡광도를 측정하였다. 흡광도는 MMR SPARK(Tecan, Switzerland)을 이용하여 측정하였으며 세포 생존율은 대조군의 흡광도에 대한 백분율로 나타내었다.
동물실험은 삼육대학교 동물윤리위원회의 승인을 받아 실험동물에 대한 윤리 지침에 따라 수행되었다(SYUIACUC 2023-021). 동물실험은 샘타코(Korea)로부터 32마리의 수컷 Sprague-Dawely rats을 분양 받아 사용하였으며 사료는 두열바이오텍(Korea)에서 공급받아 사용하였다. 실험동물은 스테인리스 케이지당 한 마리씩 무작위로 배치하였으며 온도 22±1℃, 습도 50±10%, 12시간 명암주기가 일정하게 유지되는 삼육대학교 실험동물센터(Korea)에서 사육하였다. 1주일간의 적응 기간을 거친 후 실험쥐의 근감소증을 유도하기 위해 대조군을 제외한 모든 처리군에 2.25 mg/kg 농도의 덱사메타손을 3일간 복강 내 투여하였다. 이후 본 실험은 대조군, DEX, CSFP(5%) 또는 CSFP(10%) 등 4개의 처리군으로 분류하여 총 8주간 진행되었다. 대조군과 DEX 처리군은 AIG-93G 표준 사료(Envigo, USA)를 공급하였으며 CSFP(5%) 및 CSFP(10%) 처리군은 동일한 사료 조성을 기반으로 단백질 공급원을 CSFP로 대체하여 제조한 사료를 공급하였다(Table 1).
동물실험 종료 후 실험쥐를 CO2 가스로 마취시켜 도살한 뒤 비복근(gastrocnemius muscle)과 전경골근(tibialis anterior muscle)을 적출하여 무게를 측정하였다. 약력(grip strength) 측정 실험은 실험쥐의 최대 근력을 평가하는 방법으로 Grip strength meter(Bioseb, France)를 이용하여 측정하였다. 실험쥐가 T-bar를 잡게 유도한 뒤 꼬리를 2 cm/s의 속도로 당겨 악력을 측정하였으며 3회 반복하여 측정한 평균값을 결과로 사용하였다.
각 처리군별 단백질 합성 및 분해 관련 인자의 mRNA 발현 양상을 분석하기 위하여 실험쥐의 비복근으로부터 RNA를 추출하였다. RNA 추출에 필요한 시약들은 Sigma-Aldrich(USA)에서 구입하였다. Trizol 1 mL와 100 mg의 조직을 함께 균질화한 후 chloroform 200 μL를 첨가하여 혼합하였다. 그 다음 원심분리하여 회수한 상등액에 isopropanol 500 μL를 첨가하고, 10분간 얼음에 냉각하여 RNA를 침전시켰다. 침전된 RNA를 세척 후 Maxima First Strand cDNA Synthesis Kit for RT-qPCR(Thermo Fisher Scientific)를 이용하여 제조사의 지침에 따라 cDNA를 합성하였다. 실시간 중합효소 연쇄 반응(real-time polymerase chain reaction, RT-PCR)을 수행하기 위해 SYBR green qPCR High-ROX PreMIX(Enzynomics, Korea)와 프라이머(Bioneer, Korea)를 사용하였으며 프라이머의 염기서열은 다음과 같다: β-actin(forward, TAT CGG CAA TGA GCG GTT CC; reverse, AGC ACT GTG TTG GCA TAG AGG), MyoD(forward, ACT ACA GCG GCG ACT CAG AC; reverse, ACT GTA GTA GGC GGC GTC GT), myogenin(forward, TGA ATG CAA CTC CCA CAG C; reverse, CAG ACA TAT CCT CC ACC GTG), MuRF-1(forward, ATC ACT CAG GAG CAG GAG GA, reverse, CTT GGC ACT CAA GAG GAA GG), atrogin-1(forward, AGC TTG TGC GAT GTT ACC A; reverse, GGT GAA AGT GAG ACG GAG CA). RT-PCR 반응액은 SYBR green qPCR High-ROX PreMIX 10 μL, forward 프라이버 1 μL, reverse 프라이머 1 μL, DNase-free water 6 μL, cDNA 2 μL로 구성하였으며, DTprime 5(DNA-Technology, Russia)를 이용해 RT-PCR을 수행하였다. 초기 변성(Initial denaturation) 단계는 95℃에서 10분간 수행하였으며 이후 95℃에서 10초간 변성, 60℃에서 20초 동안 결합(annealing), 72℃에서 30초간 신장(extension)하는 과정을 40회 반복하였다. 각 처리군 간 상대적인 mRNA 발현량은 2-delta delta Ct 방법을 이용하여 계산하였다.
결과 및 고찰
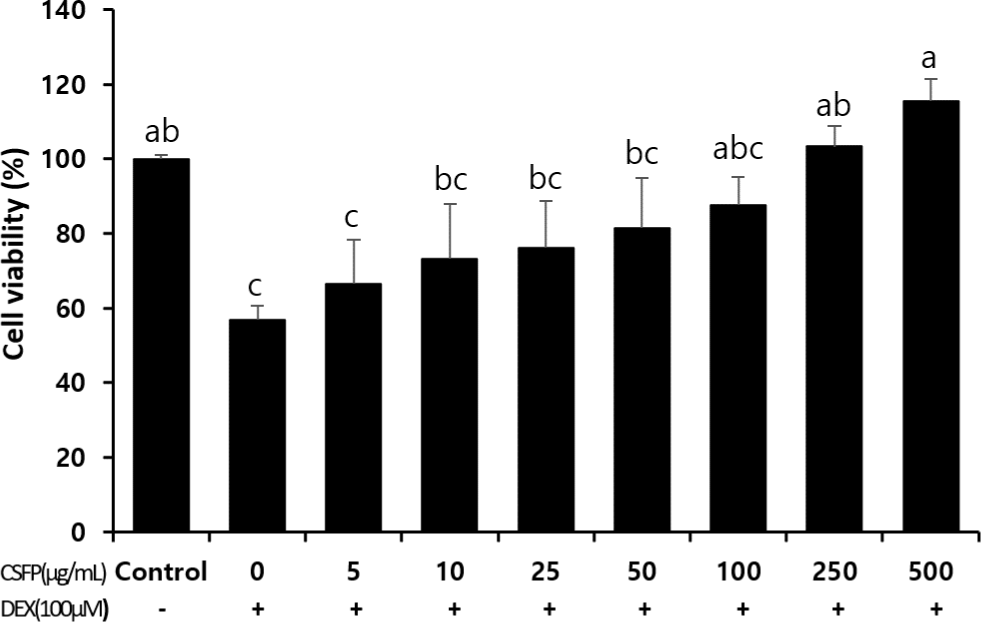
CSFP의 세포 보호 효과를 확인하기 위해 C2C12 세포에 100 μM 농도의 덱사메타손을 처리하여 세포 손상을 유도한 후 CSFP를 함께 처리하여 세포 생존율의 변화를 측정하였다(Fig. 1). 덱사메타손 단독 처리군에서는 세포 생존율이 56.86%로 유의적으로 감소하였으나 CSFP를 250 μg/mL 이상의 농도로 처리한 경우 세포 생존율은 103.32%–115.57%까지 유의하게 증가하였다(p<0.05). 합성 glucocorticoid인 덱사메타손은 C2C12 세포의 단백질 합성을 억제하고 UPS 경로를 통한 단백질 분해를 촉진시키므로 sarcopenia와 관련된 실험에서 C2C12 세포를 손상시키기 위해 사용되는 물질이다[14]. 본 연구에서도 덱사메타손(100 μM) 처리에 의해 C2C12 세포의 생존율이 감소하여 세포 손상이 성공적으로 유도되었음을 확인하였고, 250 μg/mL 이상의 농도로 CSFP를 처리한 경우 손상된 C2C12 세포의 생존율이 유의적으로 회복되었다. 이는 CSFP가 덱사메타손에 의해 유도된 손상으로부터 C2C12 세포를 효과적으로 보호할 수 있는 기능이 있음을 보여준다. 이러한 결과는 스피룰리나(spirulina), 누에 단백질, 또는 식물성 단백질 등 일부 단백질 유래 기능성 소재들이 C2C12 세포의 생존율을 증가시키거나 분화를 촉진한다는 선행연구와 유사한 경향을 보인다[15,16]. 특히 스피룰리나 유래 단백질 가수분해물은 Akt/Foxo3a 신호 경로를 통해 근위축 관련 유전자(Atrogin-1, MuRF-1)의 발현을 억제하고, 근세포 생존율을 증가시킨다고 보고된 바 있다[17]. CSFP 역시 유사한 생리활성 펩타이드를 함유하고 있을 가능성이 있으며, 이들 성분이 AMPK, PI3K/Akt, 또는 Foxo3a 경로에 작용하여 세포 내 스트레스를 억제하고 생존 신호를 유도했을 가능성이 있다. 다만, 본 연구에서는 CSFP의 세포보호 기전을 분자 수준에서 직접적으로 규명하지 않았기 때문에 향후 AMPK, PI3K/Akt, 또는 Foxo3a 등의 신호전달경로에 대한 추가적인 기전 연구가 필요하다.
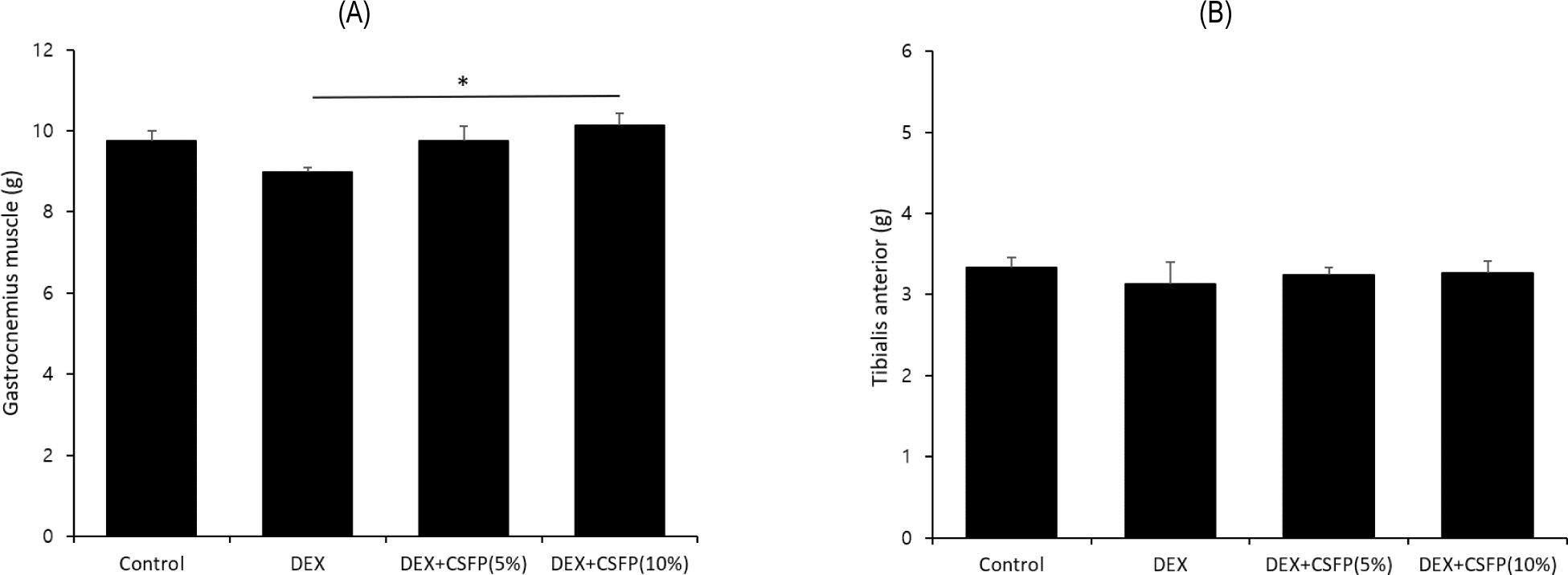
CSFP를 섭취한 실험쥐의 비복근 및 전경골근 무게를 측정한 결과는 Fig. 2와 같다. 전경골근의 무게는 각 처리군 간에 유의적인 차이를 보이지 않았다. 반면, CSFP(10%)가 첨가된 사료를 섭취한 실험쥐의 비복근 무게는 DEX 처리군과 비교하여 유의하게 증가하는 양상을 보였다(p<0.05). 비복근은 실험쥐의 하지 후방 구획에 있는 가장 중요한 표층 근육으로 내측두(medial head) 및 외측두(lateral head)의 두 부분으로 구성되며 보행 및 도약 시 추진력을 제공하고 하지의 안정성 유지 및 충격 완화에 중요한 기능을 수행한다[18]. 또한, 비복근은 근섬유 유형의 분화가 뚜렷하고 해부학적 경계가 명확하여 근생리학적 특성을 평가하거나 약물 및 영양학적 효과를 검증하는 연구의 분석 항목으로 널리 활용되고 있다[19]. 특히, 비복근은 보행 시 지속적인 부하를 받고 지구력 운동에 동원되는 근육이라서 대사적 요구량이 상대적으로 높기 때문에 영양소 및 생리활성물질이 근육에 미치는 효과를 평가하기에 적합한 조직이다[20]. 본 연구에서 단백질 급원으로 10% CSFP가 첨가된 사료를 섭취한 실험쥐들은 비복근의 무게가 유의하게 증가하였다. 이는 동물사료 내 CSFP의 첨가가 근육량 유지에 긍정적인 영향을 미칠 수 있다는 가능성을 보여주며 CSFP가 지구력 및 부하가 큰 후방 구획 근육의 보호에 효과적일 수 있음을 시사한다. 향후 연구에서는 CSFP의 근감소증 개선 효과를 분자 수준에서 규명하기 위해 단백질 합성 및 분해 관련 신호전달 경로에 대한 분석이 요구되며 다양한 운동 부하 조건에서의 반응성을 비교함으로써 CSFP가 근육의 생성 및 유지에 미치는 영향에 대한 기전을 명확히 규명할 필요가 있다.
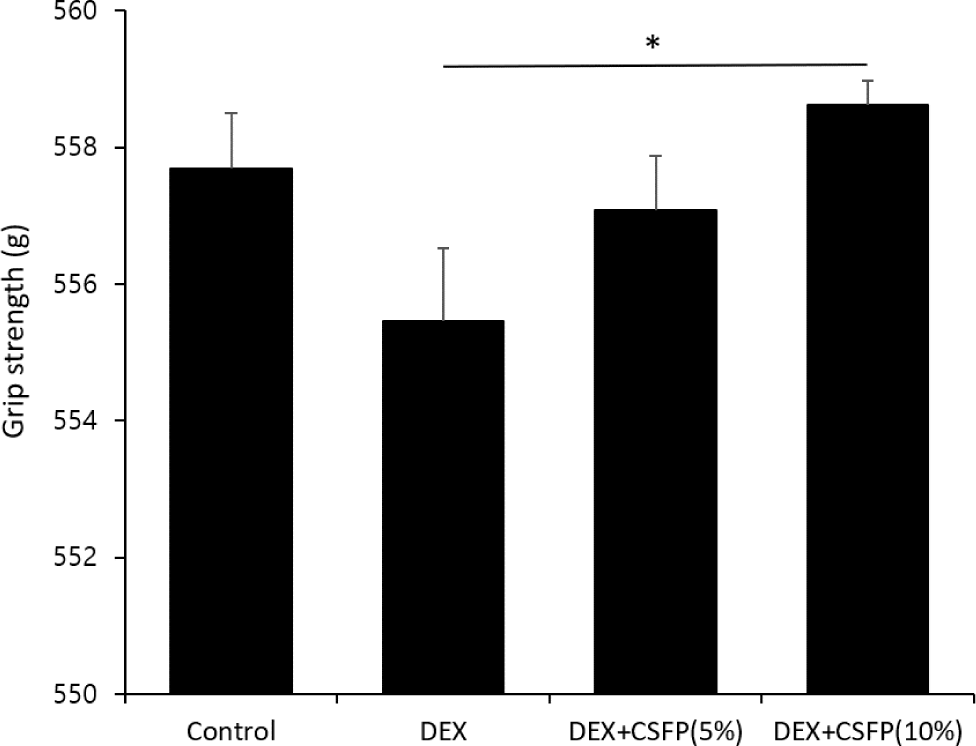
덱사메타손으로 근감소증을 유도한 실험쥐를 대상으로 CSFP의 섭취가 실험쥐의 근력에 미치는 영항을 평가하였다(Fig. 3). 8주간의 동물실험 종료 후 실험쥐의 악력을 측정한 결과 CSFP(5%) 처리군은 DEX 처리군의 악력 측정치와 비교하여 유의한 차이를 보이지 않았으나 CSFP(10%) 처리군에서는 악력이 유의적으로 증가하는 경향을 나타냈다(p<0.05). 비록 CSFP(5%) 처리군에서 근력 개선에 뚜렷한 효과가 나타나지 않았으나 CSFP(10%) 처리군에서는 근력 개선에 유의적인 효과가 나타난 것을 볼 때 일정 농도 이상의 CSFP 섭취는 근감소증으로 인한 근력 저하를 완화할 수 있음을 시사한다. 또한, CSFP(10%) 처리군은 악력뿐만 아니라 비복근 무게도 유의적으로 증가하였다. 비복근은 다양한 운동 기능에 핵심적인 역할을 하며 대사적 요구량이 높은 근육으로 알려져 있다[21]. 따라서 CSFP의 단백질 가수분해 성분이 근육량 증가와 근력 유지에 기여할 수 있다는 가능성을 보여주며 단백질 합성을 촉진하는 신호전달 경로에 작용했을 가능성을 시사한다. 예를 들어, mTOR 경로를 통한 단백질 합성 촉진과 이에 따른 근감소증이 개선 효과가 잠재적으로 고려될 수 있다[22]. 또한, 선행연구에서 실크 펩타이드를 섭취한 고령 흰쥐에서 mTOR 신호전달 경로가 활성화되어 근감소증을 효과적으로 개선되었음을 보고하였다[23].
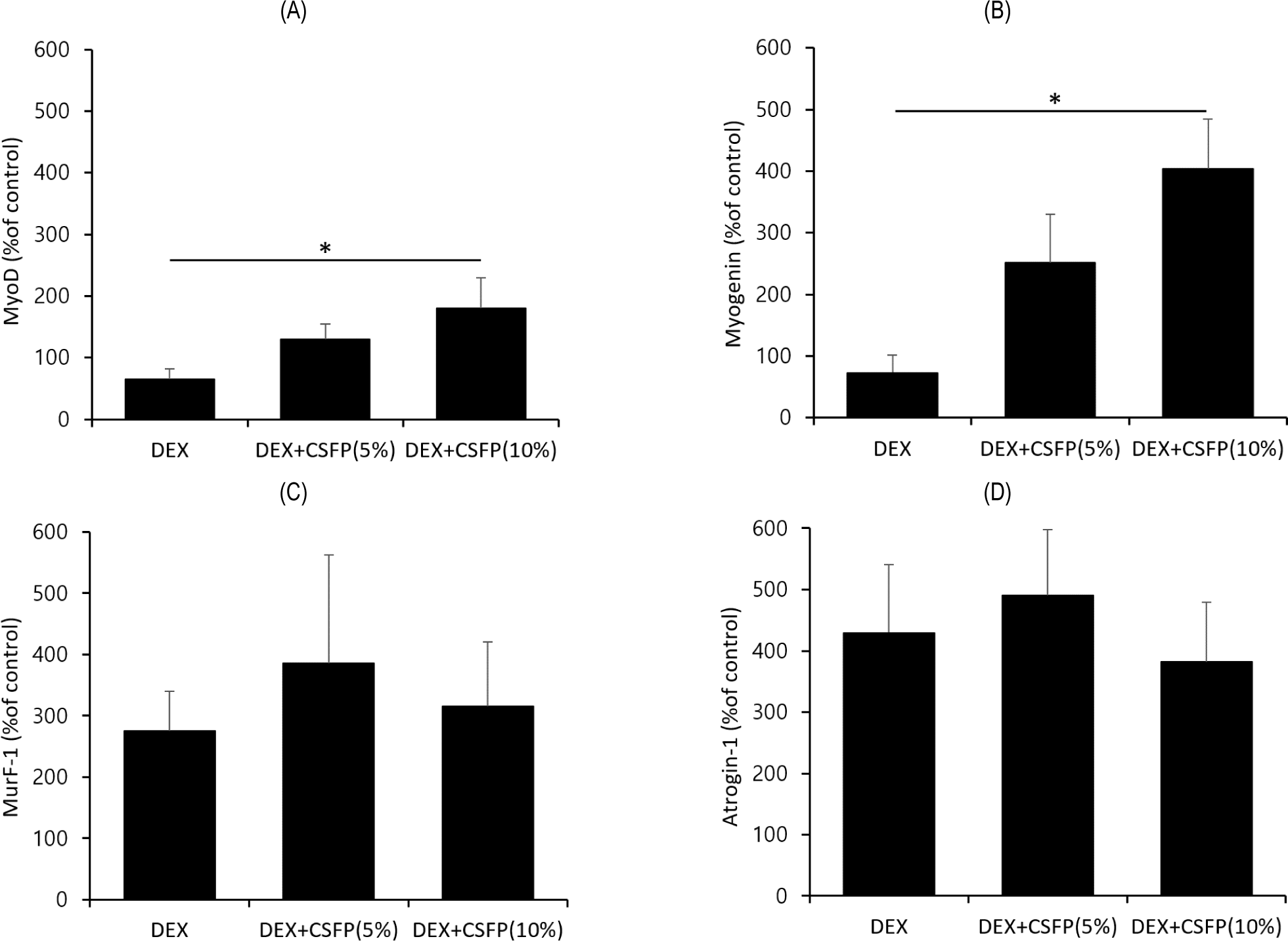
MuRF-1과 atrogin-1은 근육 단백질 분해와 관련된 인자이며 MyoD와 myogenin은 근육 단백질 합성과 관련된 인자로 알려져있다. CSFP의 섭취가 근육 단백질 합성 및 분해 관련 인자의 mRNA 발현에 미치는 영향을 평가하기 위하여 각 인자의 mRNA 발현량을 측정하였다(Fig. 4). 그 결과 MuRF-1 및 atrogin-1의 mRNA 발현량은 실험군 간에 유의적인 차이를 나타내지 않았다. 반면, MyoD의 mRNA 발현량은 DEX+CSFP(10%) 처리군에서 180.06%로 증가하였으며 myogenin의 mRNA 발현량은 DEX+CSFP(10%) 처리군에서 403.45%로 증가하였다. 이는 DEX 처리군의 MyoD 및 myogenin mRNA 발현량인 65.62%, 73.23%와 비교하여 높은 수치이며 통계적으로 유의적인 차이를 보였다(p<0.05). 근육 세포의 증식과 분화에 관여하는 MyoD, myogenin, myogenic factor 5 및 muscle specific regulatory factor 4 등의 근육 생성 조절 인자(myogenic regulatory factors)는 근육 세포의 증식과 분화에 핵심적인 역할을 하며 근아세포를 근관세포로 분화시켜 골격근 형성을 유도할 수 있다[24]. 특히, MyoD와 myogenin은 근섬유 다발의 형성을 통해 골격근의 발달을 촉진하며[25], 덱사메타손은 이러한 근원성 분화(myogenic differentiation)에 관여하는 근육 생성 조절 인자의 발현을 억제하는 것으로 알려져 있으며[26,27], 덱사메타손에 의해 근감소증이 유발되면 근육 생성 조절 인자 중 MyoD 및 myogenin 등의 유전자 발현이 감소될 수 있다고 보고되었다[28]. 따라서 CSFP은 덱사메타손 처리에 의해 감소된 MyoD 및 myogenin의 유전자 발현량을 증가시켜 근감소증을 완화시킬 수 있는 것으로 추정된다. 한편, 본 연구는 CSFP 섭취에 따른 myogenin 및 MyoD mRNA 발현 증가의 직접적인 기전을 규명하지 못한 한계가 있다. 그러나 선행연구에 따르면 이러한 발현 증가는 Akt의 활성화와 관련이 있을 것으로 추정된다[29]. Akt는 serine/threonine kinase로서 단백질 합성 경로를 조절하여 근육 합성을 촉진하는 역할을 하며 그 활성화는 MyoD 및 myogenin의 mRNA 발현을 증가시켜 근육 생성에 기여할 수 있는 것으로 알려져 있다[30,31].
결 론
본 연구에서는 CSFP가 덱사메타손으로 유도된 손상으로부터 C2C12 세포를 보호하는 효과를 확인하였으며 덱사메타손 처리로 근감소증이 유발된 실험쥐 모델에서 CSFP가 근감소증 개선에 미치는 영향을 평가하였다. 세포 수준에서 CSFP는 덱사메타손에 인한 C2C12 세포의 손상을 효과적으로 완화하여 세포 생존율을 유의적으로 증가시켰으며 동물실험에서는 단백질 급원으로서 10% CSFP가 첨가된 사료를 섭취한 실험쥐에서 비복근 무게와 악력이 유의적으로 증가하였다. 비복근은 보행 및 도약과 같은 다양한 운동 기능 수행에 필수적인 근육으로 대사적 요구가 높은 조직으로 알려져있다. 따라서 비복근 무게의 증가는 CSFP가 근육량 및 근력 유지에 긍정적인 영향을 미칠 수 있음을 의미한다. 근육 단백질 합성과 관련 유전자 발현 분석에서도 CSFP(10%) 처리군에서 근육 생성 조절 인자인 MyoD 및 myogenin의 발현이 유의하게 증가하여 CSFP가 근육 재생 및 성장 촉진에 관여할 가능성을 제시하였다. 선행연구를 근거로 CSFP에 포함된 단백질 가수분해물이 mTOR 신호전달 경로를 활성화하여 단백질 합성을 촉진함으로써 근감소증 개선에 기여했을 것으로 추정된다. 이러한 결과는 CSFP가 기능성 단백질 소재로서 근육량의 손실을 억제하고 근력 저하를 방지할 수 있는 잠재력을 지니고 있음을 시사하며 이는 노인층의 근감소증 예방 및 개선을 위한 건강기능식품 소재로서의 활용 가능성을 제시한다. 특히, 고령층은 노화에 따라 근육량 감소와 신체 기능 저하를 경험하게 되므로 CSFP와 같은 고품질 단백질 공급원의 섭취는 근육 건강 유지 및 삶의 질 향상에 기여할 수 있을 것으로 기대된다.






