서 론
박테리아 오염은 낙농 산업에서 생산되는 제품의 품질, 기능성 및 안전성에 부정적인 영향을 미치며, 유제품 가공 장비의 표면에 부착되어 성장하는 박테리아 세포의 집합체인 생물막은 유제품 오염의 주 원인이다[1]. 유제품 생물막에는 우유 잔류물, 특히 단백질과 인산칼슘과 같은 미네랄이 포함되어 있어 잠재적인 오염원일 뿐만 아니라 부식 속도를 증가시키고 열 전달을 감소시키며 유체 마찰 저항을 증가시킬 수도 있다[2]. 생산 기간 연장, 복잡한 장비 사용, 공장 자동화, 점점 더 엄격해지는 미생물학적 요건 등의 추세로 인해 박테리아 생물막으로 인한 유제품 오염은 유제품 제조업체의 주요 관심사가 되었다.
유가공 공장의 CIP(Clean-In-Place)는 세정뿐만 아니라 바이오필름 제거 공정을 포함한 일련의 세정시스템을 의미한다. 이는 “장비를 분해하거나 열지 않고 수동 개입이 거의 또는 전혀 없이 파이프라인 전체를 세척하는 것”으로 정의된다. 우유 접촉 표면의 세척 및 위생 효율성은 오염 특성, 표면의 미세 지형, 통로의 직진성, 표면제의 호환성, 적용 방법, 적용 속도 및 관련 침투 속도와 같은 많은 요인에 의해 크게 영향을 받는다[3].
낙농 산업에서 CIP 시스템은 일반적으로 가성(수산화나트륨)과 산(질산) 세척 단계를 순차적으로 사용하며, 원래는 유기(단백질 및 지방)와 무기(칼슘-인산염 및 기타 미네랄)를 제거하기 위해 선택된 화합물이며, 오염이 심한 경우에는 소독제도 사용될 수 있다[4].
가장 많이 사용되는 강력한 가성 세척제는 수산화나트륨(NaOH)으로, 일반적으로 1%–2% 농도로 사용되나 오염이 심한 경우에는 5% 농도로 사용된다[5]. 가성(알칼리) 세척 단계의 주요 역할은 단백질과 탄수화물을 제거하는 것이다[6]. 가성 단계의 효율성을 높이면 필요한 질산의 양과 소독제 사용 필요성이 줄어들 수 있다. 세척 효과를 높이기 위해 계면활성제, 유화제, 킬레이트 화합물 및 착화제를 포함하는 가성 혼합물과 가성 첨가제가 개발되었다. 산성 단계의 주요 역할은 부식성 세척 화학물질에 노출된 후 관 표면에 남아 있는 미네랄 스케일을 제거하는 것이다. 산성 단계는 또한 장비 표면에서 미량의 알칼리성 제품을 제거하는 데 도움이 되고 배수 및 건조를 강화하며 남아 있는 미생물의 성장을 지연시키는 정균 조건을 제공한다[7]. 낙농 산업에서 사용되는 가장 일반적인 산은 질산이며, 부식성 화학물질과 마찬가지로 다른 산이나 계면활성제를 함유할 수 있는 산 혼합물도 제조되었다. 전통적으로 염소 기반 소독제가 사용되어 왔지만, 4차 암모늄 화합물, 음이온산, 요오드 포어 및 염소 기반 화합물을 포함한 다양한 소독제가 현재 사용되고 있거나 CIP 체제에서 사용하기 위해 평가되고 있다[8–10].
그러나 이러한 화학물질은 취급 부주의로 인한 누출 및 잔류 물질의 노출로 인해 인체에 유해할 수 있다. 따라서 본 연구에서는 목장 환경이나 유가공장에 상재하는 오염 미생물의 종류를 파악하고, 식약처에서 식품용 살균제로 인정한 차아염소산나트륨/구연산 CIP 시스템을 사용하여 기존 시판 제품과 오염 미생물 제거 효과를 비교하였다.
재료 및 방법
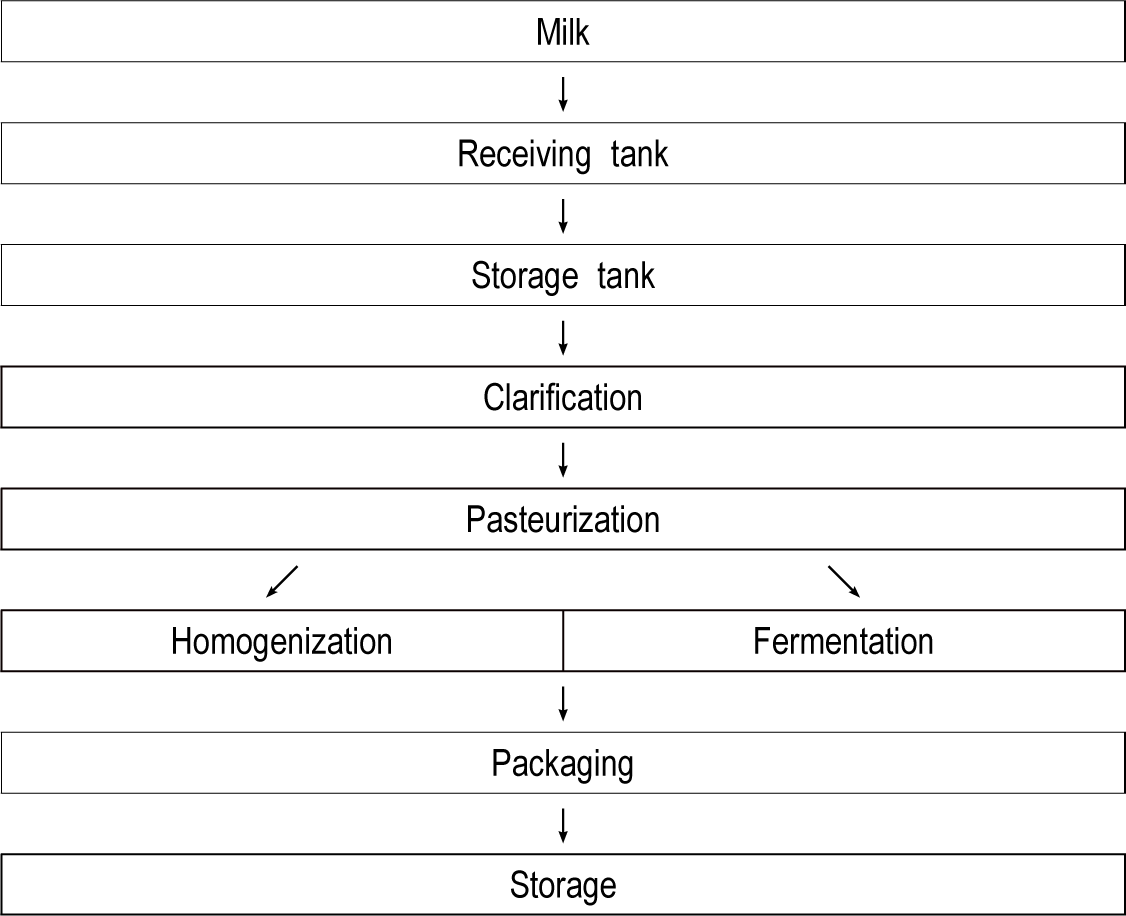
착유된 원유는 Fig. 1과 같이 송유관(파이프라인)을 통해 즉시 4°C 집유 냉각 저장고에 저장되고 그 후 원유는 균질, 살균되어 냉각 상태로 보관 및 포장되거나 가공을 위해 송유관을 통해 발효 배트나 치즈 제조용 배트로 옮겨진다. 소규모 농장의 경우 지역 조합에서 집유 차량를 통해 원유를 수거하고 수거된 집유는 우유 제조공장으로 간선 운송된다.
우유 및 유제품 가공 공정의 미생물 저감 분석을 위해 Table 1과 같이 제조단계별 채취대상을 선정하였다. 본 연구의 미생물 저감 기술은 김제 소규모 목장형 유가공장에서 실험하였다. CIP 세척 시스템은 저장탱크(storage tank)부터 충진(packaging)까지 해당되며, 본 실험을 위해 구연산(12% 농축액, 덕산)과 차아염소산나트륨(5% 농축액, 대정) 조합을 사용하였다.
지리적으로 다른 위치에 있는 4개의 목장형 유가공장의 원유와 환경시료(토양, 음수, 깔집, 세척수, 원유 탱크 표면, 냉각실 바닥, 숙성실 보드)에 대해 무균적으로 수집한 미생물 분석을 수행하였다. 원유탱크 표면, 냉각실 바닥, 숙성실 보드 시료는 swab법(3M Quick swab & 3M Pipette swab; 3M, USA)을 사용하였으며, 원유, 토양, 음수, 깔집, 세척수는 전처리용액과 함께 멸균된 stomacher bag에 넣어 stomacher(Elmex SH-ⅡM, Elmex, Japan)로 균질화하고 희석하여 사용하였다[11]. Tryptic soy agar(Difco, USA) 및 yeast extract peptone dextrose agar에 도말하여 37°C에서 24시간 이상 배양한 후 미생물 집락의 형태에 따라 분리하였다. 일부 분리 미생물은 16S rRNA sequencing으로 동정하였다.
분리균주의 항생제에 대한 내성 측정에는 Clinical and Laboratory Standards Institute(CLSI) guidelines(2018)에 따라 disk diffusion assay에 의해 측정하였다[12]. 사용한 항세제 디스크(BBL, Sensi-disc, Becton Diskinson, USA)는 vancomycin, ampicillin, cephalothin, penicillin G, streptomycin 등 총 11종의 항생제를 사용하였다. 각 분리균주는 TSB 액체 배지에서 배양한 후 105 CFU/mL가 되게 Mueller hinton afar(Merck, Germany)에 도말한 다음, 11종의 항생제 디스크를 놓고 37에서 24시간 방치한 다음, 각 항새제에 대한 저지환의 크기를 측정하고 감수성과 내성을 판정하였다.
CIP 시스템(구연산/차아염소산나트륨)은 목장형 농가의 발효유 제조 라인을 사용하였다. CIP라인이 적용된 곳은 원유 저장탱크에서부터 집유, 청정, 살균, 발효조, 충진기까지이며, 구연산(1%)과 차아염소산나트륨(50 ppm)조합에 노출시키고 Table 2의 조건대로 처리하였다. 발효유를 제조한 후 세척하지 않았고 4시간 후에 CIP 시스템을 이용하여 세척하였다. 6단계가 모두 끝난 후 세척수(1 L씩 10병)는 모아졌고, 일반세균과 대장균군의 생균수를 확인하여 저해 효과를 확인하였다. 모든 실험은 상온(20±5°C)에서 수행하였다.
| Step | Time | Process |
|---|---|---|
| 1 | Water pre-rinsing, 45°C | |
| 2 | 20 min | 1%–2% alkaline cleaning, 85°C |
| 3 | Water cleaning | |
| 4 | 10 min | 0.5%–2% acid cleaning 60°C |
| 5 | Water post-rinsing | |
| 6 | Hydrothermal sterilization, 95°C |
Table 2의 조건에서 처리한 시료 및 CIP 시스템 적용 후 미생물 분포는 Swab kit(3M)를 사용하여 10 cm2의 넓이를 측정하였으며, 균수는 CFU/cm2로 나타내었다. 6단계의 CIP 시스템이 끝난 후 첫번쨰 세척수는 멸균 희석수로 희석한 후 측정하였으며 균수는 CFU/mL로 나타내었다. 대장균/대장균군(Escherichia coli/coliform group)의 정량 분석을 위해 PetrifilmTME. coli/Coliform count plate(EC, 3M)을 사용하였고, 일반세균 정량을 위해 PetrifilmTM Aerobic Count(AC, 3M)을 사용하였다. 접종 후 24시간 37°C에서 배양한 후 콜로니를 계수하였다. 미생물 저감효과를 측정하기 위해 미생물 제어기술 전과 후의 미생물생균수를 비교하였다.
세척제 변경에 따른 최종유제품의 성분 변화를 확인하기 위해 일반성분 분석을 수행하였다. 수분, 조단백질, 조지방 및 회분은 AOAC 방법에 의하여 정량하였고, 탄수화물 함량은 전체에서 수분, 조단백질, 조지방 및 회분을 뺀 값으로 계산하였다.
시료의 잔류염소(residual chlorine) 함량의 측정은 시료 30 g을 취하여 증류수 270 mL로 시료액을 만들어 residual chlorine meter(RC-24P, TOA Electronics, Japan)를 시용하여 측정하였다[13].
결과 및 고찰
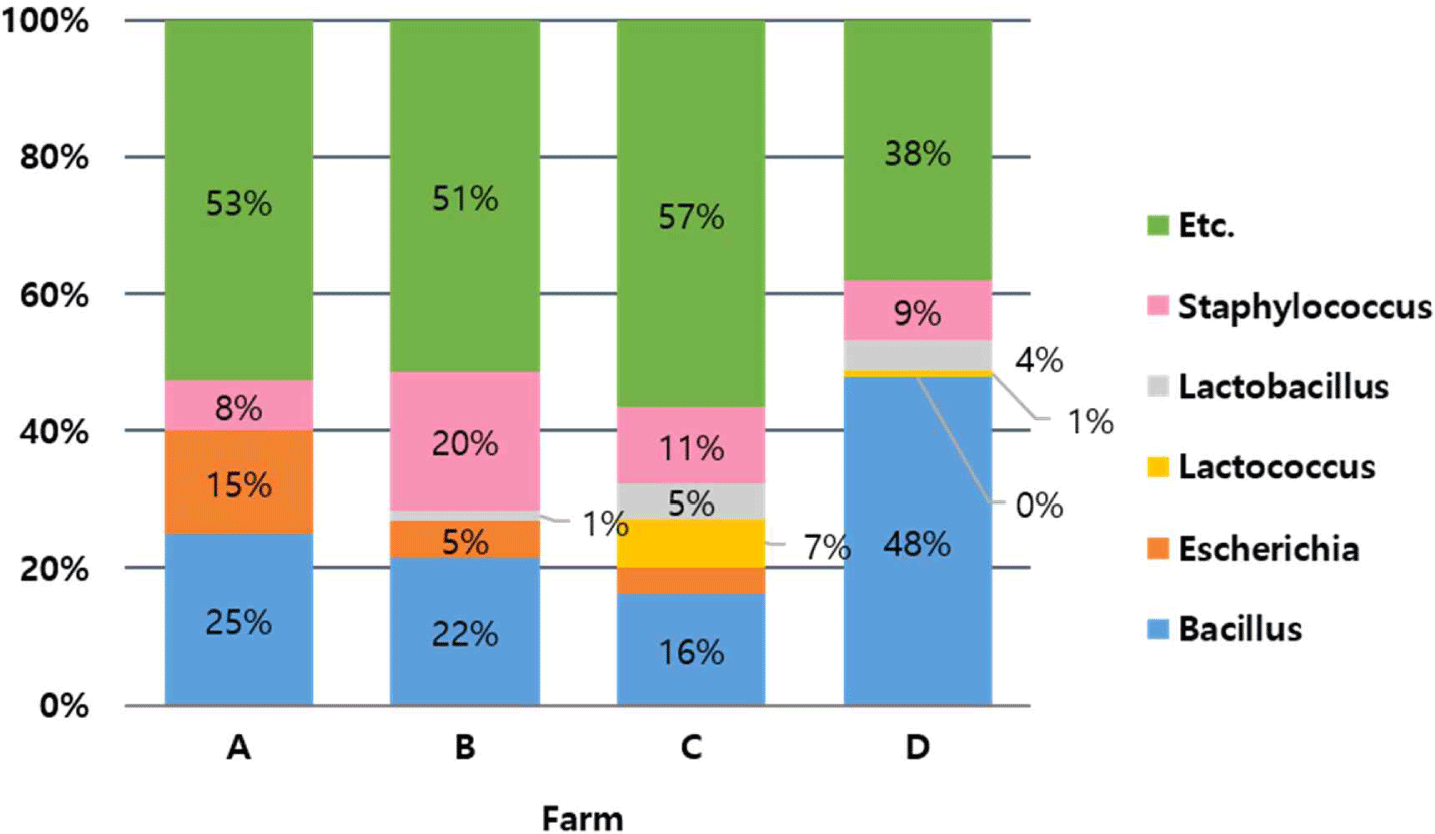
서로 다른 4곳의 축사환경(원유 및 환경시료)의 미생물 분석은 배지를 통해 검출된 콜로니의 16S rDNA sequencing 분석을 통해 동정되었으며, 전체 분리 균주들 중에서 각각의 세균을 속 수준에서 분류하였고 %단위로 나타내었다. 그 결과 주로 분리된 균은 Staphylococcus속과 Bacillus속이었다(Fig. 2). 또한 일부 분리균(155종)의 항생제내성을 분석한 결과, 내성을 보유하지 않거나(14.2%) 다제내성을 가진 것(41.3%, 물 또는 냉각실 바닥에서 분리)을 확인하였다. 목장 환경이나 유가공장에 상재하는 미생물은 원유 수송관을 통해 CIP 라인을 오염시킬 수 있으므로 적절한 관리가 필요하다.
목장형 유가공장의 안전관리를 위하여 기존 정치세적 방법보다 친환경적인 세척제제로 구연산과 차아염소산나트륨을 사용하였다. CIP 시스템(구연산/차아염소산나트륨)을 적용한 6곳(원유 저장탱크, 집유, 청정, 살균, 발효조, 충진기)은 유가공 제조 업체의 발효유 생산 라인으로 생산 직후 4시간 방치 후에 수행하였다. 6단계의 CIP 시스템이 끝난 후 첫 번째 세척수를 사용하여 남아 있는 미생물의 수를 적용 전과 비교하여 계산하였다. 그 결과 6곳 모두에서 대장균군이 검출되지 않았고, 일반세균은 0–32 CFU/mL로 식약처의 우유류에 대한 세균수 기준규격(n=5, c=2, m=10,000, M=50,000)에 매우 적합한 수준이었다. 특히, 발효유 VAT에서 세척 이후 대장균군이 검출되지 않았고, 일반세균은 1±0.0 CFU/mL로 매우 낮은 수준으로 검출되었다. 이전 연구에서 Bacillus cereus, E. coli 및 Staphylococcus aureus에 인위적으로 오염된 파일럿 규모의 CIP 시스템은 7%의 구연산과 200 ppm의 차아염소산나트륨으로 동시 세척 시 B. cereus, E. coli 및 S. aureus의 생물막을 각각 6.9, 7.0 및 8.0 log CFU/cm2만큼 감소시켰다[14]. 따라서 차아염소산나트륨과 구연산 CIP 시스템은 우리의 결과에서 보여진 E. coli 와 일반 세균뿐만 아니라 선행연구 결과에서 보듯이 식중독균에도 효과적인 접근 방법임이 입증되었다. 또한 차아염소산나트륨과 구연산은 식품첨가물로 승인되었기 때문에 안전한 유제품 생산에 기여할 수 있다. 추가적으로 CIP 시스템이 적용되지 않는 우유 거름망(filter)은 분리작업 후 일반 주방세제를 사용하여 세척하였다. 그 결과 대장균군은 음성, 일반세균은 9±2.40 CFU/cm2로 매우 양호한 수준이었다(Table 3).
잔류 염소량은 기존 산·알칼리 세척제와 비교하여 차아염소산나트륨/구연산 세척제와 구연산/수산화나트륨 세척제를 사용하였을 때 감소하였고, 물세척(5분 이상) 후에는 모두 수돗물 수준으로 나타났다. 검출된 수치는 모두 먹는물 수질기준 중 염소이온의 기준치(250 mg/L) 이하로 매우 안전한 수준이었다. 물세척 후에 음이온 계면활성제는 검출되지 않았다. 세척제 비용을 계산해 보면, 기존 산·알칼리 세척제를 사용할 경우에 비해 구연산과 차아염소산나트륨 세척제를 사용할 경우 증가비용이 발생할 수 있다. 그러나 세척제 비용의 대부분을 차지하는 구연산 농도가 4% 이하일 경우 증가비용이 거의 발생하지 않으며, 이에 따라 현장에 적용하는 구연산 농도는 추가적인 미생물 제어효과를 현장 검증하여 최종 설정(1%)하였다(Table 4).
| Cleaning agents | Chloride (mg/L) |
|---|---|
| Water | 12.65±0.02 |
| Citric acid/sodium hypochlorote | 13.25±4.73 |
| Citric acid/sodium hydrate | 13.73±2.71 |
| Commercial CIP agents | 33.94±10.83 |
기존 산·알칼리 세척제 사용 후와 구연산·차아염소산나트륨 세척제 사용 후의 최종 발효유제품의 이화학적, 영양학적 특성을 비교해 보았다. 그 결과 두 제품 간의 수분, 지방, 단백질, 탄수화물, 회분 그리고 pH에서 모두 유의적 차이가 없었다(p<0.05). 또한 두 제품 간에 관능적인 특성도 차이가 없었다(Table 5).
요 약
박테리아 오염은 낙농 산업에서 생산되는 제품의 품질, 기능성 및 안전성에 부정적인 영향을 미치며, 유제품 가공 장비의 표면에 부착되어 성장하는 박테리아 세포의 집합체인 생물막은 유제품 오염의 주 원인이다. 유제품 제조 시설에서 생물막은 CIP 시스템으로 제어되며, 주로 수산화나트륨과 질산이 사용된다. 그러나 이러한 공격적인 화합물의 누출 또는 잔류는 인체에 유해할 수 있다. 따라서 본 연구에서는 식약처에서 식품용 살균제로 인정한 차아염소산나트륨/구연산 조합을 사용하여 기존 시판 제품과 박테리아 제거 효과를 비교해 보았다. 스테인리스 칩에서 10 ppm 차아염소산나트륨/1% 구연산 복합처리시 6 log CFU/cm2가 감소하였다. 현장 제조 공정의 CIP 시스템에 적용하였을 때 처리 전과 비교하여 대장균군은 검출되지 않았고, 일반세균은 0–32 CFU/mL수준이었다. 또한 CIP 처리 후에 염소이온 잔류량은 수돗물과 비슷한 수준이었고, 일반성분도 유의적 차이가 없었다. 따라서 차아염소산나트륨/구연산 CIP 시스템은 유제품 제조 공정에 적용가능한 기술이다.