서 론
요구르트는 공생하는 요구르트 배양체의 유산 발효를 통해 제조된 우유 기반의 제품으로 널리 이용되고 있다[1,2]. 요구르트는 일반적으로 건강 제품으로 인식되고 있으며, 프로바이오틱스(probiotics)와 프리바이오틱스(prebiotics)를 소비자에게 전달하기 위해 사용되고 있다[2]. 그러나, 모든 요구르트가 프로바이오틱인 것은 아니며, 모두 기능성 제품인 것도 아니다[2]. 건강을 증진시키는 음료에 대한 수요가 점진적으로 증가하고 있어, 유제품 업계는 그 수요를 충족시키기 위해 기능성 프로바이오틱 요구르트를 개발하기 위해서 많은 연구를 집중적으로 진행하고 있다. 하지만, 세계 여러 지역의 규제 체계, 임상 시험 결과 및 요구르트에 포함되어 있는 다양한 종류의 프로바이오틱 균주를 열거하기 위한 방법론적 접근법에 대한 중요한 정보를 제공하는 자료는 매우 부족한 실정이다.
따라서 본 총설에서는 기능성 프로바이오틱 요구르트와 관련된 최근의 정보의 문헌을 정리하였으며, 규정 준수가 가장 중요하기 때문에 프로바이오틱 요구르트와 요구르트에 포함된 프리바이오틱 및 프리바이오틱이 아닌 성분에 대한 각 나라별 규제 체계를 비교하여 정리하였으며, 유제품 산업에 인체에 많은 유익하다고 입증된 제품을 판매할 수 있는 기회를 제공하기 위해서는 임상 시험 결과의 필요성을 강조하였으며, 그리고 기능성 요구르트의 프로바이오틱 균주의 검출에 관해서 논의하였다. 무엇보다 요구르트에 첨가된 다양한 종류의 프로바이오틱 종은 요구르트에 포함된 각 균주의 생존 가능성을 결정하는 데 필요한 방법론적 및 분석적 접근에 대한 과학적인 방법이 요구되고 있다. 왜냐하면 이러한 균주들은 유통기한 동안 건강에 도움을 줄 수 있기 위해서는 일정수준 이상으로 균수가 유지되어야 하기 때문이다. 본 총설에서는 요구르트 내 프로바이오틱 세포 수의 계산을 위한 배양 의존적 및 배양 독립적 접근법의 장단점을 비교 및 정리하여 제시하였다.
결론적으로 본 총설에서 다루어진 내용들은 향후 유가공관련 정책 입안자, 낙농업자, 기능성 식품 개발자, 유가공관련 연구소 연구자들에게 기초적인 자료를 제공하는 데 그 목적이 있다. 그리고 모든 자료들은 이미 발표된 다양한 과학적인 문헌 등을 조사하여 재정리하였다.
본 론
발효는 인류만큼 오래된 식품 보존 과정으로 식품과 음료의 유통기한을 연장하고 관능과 영양적 품질을 개선하는 것을 목표로 한다[3]. 발효는 외인성 산화제를 포함하지 않고 유기기질로부터 에너지를 유도할 수 있는 대사 과정이다. 유산 발효는 pH를 감소시킨 식품 매트릭스(matrix)로 이어져 요구르트 및 기타 다른 발효 제품에서 식품 매개 병원균에 가혹한 조건을 만든다[3]. 발효식품은 소비자에게 잠재적인 유익한 효과와 관련이 있다고 세계적으로 알려져 있다[1–3]. 유기산 함량과 산 생산 속도는 요구르트의 점도와 겔화 특성에 영향을 미치므로 일정한 산 생산 속도가 요구된다[2,4]. 특히, 발효유는 생리 활성 펩타이드 또는 박테리오신(발효 배양물질의 단백질 분해 효소에 의해 촉매됨)의 방출, 유당 불내증 소비자에게 이익이 되는 유당 함량의 감소 및 일반적으로 식품의 관능적 품질이 향상으로 이점을 가진다[5].
프로바이오틱 세균은 적절한 양으로 공급되면 숙주에게 건강상의 이점을 주는 살아 있는 미생물이다[2,4]. 다양한 연구 보고에 의하면, 요구르트 또는 발효유는 일반적으로 안전한 것으로 인식되어 있으며 소비자에게 프로바이오틱 미생물 균주를 전달하는 데 가장 일반적으로 사용되는 수단이다[5].
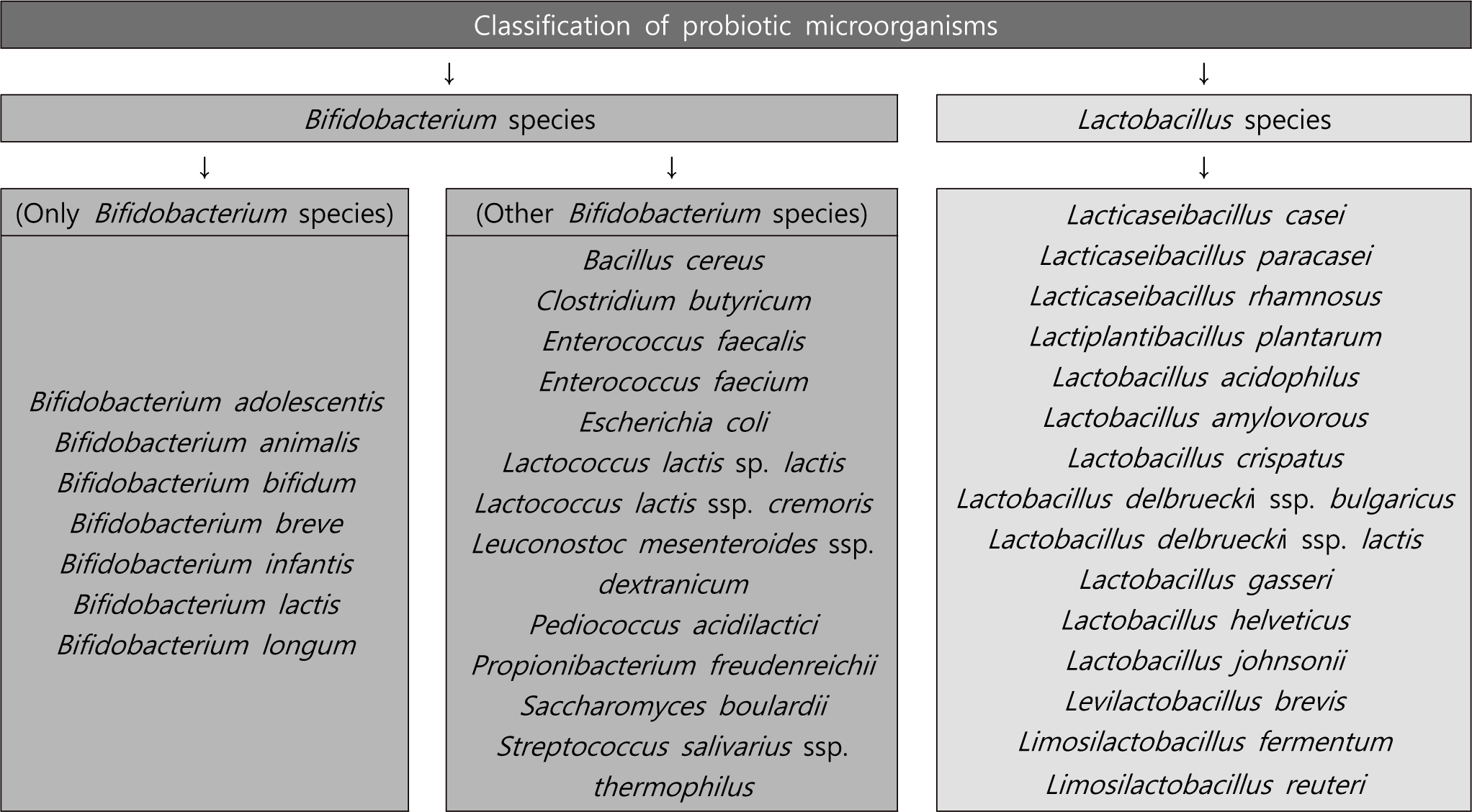
1901년 Lactobacillus delbrueckii가 최초의 Lactobacillus 종으로 명명된 이후, 미생물 분류학 연구자들은 일부 종에 대해 그 연관성이 그렇게 가깝지 않음에도 불구하고 여러 다양한 세균(250종 이상)을 Lactobacillus 속으로 분류하였다[6]. 최근 수년간 정교한 DNA 염기서열화 및 분석을 통해 전문가 패널은 Lactobacillus 속을 25개의 속으로 나누었고 여기에는 L. delbrueckii 그룹으로 지칭된 숙주 적응 유기체인 Lactobacillus를 포함, Paralactobacillus, 그리고 23개의 새로운 속으로 나눌 수 있었는데 여기에는 Acetilactobacillus, Agrilactobacillus, Amylolactobacillus, Apilactobacillus, Bombilactobacillus, Companilactobacillus, Dellaglioa, Fructilactobacillus, Furfurilactobacillus, Holzapfelia, Lacticaseibacillus, Lactiplantibacillus, Lapidilactobacillus, Latilactobacillus, Lentilactobacillus, Levilactobacillus, Ligilactobacillus, Limosilactobacillus, Liquorilactobacillus, Loigolactobacillus, Paucilactobacillus, Schleiferilactobacillus, Secundilactobacillus가 포함된다[6]. 여전히 연구기관의 연구원들과 식품산업에 관여하는 관계자들에게는 이전의 명명법을 사용하고 있을지라도, 최근에 과학기술의 발전으로 현재의 미생물 분류학적 변화에 반드시 관심을 가져야 할 것이다(Fig. 1).
다양한 이로운 점을 살펴보면, 미네랄 흡수, 변비 예방, 혈청 콜레스테롤 감소, 유당 불내증 감소, 혈압의 감소, 대장암 발병 가능성 감소, 장 감염 예방, 염증성 대장 증후군 예방, 그리고 면역 체계의 활성화 등이 있다[4,7,8]. 요구르트 및 기타 발효유 제품은 항산화 활성을 갖는 생리 활성 펩타이드를 축적할 수 있다[9]. 선별된 프로바이오틱 균주에 의해 우유에서 방출된 생리 활성 펩타이드는 안지오텐신 전환 효소(angiotensin-converting enzyme, ACE)를 억제할 수 있다. ACE를 억제하는 것은 혈압 저하 또는 고혈압과 관련이 있다. 생리 활성 펩타이드는 비활성화된 안지오텐신 I(angiotensin I)에서 혈관을 수축시키는 안지오텐신 II(angiotensin II)로의 전환을 차단하여 ACE를 억제한다[10]. 이는 결과적으로 혈관을 확장시키는 브래디키닌(Bradykinin)의 증가를 초래하여 혈압 저하를 초래한다.
Lactobacillushelveticus H9에 의해 발효된 프로바이오틱 우유는 항 고혈압 펩타이드를 가지고 있으며 고혈압과 관련된 문제의 임상적 감소에 기여할 수 있는 ACE를 억제하는 것으로 나타났다[11]. ACE의 억제는 프로바이오틱 접종 크기에 따라 달라지며 7 log10 CFU/mL는 대조군 우유 샘플의 30%와 비교하여 ACE 억제 활성을 70%로 이끌었다[10].
전 세계적 건강 문제인 암은 체내에서 조절되지 않는 비정상 세포의 성장과 확산으로 설명된다. 암세포가 화학요법에 대한 내성이 높아짐에 따라, 이를 대체할 수 있는 치료가 필요하며, 생리 활성 펩타이드는 악성 체세포의 세포사멸 및 병원성 세균 세포의 억제를 유도할 수 있다[12]. 이 기전은 음전하를 띈 암과 세균 세포가 프로바이오틱 우유에서 양전하를 띤 펩타이드에 결합하는 것과 관련 있다[12]. 생리 활성 펩타이드는 음전하를 띤 세포의 막을 파열시켜 세포의 사멸을 초래할 수 있다.
프로바이오틱 제품 개발의 초기 단계는 균주의 선택이다. Lactobacillus rhamnosus GR-1과 Lactobacillusreuteri RC-14를 포함하는 균주는 제품의 유통기한 동안 요구르트 내에서 생존성을 유지할 수 있다[13]. 요구르트 배양액과 프로바이오틱 균주 사이의 비시너지적(nonsynergistic) 상호 작용 가능성으로 인해 선택된 프로바이오틱 균주에 대한 성장 조건을 최적화하는 것이 매우 중요하다.
소비자의 프로바이오틱 기능성 식품에 대한 선호도는 영양학적 주장보다는 건강상의 이점에 더 많이 있으며, 이는 프로바이오틱 균주의 생존성과 관련이 있다[14]. 프로바이오틱 균주의 선택 기준에는 안전성뿐만 아니라 균주의 기술적, 관능적 및 기능적 특성이 포함된다[3]. 안전성 측면에서 Lactobacillus 및 Bifidobacterium 균주는 일반적으로 안전한 것으로 인식되는 GRAS(generally recognized as safe) 상태를 가지며 식품에 포함된 균주 중 가장 많이 연구된 속이다[13].
스웨덴과 핀란드에서는 L. rhamnosus LGG가 대량으로 소비되며, 이로 인한 유산균 균혈증은 보고되지 않는다. LGG를 임산부와 인체 면역 결핍 바이러스를 가진 환자에게 먹였을 때도 부정적인 영향은 발견되지 않았다[2,4]. Enterococcus, Lactococcus, Saccharomyces, Pediococcus 속은 잠재적 프로바이오틱 종을 보유하고 있는 것으로 간주된다[15]. 소비자가 신맛이나 쓴맛을 감지하면 음료의 선호도에 영향을 미칠 수 있기 때문에 적절한 프로바이오틱 배양은 원하는 관능적 특성(질감, 향, 풍미)을 가진 발효 제품의 가공을 가능하게 한다[14]. 배양에 의해 발효된 요구르트에 첨가된 미세 캡슐화된 프로바이오틱 세포는 프로바이오틱 균주로 인해 발생할 수 있는 부정적인 관능 특성을 피할 수 있다[16]. 또는 프로바이오틱 균주로 발생할 수 있는 부정적인 관능특성을 피하기 위해 미세 캡슐화 프로바이오틱스를 발효유에 별도 첨가하기도 한다.
기능성 측면에서 유제품에 포함된 Lactobacillus acidophilus와 같은 종은 혈청 콜레스테롤 감소, 유당 불내증 완화 및 대장암 발병 가능성 감소에 기여할 수 있다[8]. 항균 대사 산물(산 및 박테리오신)은 생물 보존(병원균 억제)에 기여할 수 있으며 건강상의 이점을 제공할 수 있다[3]. 기술적으로, 요구르트에 프로바이오틱을 포함시키는 것은 냉장 보관 시 균주별 생존 어려움(낮은 pH 및 높은 산도)의 차이와 불충분한 단백질 분해 효소로 인한 프로바이오틱의 느린 성장으로 인해 어렵다[17]. 제품 내 미생물 배양 간의 상호 작용은 요구르트 스타터 배양의 성장과 프로바이오틱의 생존성에 영향을 미칠 수 있다[18]. 특히, Streptococcus thermophiles(스타터 컬쳐)는 프로바이오틱 균주의 건강 증진 잠재력을 약화시키는 것으로 보고되었다[18]. 또한, 프로바이오틱의 생존에 대한 해로운 영향은 요구르트에 첨가되는 성분에 대한 민감도와 산도, pH, 온도, 산소 농도 및 유익한 박테리아의 생존에 영향을 미치는 기타 요인을 포함한 가공 및 저장 조건과 관련이 있다[18]. 요구르트 내 프로바이오틱 균주의 성장 및 생존과 관련된 긍정적인 결과를 보고하는 수많은 연구가 있다. 카더멈(cardamom), 육두구 또는 계피를 첨가한 모든 요구르트는 5×107–108 CFU/g 범위의 프로바이오틱 균주 LA5를 갖는 반면, 프로바이오틱 Bifidobacterium 균주 Bb12를 포함하는 샘플은 유통 기한 28일 후 106–107 CFU/g 범위의 균 수를 가졌다[19].
스타터 배양 및 프로바이오틱 L. rhamnosus DSA LR1의 균 수는 4℃에서 20일 저장 후 7 log10 CFU/mL 이상으로 유지되었다[17]. 이는 유산균 플레이팅 기술과 PCR-변성 구배 젤 전기영동(PCR[polymerase chain reaction]-denaturing gradient gel electrophoresis) 분자 기술에 의해 확인되었다[17]. 요구르트 내 비캡슐화 및 캡슐화 프로바이오틱 균주 L. acidophilus LA5는 냉장 보관 35일 이후에 각각 1.58×107 CFU/g와 1.12×107 CFU/g의 생존성을 보였다[20]. 프로바이오틱 균주의 존재는 스타터 배양의 생존성에 영향을 미치지 않았다. L. bulgaricus와 S. thermophilus는 캡슐화되지 않은 프로바이오틱 균주가 함유된 요구르트 내에서 각각 7.99×106 CFU/g과 4.5×108 CFU/g 씩 존재했고, 캡슐화된 프로바이오틱 균주 LA5가 함유된 요구르트 내에서 각각 1.91×106 CFU/g과 6.92×108 CFU/g씩 존재하였다[20]. L. helveticus 균주(R0052, LBK-16H, H9, CP790)와 같은 락토바실러스는 권장되는 최소한의 수준 이상으로 세포 수를 유지하는 능력으로 인해 발효 스타터 배양 또는 식품 첨가물로 사용되는 것으로 보고된다[10]. 본질적으로, 앞서 말한 연구 결과는 요구르트 배양물을 포함하는 요구르트 내 프로바이오틱스의 생존성이 첨가제, 요구르트 배합 성분, 가공 조건, 저장 시간, 프로바이오틱 세포를 측정하는 방법, 선별적이고 차별적인 방법의 사용과 관련한 품질 관리 작업자의 전문성과 같은 요인뿐 아니라, 종 및 균주에 따라 다르다는 것을 나타내는 것이다[2].
L. rhamnosus는 프로바이오틱스 식품 및 보충제에서 가장 많이 연구되고 사용되는 종 중 하나이다[3]. 틀림없이, L. rhamnosus LGG는 가장 철저하게 연구된 프로바이오틱 균주이다[3,4]. 균주LGG의 선택은 보고된 프로바이오틱 특성(담즙 저항성, 위산 저항성), 장 내 대량 서식(집락형성)하는 능력, 지표 병원균의 억제 및 면역계의 자극과 관련이 있다[2,3].
L. rhamnosus 균주는 비교적 다량의 유산을 생산한다[21]. 따라서, L. rhamnosus의 최적 성장은 pH 4.2에서의 성장이 pH 5에서의 성장보다 상당히 우수하게 때문에 pH 수치의 영향을 받는다[3]. 요구르트가 L. rhamnosus의 전달 매체로 사용되는 경우, 요구르트의 낮은 pH에 의해 보다 가변적으로 억제되는 다른 종(Bifidobacterium longum, Bifidobacterium bifidum, Lactobacillus casei 및 L. acidophilus)과 달리 그렇게 많은 영향을 받지 않는다[2,3]. 그러나 Bifidobacterium 균주 중 가장 연구가 많이 된 Bifidobacterium animalis ssp. lactis BB-12는 기술적으로 산소에 내성이 있고, 대부분의 lactobacilli와 달리 유당 대사를 통해 우유 내에서 증식하며, 저장 중에 높은 생존률을 유지하고, 상당한 프로바이오틱 특성과 건강상의 이점을 나타내므로 제조업체가 요구르트 및 기타 유제품을 소비자에게 전달하는 매체로 사용하여 전세계적 마케팅에 적용할 수 있도록 하는 것이 합리적으로 가능하다[22]. 요구르트 및 기타 음료에 첨가하기 위해 선택된 프로바이오틱스는 건강을 증진하고, 기술적으로 적합해야 하며 요구르트 배양물과 잘 맞아야 한다.
일반적으로 절차 및 규정은 S. thermophilus와 L. bulgaricus를 그들 간의 공생 관계로 인해 요구르트 생산 시 스타터 배양으로 사용하도록 규정하고 있다[4]. 그러나 요구르트 스타터 컬쳐는 담즙과 위산의 환경조건에 상당한 저항성을 가질 수 없기 때문에 위장관에서 생존력 및 생존을 저해하므로 꼭 프로바이오틱으로 간주되는 것은 아니다[2]. 그럼에도 불구하고 요구르트 배양은 우유 내 유당의 발효로 인한 유당불내증을 개선할 수 있다. 요구르트 배양은 또한 면역 방어를 강화하고 설사를 줄이거나 예방하는 데 도움이 되는 것으로 나타났다[23]. 앞서 언급한 잠재적인 이점과 관련하여, 요구르트 배양은 프로바이오틱 특성을 가진 것으로 간주될 수 있다[23]. 비록 요구르트 배양이 유당의 소화를 향상시키기는 하지만, 프로바이오틱 잠재력을 반박하는 상반된 보고가 있다. 인간의 위장관에서 확인된 높은 생존성을 유지하는 요구르트 배양이 반드시 숙주(사람)에게 건강상의 이점을 제공하는 것은 아닐 수 있다는 점에 유의해야 한다[23]. 임상 시험에서 입증된 바와 같은 관련 임상 효과가 있어야 한다. 요구르트 배양의 프로바이오틱 잠재력을 반박하는 것은 요구르트 스타터 배양이 catechin, epigallocatechin gallate, epigallocatechin, catechin gallate 및 epicatechin gallate와 같은 녹차에서 페놀 화합물을 대사할 수 없다고 주장하는 일부 연구자들과 관련된다[9]. 이는 일부 프로바이오틱 락토바실러스가 식품에서 페놀 화합물을 대사하는 것으로 보고된 사실과 비교될 수 있다[9].
프로바이오틱으로 간주되는 제품에는 프로바이오틱 세균의 단일 균주 또는 복합 균주(동일한 종 또는 속의 여러 균주)가 포함될 수 있다[24]. Lactobacillus와 Bifidobacterium 종은 1950년대 이후 각각 1,265종과 625종 이상의 임상시험에서 가장 많이 연구되고 있다[25]. 대부분의 프로바이오틱 균주는 역사적 기간 동안 소비되었던 발효 음료에서 얻어진다는 점을 고려하면, 이러한 균주들은 유럽 식품 안전청(European Food Safety Authority, EFSA) 및 미국 식품의약품 안전청(Food and Drug Administration, FDA)이 인정한 GRAS이다[24]. 잠재적 프로바이오틱 균주의 안전성 평가의 핵심은 종 수준에서 분류학적 문을 확인하는 것뿐 아니라 관찰된 내성이 내인성(전이할 수 없는)인지 또는 후천적(전이할 수 있는)인지 여부를 입증할 필요가 있는 항생제 내성 유전자를 분석하기 위한 특정 균주의 전장 유전체 분석이다[26]. 잠재적 프로바이오틱스 균주의 효소 활성, 예를 들어 담즙염 가수분해효소(bile salt hydrolase, BSH) 활성 및 용혈 활성도는 규정된 것에 의해서 평가할 필요가 있다[26]. 중간 정도의 BSH는 담즙염을 가수분해하여 혈중 콜레스테롤 수치를 낮출 수 있으나 고농도 BSH 활성은 잠재적으로 지질 대사를 저해하고, 담석의 축적에 기여하는 것으로 보고되었다[27]. 또한 안전성 평가를 실시함에 있어 프로바이오틱 생리적 기능, 대상자의 건강 상태, 투여 방식(액체 또는 분말) 및 관련된 프로바이오틱 균주와 같은 사항을 고려할 필요가 있다[27]. 프로바이오틱스의 안전성에는 프로바이오틱 균주의 잠재적 부작용과 프로바이오틱 음료 및 식품 내 오염 물질에 의해 생성된 독소의 잠재적 감염 또는 영향의 두 가지 측면이 있다[24].
그럼에도 불구하고, 일부 보고에 따르면, Lactobacillus 균주로 인한 패혈증 사례와 진균 독성 곰팡이로 인한 음료의 오염과 관련된 미숙아의 위장 털곰팡이증으로 인한 사망을 지적하였다[24,27]. 다종의 프로바이오틱 제품을 투여 후 급성 췌장염을 앓고 있는 취약 환자에서도 사망 위험이 증가한 것으로 보고되었다[24]. 따라서 취약한 그룹(미숙아, 유아, 노인, 입원 환자 또는 면역력이 약한 사람), 특히 인간 면역결핍 바이러스(human immunodeficiency virus, HIV)의 경우, 간 질환자, 염증성 장 질환, 손상된 점막 또는 면역 조절 장애가 있는 사람에게 프로바이오틱스를 투여할 때에는 안전성을 심각하게 고려하는 것이 좋다[2,24,27]. 프로바이오틱 제품에 포함되어 일부 병원의 환자에게 투여된 Saccharomyces boulardii는 중환자 또는 면역력이 약한 사람의 진균혈증과 관련이 있었다[24,27]. 반면 HIV 감염자가 항레트로바이러스 치료를 받고 프로바이오틱 보충제를 투여받은 경우 부작용을 겪지 않았다고 보고하였다[24]. 실제로 환자들은 면역에 이로운 효과와 장 상피 장벽의 기능이 향상되었다. 그러나 이 결과가 항상 적용 가능한 것은 아니라고 가정하는 것이 더 실질적이다. 주의할 점은 프로바이오틱 균주가 감염에 관여한 대부분의 경우에서, 관련된 개인들은 면역력이 저하되었거나 심각한 근본적인 건강 문제를 가지고 있었다는 것이다[2,28].
숙주의 장에서 프로바이오틱의 수치를 높이는 것만으로는 건강(기능성) 강조 표시에 대한 승인을 기대하기에 충분하지 않다[14]. 효능이나 임상 결과에 대한 증거는 규제 당국에 제출해야 한다. 보고서에 따르면 프로바이오틱이 건강에 도움이 된다는 주장은 대부분 시험관내(in vitro) 및 동물 생체 내 모델(in vivo)을 기반으로 하고, 임상시험을 기반으로 하는 경우는 이보다 적다[25]. 그러나 시험관내 및 동물 체내 평가 결과를 인간의 결과로 추정하지 않는 것이 좋다. 프로바이오틱의 효능은 잘 설계된 인간 임상 시험에 따라 조사, 확인 및 승인되어야 한다[25]. 하지만 프로바이오틱 유제품의 유효성을 평가하기 위한 임상 시험이 부족하다[25]. 몇몇 연구자들은 임상 시험과 관련된 보고서가 몇 개밖에 없으며, 사용 가능한 보고서는 완전한 무작위, 이중 맹검, 위약 대조 시험이 아닐 수 있음을 주장하였다[2]. 일반적으로 지금까지 수행된 인간 임상시험의 수는 충분하지 않으며 수행된 임상 시험은 과학적으로 허용 가능한 통계적 유의성을 갖기에 충분하지 않을 수 있다[25]. 많은 수의 임상 시험이 건강한 참가자를 대상으로 수행되어 치료 효과를 확인하기 어렵다. 따라서 건강에 도움이 된다는 주장이 사실임을 확인하는 것과 관련된 과제 중 하나는 기능성 제품을 마케팅 하기 전에 비용이 많이 들고 시간이 많이 걸리는 무작위, 이중 맹검, 위약 대조 임상 시험을 수행해야 한다는 것이다[14,25].
유럽식품안전청(EFSA)은 유효성 부족, 부적절한 특성화, 영양 및 생리적 향상에 대한 설득력 없는 유익한 효과, 임상 시험에서 위약과 무작위화의 부족, 임상 시험에 대한 품질 및 과학적 설계의 부재로 인해 제조업체가 제출한 건강에 도움이 된다는 모든 주장을 거부하였다[25]. 미국에서는 임상 시험의 실제 결과와 관련된 중요한 정보를 제공하는 임상 가이드를 사용할 수 있으며, 정기적으로 업데이트된다[2,25]. 따라서 (1) 무작위 임상 시험, (2) 통제된 코호트(controlled cohort) 또는 환자-대조군(case-control) 시험, (3) 체계적인 분석 및 전문가 보고서의 3가지 단계의 임상 평가를 수행하는 것이 좋다[25].
유엔 식량 농업 기구와 세계 보건기구(FAO/WHO, 2002)가 제공하고 전문가 위원회에 의해서 2013년 수정된 정의에 의하면, 요구르트에 포함된 미생물은 풍부하고 생존력이 높아야 한다고 되어져 있다[2,4]. 제품 라벨에 프로바이오틱이라는 단어를 사용하는 것은 세계의 일부 지역에서 제한된다. 유럽 연합(EU)에서 프로바이오틱이라는 단어를 사용하는 것은 건강(기능성) 강조의 표시로 이해되며 라벨에 포함하기 위해서는 EFSA의 승인이 필요하다[14]. EFSA는 GRAS 균주가 포함된 제품 라벨에 프로바이오틱이라는 단어의 사용을 허용하지 않는다[24]. 이는 프로바이오틱이라는 용어의 사용을 허용하는 FDA 입장과 대조적이며, FDA는 여러 변종이 인체 섭취에 안전한 것으로 여긴다[24]. 그러나 캐나다와 미국에서는 제조자가 제품의 프로바이오틱 균주에 대한 임상 증거를 제공해야 하며, 제품에 여러 균주가 포함된 경우 임상 증거는 일부를 통한 추정이 아닌 전체 조합에 대한 것이어야 한다[25]. 캐나다의 경우, 이 규정은 요구르트로 표시된 유제품이 두 가지 특징적인 배양물이 있음을 공표하도록 요구한다[23]. 음료에 포함된 프로바이오틱 균주의 생존율은 제품의 유통기한 동안 유지되는 명시된 1회 제공량 당 최소 1.0×109 CFU이어야 한다.
일본의 후생노동성은 1991년에 기능성 식품에 대한 특정 보건용 식품(foods for specified health uses, FOSHU) 지침을 제정하였다[29]. FOSHU 지침의 사용을 통해, 과학적으로 입증되고 건강에 도움이 된다는 주장이 증명된 활성 성분을 포함한 식품 및 음료는 제품 라벨에 FOSHU 태그를 부착하도록 승인된다[29]. EFSA 규정과 달리 일본에서는 유효 성분이 정부의 승인을 받은 경우, 유효 성분이 포함된 제품의 라벨에 FOSHU 태그를 부착할 수 있다[29]. EFSA는 활성 성분을 함유한 제품을 사용하여 임상 시험을 수행해야 하며, 활성 성분만으로는 임상시험을 수행할 수 없다[30]. 인도에는 프로바이오틱 제품에 대한 규제 기관이 확립되어 있지 않은 것으로 보인다[30]. 보고된 바에 따르면, 인도의 의학 연구 위원회는 건강 기능성의 잠재적인 효능을 추론하기 위해 제품 내 프로바이오틱 균주를 평가하기 위한 가이드 라인 편집에 나섰다[30]. 중국 식품의약국은 유럽의 EFSA와 유사한 인간 임상시험과 개입에 대한 요구 사항을 규정하고 있다. 그러나 중국은 인간의 임상 시험 결과가 여전히 뛰어난 경우, 동물 모델 기반의 입증된 건강 증진 효과에 대한 주장을 수용한다[30]. 요구르트에 관련하여 브라질 법률은 기존 요구르트 내 유산균의 총 생존율은 유통 기한 동안 7 log10 CFU/mL 이상이 되도록 요구하고 있다[31]. 호주에서는 요구르트에 ABT 배양이 허용되며, 이 경우 주요 미생물은 L. acidophilus, Bifidobacterium 및 S. thermophilus이다[23]. 미국 FDA는 성분과 관련하여 배양된 우유가 최소한 3.25%의 유지방, 8.25%의 무지 고형분, 그리고 유산으로 표현되는 0.5%의 적정 산도를 포함해야 한다고 요구하고 있다[32]. 이 규정은 또한 비타민 A와 D를 강화시킬 수 있다[32]. 미국 표준은 요구르트 스타터 배양물이 있는 요구르트의 생산을 요구하며, 요구르트에 프로바이오틱 배양물을 첨가할 수 있다[23]. 미국 요구르트 생산 규정(US FDA, 2019)에서는 요구르트를 요구르트 배양(L. delbrueckii ssp. bulgaricus 및 S. thermophilus)을 사용하여 처리한 유제품으로 설명하지만, 다른 유산균도 요구르트에 포함될 수 있다[32].
남아프리카 공화국에는 요구르트의 기준과 관련된 두 가지 규정이 있다. 첫 번째 규정은 보건부(Department of Health, DOH)에서 제공한다. DOH에 따르면 요구르트 제품 라벨에 프로바이오틱이라는 단어를 사용하는 것은 식품의 라벨링 및 광고와 관련된 국가의 개정된 규정에 의해 허용되지 않는다[2,33]. 요구르트에 포함된 미생물과 관련된 기능성 식품의 표시는 요구르트 배양이 L. delbrueckii ssp. bulgaricus 및 S. thermophilus를 포함하는 경우에만 가능하다. 이 규정은 또한 유제품 요구르트의 배양 균 수가 108 CFU/g 이상인 경우 “요구르트 배양물은 유당을 잘 소화하지 못하는 사람에서 유당 소화를 개선시킨다”와 같이 기능성 식품에 대한 문구를 명시해야 할 것을 포함한다[33]. 두 번째 규정은 남아프리카 농무부(Department of Agriculture, DOA)로부터 제공되며 이 규정은 DOH의 규정과 다소 상충이 된다[34]. DOA의 규정(R.260), 1990년 남아프리카 농산물 표준법(1990년의 119번 법령, 2015년 남아프리카 농무부)의 개정판에 따르면, 요구르트 배양은 L. delbrueckii ssp. bulgaricus 및 S. thermophiles, 또는 요구르트 제조에 사용되는 다른 유사한 배양물로 구성된 것으로 정의된다[34]. 요구르트 및 드링크 요구르트에 대한 표준에 따르면, 요구르트 및 드링크 요구르트는 최종 제품에 최소 107 CFU/g의 요구르트 배양물을 포함해야 한다[34]. 또한 이 표준은 요구르트에 다른 특정 미생물을 추가하는 것을 허용(요구르트 배양을 보충하기 위해)하며, 이 경우 제품 내 미생물의 존재 여부를 라벨에 표시해야 하며 생존 가능성은 각 특정 미생물에 대해 최소 107 CFU/mL 이상이어야 한다[34]. 추가적인 특정 미생물에 대한 분류학적 명명법이 요구르트 제품 라벨에 포함될 수 있지만, 프로바이오틱으로 표시할 수는 없다. 남아프리카 공화국의 규정을 요약하자면 R.429는 제품 라벨에 프로바이오틱이라는 단어의 사용을 허용하지 않는다. 1990년 개정된 농산물 표준법(R.260, ACT No. 119 of 1990)은 분류학적 명명법과 최소 균 수 수준만 제품 라벨에 첨부되어 있다면 특정 프로바이오틱 균주를 요구르트 제품에 혼합하는 것을 허용한다[2]. DOH의 규정은 108 CFU/g을 요구하지만, DOA의 규정은 요구르트 제품 라벨에 표시된 모든 종에 대해 107 CFU/g을 규정한다[2]. 이러한 차이점을 또한 인식하고 주의깊게 살펴보아야 할 것이다.
프리바오틱의 정의는 건강상의 이점을 제공하는 숙주 미생물이 선택적으로 사용하는 기질로 수정되어 왔다. 폴리페놀, 다중 불포화 지방산과 같은 물질은 대상 숙주에서의 증거를 설득력 있는 증거로 가정하면 업데이트된 정의에 적합할 수 있다[2]. 일반적으로, 이눌린, 갈락토올리고당, 프락토올리고당, 올리고프락토즈, 저항녹말, 락추로스, 폴리덱스트로스는 발효, 냉장 보관 또는 장내에서 유익균의 성장이나 증식을 촉진하기 위해 유제품에 첨가되는 주요 프리바이오틱 성분이다[12,14]. 몇몇 연구자들이 보고에 의하면 특정 견과류, 곡물 및 과일은 프리바이오틱스로 요구르트에 첨가될 수 있지만, 잠재적으로 물리화학적 매개변수, 질감, 유동학에 영향을 미칠 수 있으며 신중하게 선택하지 않으면 유통기한 중 냉장 보관 기간 동안 요구르트의 소비자 선호도를 부정적으로 바꿀 수 있다[12,25]. 요구르트 내의 특정 프로바이오틱 균주의 성장과 생존성은 요구르트에 첨가하는 프리바이오틱 성분의 종류 및 농도에 따라 달라진다는 점에 유의할 수 있다[8,25].
역사적으로, 요구르트 소비는 건강과 웰빙 향상에 대한 믿음과 연관이 있다[25]. 소비자에게 미치는 요구르트의 잠재적 건강상의 이점에 대한 인식은 기능성 비프리바이오틱 성분이 포함된 요구르트 신제품을 혁신하고 시장에 내놓으려는 식품업계의 열망을 이끌었다[14]. 프리바이오틱에 대한 현재의 정의를 제안하는 것 외에도 프리바이오틱 효과를 난소화성 물질의 대사를 통해 장내 미생물의 총 구성 및 활성을 조절하며 발생하는 유익한 생리학적 결과로 정의한다[35]. 프리바이오틱 효과는 프로바이오틱스, 미네랄, 비타민, 어유, 섬유질, 피토스테롤(또는 스테롤), 오메가3 지방산, 폴리페놀, 이소플라본, 생리활성화합물, 가수 분해된 유청 단백질 등을 포함할 수 있는 비프리바이오틱 기능성 성분을 통해 실현될 수 있다[25]. 피토스테롤(식물성 영양소)은 콜레스테롤 감소 능력을 가지고 있으며, 이소플리본은 강력한 항산화제이며, conjugated linoleic acids는 항 아테로겐성(anti-atherogenic) 물질이며, 총 콜레스테롤을 억제하고 일부 인간 암세포주의 성장을 억제할 뿐만 아니라 면역 체계를 조절하고 성장을 촉진한다[14]. 하지만, 일부 비프리바이오틱 기능성 성분에는 기술적인 문제가 있다. 예를 들어, 오메가3 지방산은 약간의 비린내가 있으며 열, 공기, 빛에 민감하고 피토스테롤과 이소플리본은 소수성으로 무지방 식품 매트릭스에 첨가하기 다소 어렵다[14].
프로바이오틱 음료는 안전성, 품질 및 기능적 요건을 준수해야 한다[36]. 첫째, 제품의 프로바이오틱 미생물이 라벨에 명시된 치료 목적의 최소 수준 이상으로 측정되어야 한다[36]. 규제 조건에 부적합이 보고되었다면, 적절한 방법을 이용하여 프로바이오틱 미생물의 활성을 조사하는 것이 중요하다[36]. 배양 의존적(culture-dependent) 접근법은 프로바이오틱 균체수 수준을 분석하는 방법 중 하나이다.
발효 이후 소비까지의 기간 동안 프로바이오틱 세포가 살아 있을지라도 기능을 저하시키는 스트레스를 받을 수 있다[4,36,37]. 이는 평판계수법이 프로바이오틱 균 수의 규모를 반영할 수 있지만, 스트레스를 받은 세포의 비율을 나타낼 수는 없다는 의미이다[4]. 그럼에도 불구하고, 생존 가능하지만 배양할 수 없는(viable but nonculturable, VBNC) 또는 스트레스를 받은 프로바이오틱 세포가 숙주에게 건강상의 이점을 제공할 가능성이 있다[2]. 프로바이오틱 생존성 평가를 위한 배양 의존적 기술은 경우에 따라 72–96시간의 긴 배양기간을 갖는 등 노동적이고 시간 집약적인 문제가 있다[37]. 요구르트의 프로바이오틱스 분석에서의 또 다른 문제는 표준화된 차등 또는 선택적 카운트 방법이 거의 없다는 것이다. 여기에는 L. acidophilus 분석을 위한 ISO(International Organization for Standardization, 국제표준화기구) 20128과 Bifidobacterium 분석을 위한 ISO 29981 등의 국제표준화기구(ISO) 방법이 포함된다[36,37]. 이는 요구르트에 포함되는 대부분의 프로바이오틱스가 유산균(lactic acid bacteria, LAB) 그룹에 속하고 거의 유사한 배양 및 대사 요구 조건을 가지는 스타터 배양균과 밀접한 관련이 있다[4,36,37]. 이는 동일한 제품에 혼합되어 있는 밀접하게 연관된 프로바이오틱 균주를 성장시키고 분화시키는 동시에 요구르트 스타터 배양을 억제하기 위한 적합한 배지를 찾아야 하는 필요성을 더 복잡하게 한다. 반면에, 스타터 배양은 프로바이오틱 균주 이상으로 자랄 가능성이 있다. 그러므로, 요구르트에 포함된 프로바이오틱스 분석을 위해서 배양 의존적 평판 계수 기술은 적절한 배지와 조건을 사용하며 현명하게 사용해야 한다.
Lactobacillus 속에 속하는 프로바이오틱스는 De Man, Rogosa and Sharpe(MRS) 배지로 분석할 수 있는 반면, 요구르트 제조의 주 배양균인 S. thermophilus 및 L. bulgaricus는 pH 6.8의 M17 배지에서 분석할 수 있다[13]. 유산균을 선택적으로 분리하기 위해서 사용되고 있는 이러한 배지에 다양한 첨가제를 추가하여 배지를 더 선택적으로 만들 수 있지만, 첨가된 성분의 양과 분석 조건의 표준화는 반드시 필요하다[2]. pH 5.2 MRS 배지 또는 pH 5.3의 clostridial 배지는 L. bulgaricus(백색, 거칠고 불규칙한 직경 1.0 mm의 콜로니) 배양을 위해, S. thermophiles 배지는 S. thermophilus(황색의 둥글고 직경 0.1–0.5 mm) 콜로니 배양을 위해 사용한다[13]. 하지만 배양 의존 측정법에도 어려움이 있다. 일부 유산균 프로바이오틱 균주를 분석하는 선택적 배지나 기술을 이용할 수 있지만, 동일한 종의 모든 균주에는 적용되지 않을 수 있다[36,37]. Bifidobacterium 속의 프로바이오틱스 종을 분석하고 구분하기 위한 분별 배지는 없으며, 이는 식음료에서 하나 이상의 종에 대한 함량을 복잡하게 한다[36,37]. 선택 분별 배지의 사용은 세포 생존성과 관련된 확실한 결론을 제공하기 위해 시도되고 검증된 기술이 필요한 주관적인 결정에 어느 정도 의존한다. 다행히도, 식품에서 프로바이오틱 균주를 분석하기 위한 배양 의존적 방법의 발전과 진보가 있었다. 예를 들면, 비피도박테리아의 선택적 분석을 위한 무피로신(항생제) 기반 배지가 개발되기도 하였다.
유세포 분석(flow cytometry, FC)은 세포 분류 정량 방법 중 하나이다. 세포나 입자의 물리화학적 특성을 동시에 평가할 수 있다[36]. 이 방법은 세포 구성 요소에 형광 염색을 하여 세포막 보존성, 세포질 pH, 세포 내 효소 활성 및 세포 막 전위 등의 살아 있는 세포의 생리적 특성을 분석하는 데 도움이 되고 세포가 염색될 때 세포의 생존성 정도가 반영된다[36]. 유세포 분석으로 식품의 프로바이오틱 세포 분석 및 오염 물질을 검출할 수 있다. 유세포 분석은 초콜릿 내의 L. rhamnosus R0011의 총 세포 수(total cells)와 살아 있는 세포 수(viable cells)를 분석하는 데 성공적으로 사용되어 왔다. 유세포 분석은 TFC(total cells measured by FC, 총 세포 수)와 VFC(viable cells measured by FC, 살아 있는 세포 수)를 구별하여 죽은 세포 수를 확립하는 데 사용할 수 있다. VFC(살아 있는 세포 수)는 콜로니 형성 단위 형태로 얻어진 수의 두 배에 해당된다. 표적 종에 대한 다 클론 항체에 적용되는 종에 기반한 분석적인 유세포 분석 방법을 통해 ISO 표준 평판법으로 72시간 대시 2시간 만에 4개의 프로바이오틱 유제품에서 Bifidobacterium lactis를 신속하게 분석할 수 있었다[38]. 요구르트 및 기타 식품의 미생물을 분석하기 위한 유세포 분석에 있어 어려움은 분석에 잠재적으로 영향을 미칠 수 있는 식품 입자의 존재와 관련이 있다. 유세포 분석은 요구르트에서 스타터 배양 세포와 프로바이오틱 세포를 구분하기 위해 생존 가능한 균주 염색과 특정한 항체 라벨링을 신중히 결정해야 한다.
이러한 접근 방식은 PCR, 역전사 효소 PCR(reverse transcriptase-PCR, RT-PCR) 및 실시간 정량 PCR(real time-quantitativePCR, RT-qPCR)이 있다. PCR 기법은 손상 받지 않은 살아 있는 세포의 온전한 DNA만이 증폭된다는 가정하에 프로바이오틱 미생물의 생존성을 확인하는 데 사용될 수 있다[36,39]. 하지만, 온전한 DNA가 세포 생존성을 의미하지 않을 수 있다는 점을 유의해야 한다[36]. RT-PCT은 RNA 전사를 통해 시퀀스가 개별적으로 증폭되어 역전사 효소에 의해 활성화된 DNA를 형성할 수 있는 PCR의 변형이다[36]. 이 경우, 프로바이오틱 세포 생존 가능성 가정은 mRNA 표지의 반감기가 매우 짧기 때문에 죽은 세포의 경우 전사가 일어나지 않으며 표적 서열 증폭이 관찰되지 않는다는 사실을 기반으로 한다[36,39]. 성공적인 mRNA전사는 세포 생존성을 더 잘 암시할 수 있지만, 리보솜RNA(rRNA)은 세포 생존성 또한 확인할 수 있다[36]. RT-qPCR 기술은 증폭을 가능하게 하기 위해 형광 리포터(reporter) 염료를 사용하는 DNA 증폭을 수반하며, 동시에 단일 튜브 형태로 PCR 반응의 검출 단계를 결합한다[36]. 이 RT-qPCR 기술은 식품 시료의 DNA 주형(template)에 있는 표적 DNA 서열의 풍부함을 측정함으로써 샘플 미생물을 정량화를 가능하게 한다[36,40]. RT-qPCR 방법은 요구르트 제품에서 살아 있는 세포와 죽은 세포의 DNA를 구분하는 데 어려움이 있다[40]. 요구르트와 건강에 대한 건강 주장은 프로바이오틱 균주의 생존성과 연관 있기 때문에 배양에 의존하는 분석법의 한계는 추가적인 정보를 찾기 위한 분자 기술로 연결된다.
이러한 두 가지 기술은 살아 있는 세포 검출로 제한하기 때문에 생존 PCR(viability PCR, vPCR) 이라고 할 수 있다[36]. 기술의 원리는 EMA 염료가 손상되거나 손상된 막이 있는 세포의 DNA에 침투하여 삽입되지만, 손상되지 않은 정상 세포에는 염료가 들어가지 않는 것이다[39,40]. 따라서, EMA 염료 처리 후 DNA 분리가 이루어지면, RT-qPCR 분석 시에 EMA 염료와 반응한 DNA는 적절히 증폭되지 않고 EMA 염료가 없는 정상세포는 충분히 증폭한다[39,40]. 이 경우, 손상된 막을 가지고 있지만 여전히 대사적으로 활성화된 상태인 세포의 존재는 대조군에 비해 log10 단위가 낮고, 이는 생존성의 감소를 의미한다. 문제는 일부 손상되지 않은 정상세포가 EMA 염료를 흡수할 수 있는 가능성이다. EMA-PCR과 비슷한 윈리를 이용하는 PMA-PCR 기술은 정상 세포가 EMA 염료를 흡수할 가능성에 대응하기 위해 개발되었다[36,39]. PMA 염료는 살아 있는 세포에 영양을 미치거나 흡수되지 않는다[39]. 하지만, 고농도에서 세포 생존성이 저하될 수 있다. PMA-PCR 기술은 식음료의 가공 혹은 저장 조건에 기인할 수 있는 세포 사멸 추세를 설명할 수 있다[39]. PMA는 젤 전기영동으로 손상되지 않은 세포를 검출하는 것으로 제한될 수 있다[39,40]. PMA-RT-qPCR이 죽은 세포에서 L. delbrueckii ssp. bulgaricus 균주 ND02의 살아 있는 세포를 구별할 수 있음을 보여주었다[39]. 요구르트와 같은 불투명한 제품을 취급할 때 PMA-PCR에 대한 문제가 발생하지만, 이는 빛 대신 촉진제를 사용하여 DNA-PMA 삽입을 유도하거나 온도나 pH를 조절하여 탁도를 변화시킴으로써 해당 문제를 해결할 수 있다[36].
고급 분자 분석법 발전 추세는 음료에 포함되는 미생물 종의 다양성과 풍부성을 조사함에 있어 생물 정보학 및 대사체학에 관련된 고급 배양독립법, 고 처리량, 서열 기반 미생물 분석이다[13]. 이러한 접근법은 프로바이오틱 음료와 인간의 장 내 미생물의 다양성과 풍부성(각 종의 종류와 생존성)을 결정하고 장내 미생물군에 대한 프로바이오틱스 효과를 결정하기 위해 사용된다[41]. Illumina와 Ion torrent(Thermo Fisher Scientific, South Africa)를 포함한 차세대 시퀀싱(next generation sequencing, NGS) 기술은 유전체학 분석에 가장 많이 적용되는 기술이다[41]. 이외에도 Pacific Biosciences 단일분자 실시간 시퀀싱, 454 파이로시퀀싱, SOLiD 기술이 있다. NGS 접근법에는 16S rRNA 앰플리콘 시퀀싱, 16S rDNA 계통 발생의 마이크로어래이, 균유전체 시퀀싱이 포함된다[41]. NGS 접근법은 숙주가 잠재적인 효과를 얻는 데 중요한 제품 내 세균 세포의 생리적 상태나 생존 가능 프로바이오틱스 모집단의 정확한 정량화를 가능하게 하지 못할 수 있다는 점에 유의해야 한다[42]. 따라서 샘플 제품에서 배양 가능한 표적 프로바이오틱스를 결정하기 위해 분자 고처리량 기법을 정량 PCR 및 무작위 증폭 다형성 DNA-PCR분석과 결합하는 것을 고려할 것을 권고한다[42]. NGS 접근 방식은 빠르고 신속하게 결과를 제공할 수 있지만, 올바른 분석 소프트웨어를 사용하고 유전체학 정보를 분석(건전한 결론을 내리기 위해)하는 데 필요한 장비 비용과 생물 정보학 및 기술 전문성이 더 진보된 배양 독립 기술을 적용하는 데 장애가 될 수 있다.
프로바이오틱스의 잠재적인 건강상의 효과는 무작위 위약 대조 시험으로 지칭되는 체외 및 체내 임상 실험에서 평가할 수 있다[13].
프로바이오틱 균주의 건강 증진 잠재력은 요구르트와 같은 유제품을 고려하고 포함하도록 한다.
프로바이오틱스의 주요 항균 활성은 과산화수소, 유기산, 펩타이드, 또는 박테리오신 분비에 기인한다[3]. 프로바이오틱 요구르트와 대두 요구르트는 냉장보관 중 Escherichia coli와Staphylococcus aureus에 대한 억제 효과가 나타났으며, 이는 요구르트 내의 프로바이오틱 균주 B. lactis Bb12와 B. longum Bb46와 크게 관련이 있다[43].
식품 모델에서 개별 병원체(Staphylococcus aureus,E. coli O157: H7, Salmonella Typhi,Yersinia enterocolitica)을 첨가하고 L. rhamnosus 균주와 함께 배양한 요구르트는 배양 시간과 초기 병원체 수에 따라 병원체를 완전히 제거하거나 크게 감소시켰다[3]. 병원균의 2와 4 log10 CFU/mL 이하의 접종 수준에서 더 빨리 제거되는 것을 관찰하였다. 프로바이오틱 균주는 pH를 낮추기 위해 과산화수소, 유기산, 박테리오신 등의 대사물을 방출하는데, 이는 상승작용으로 병원체를 억제할 수 있다[43].
산성화된 L. rhamnosus 세포가 없는 상층액(cell free supernatant)이 시험된 모든 병원체를 유의하게 억제했으며, 중화된 CF가 병원체를 억제했기 때문에 유기산 이외의 다른 인자(펩티드 또는 박테리오신)는 억제 활성을 갖는 것으로 간주되었다[3]. 유단백질에 포함된 생리활성 펩타이드는 인간 장의 단백질 분해 효소 또는 프로바이오틱 LAB에 의해 방출될 수 있다[44]. 탈지유의 L. helveticus 균주는 pH, 시간, 온도 및 생체 활성 펩타이드 농도에 따라 특이적이고 의존적인 항산화 및 항대장암 활성을 갖는 생체 활성 펩티드를 방출한다[44].
발효 제품의 건강상 이점을 입증할 과학적 증거는 그러한 활동에 필요한 막대한 재정과 기술 때문에 부족하다[14]. 과학적 증거(조사결과)를 제공하는 것은 식품산업의 핵심 과제가 아니다. 그리고 이것은 연구 기관과 식품산업 간의 강력한 협력 관계를 요구한다. 발효 음료(유제품 또는 비유제품)의 건강에 대한 주장을 입증하는 것은 규제 기관의 큰 관심사이고, 기능성 식품 개발과 관련된 연구의 일부가 되어야 한다.
프로바이오틱 기능성 요구르트를 섭취할 때 미생물 구성과 세포 농도는 인간의 건강을 향상시킬 수 있는 다양한 이점을 주는 것과는 강력한 연관성이 있다[14]. 이는 발효음료의 건강상 이점이 프로바이오틱 함량, 항균 대사물, 복합 식품 분자의 분해 등 3가지 가능성 때문일 수 있음을 시사한다[14]. LGG가 함유된 요구르트를 무작위 대조시험에서 신장 환자가 8주간 섭취했을 때, vancomycin 내성 장구균이 모두 제거되었다[4]. 8주의 치료 기간 동안 프로바이오틱 균주 B. lactis Bb12 및 L. acidophilus LA5가 함유된 요구르트의 섭취는 대사 증후군 환자의 혈관 세포 접착 분자(marker)와 관련하여 혈당 수치와 내피 기능 장애를 감소시키는 것으로 관찰되었다[45]. L. rhamnosus SD11이 첨가된 발효유를 매일 섭취하면 참가자들의 구강 내 Streptococcus mutans와 총 세균이 감소하고, 유산균 수치는 대조군에 비해 프로바이오틱 그룹에서 유의미하게 증가한다고 보고하였다[46]. 유산균은 충치, 치주염, 구취, 치은염을 포함한 구강 건강 문제를 예방할 수 있다[46]. 이 메커니즘은 구강 점막의 유익균의 증가와 병원체 억제와 관련이 있다. 또한, 병원균의 억제는 박테리오신, 유기산 및 항균성 단백질의 생산으로 인해 발생한다[47]. 임상적 증거 제공은 재정 자원, 다수의 참여자, 그리고 확증된 결과를 제공하는 데 필요한 인력(간호사, 영양사, 식품 과학자, 임상 시험 관계자)의 부서간 개입으로 인해 방해될 수도 있다. 대규모 유전자 전체 분석은 밀접하게 관련된 LAB균주가 식품과 장 환경 모두에서 발생한다는 것을 입증하고 발효식품이 내장 마이크로바이옴에 대한 LAB의 공급원으로 간주될 수 있다는 전례 없는 증거를 제공한다[48].
결론 및 요약
요구르트의 발효는 일부 식품 매개 병원체에 낮은 pH와 가혹한 환경을 제공하고 관능적 특성을 개선시키기 때문에 유익하지만, 이것은 미생물 종 또는 균주에 의존적이다. 발효로 인한 유기산은 요구르트의 점도 및 겔 화 특성에 영향을 미칠 수 있다. 프로바이오틱 및 GRAS로 주장되는 균주의 잠재적 건강 이점이 제시되었다. 요구르트는 건강에 민감한 소비자에게 프로바이오틱스를 전달하기 위한 가장 선호되는 수단이다. 프로바이오틱 음료 제조업체는 규정을 준수해야 한다. 프로바이오틱 요구르트의 개발은 건전한 프로바이오틱의 특성 및 안전성, 기술적, 관능적, 기능적 특성을 가진 균주의 선택을 요구한다. 안전성 측면에서 Lactobacillus와 Bifidobacterium 속의 균주는 GRAS이다. 안정성에는 분자생물학적 분리 및 동정, 전이 가능한 항생제 내성 유전자의 부재, 프로바이오틱 유기체에 의한 용혈의 부재 등이 포함된다. 프로바이오틱 요구르트의 관능적 특성은 소비자의 선호도에 부정적인 영향을 미칠 수 있다. 따라서, 선택된 프로바이오틱 균주는 가공 및 저장 조건 동안 권장되는 기능이 유지되도록 최소치 이상의 균수가 유지되고, 관능품질을 개선하고 생존성에 기술적으로 적합해야 한다. 효능이나 임상 결과의 증거(자료)는 기능적 청구 승인을 고려하기 위해 규제 당국에 제출해야 한다. 체외 및 체내 동물 모델에 기초한 주장만으로는 불충분한 것으로 간주된다. 따라서 요구르트에 포함된 프로바이오틱 균주의 효능은 잘 설계된 임상 시험에 따라 조사, 확인, 및 승인되어야 한다. 일반적으로 허용되는 기능성 최소값은 28–30일 냉장 보관한 요구르트에 프로바이오틱 균주 106 CFU/mL이며 프로바이오틱 요구르트는 규정을 준수해야 한다. 상품 라벨에 프로바이오틱이라는 용어 사용은 남아프리카 공화국과 같은 일부 국제에서 사용이 제한된다. EU에서 상품에 프로바이오틱 용어를 사용하는 것은 건강을 건강 기능성에 대한 주장이며, EFSA는 프로바이오틱이라는 용어를 사용할 수 있도록 하는 FDA와 달리 건강 기능성 승인을 요구한다. 남아프리카 공화국과 같은 국가는 최소 스타터와 프로바이오틱 생존성 및 프로바이오틱 균주가 요구르트에 첨가될 수 있는지에 관련하여 서로 다른 정부 부처가 공포한 규정의 모순되는 조항을 명확히 할 필요가 있다. 배양에 의존하는 평판계수법은 요구르트와 같은 제품에서 생존 가능한 세포를 측정하는 데 가장 많이 사용되지만, VBNC(생존했지만 손상된 세포 수)는 측정되지 않을 수 있다. 프로바이오틱과 요구르트 배양은 밀접하게 연관되어 있으며, 요구르트에 대한 선택적 또는 분별 배지 평판계수법이 표준화되지 않는 한 쉽게 구분하기 어렵다.
유세포 분석은 요구르트의 프로바이오틱 세포 함량을 평가하기 위한 배양 의존적 기술도 분자 기반 접근법도 아니며, 유세포 분석법은 적절한 형광 염료를 사용함으로써 생존 가능한 세포와 손상된 세포 또는 죽은 세포를 구별할 수 있다. 배양 독립 기술은 핵산 분석에 의존하며 PCR, RT-PCR 및 RT-qPCR을 포함한다. 생존 가능 세포와 손상된 균(VBNC)을 구별하려면 분자 생물학에 대한 전문 지식이 필요하다. EMA-PCR 및 PMA-PCR의 사용은 살아 있는 세포(세포벽의 온전성에 따라 다름)를 추정하기 위한 대체 기술을 제공한다. 손상된 세포의 DNA는 염료가 삽입되어 살아 있는 세포의 수로 측정되지 않는다. NGS 접근법은 프로바이오틱 요구르트 내에서 미생물 다양성과 종 구성 비율을 결정하는 데 사용될 수 있다. 하지만, NGS 접근 방식은 DNA 결과가 정상 세포에서 얻어진 것인지, 손상된 세포(VBNC)에서 얻어진 것인지 알 수 없으므로 평판계수법을 채택하면 생존 가능성을 역으로 확인할 수 있다. NGS 접근 방식은 생물 정보학 기술에 대한 고급 교육이 필요하지만, 프로바이오틱 요구르트가 규정을 준수하는지 확실히 확인할 수 있다.






