서 론
마이야르 반응(Maillard reaction)은 식품의 열처리 및 저장 중에 아미노산과 환원당(reducing sugar) 사이에서 일어나는 비효소적 갈변반응(non-enzymatic browning)이다[1]. 마이야르 반응은 색상 형성에 따라 세단계로 나눌 수 있는데 초기단계에서 아미노기와 환원당이 축합(condensation)되고 축합 후 생성된 불안정한 N-substituted glycosilamine은 Amadori rearrangment를 거쳐 1-amino-1deoxy-2ketose가 형성된다. 중간 단계에서 추가 dehydration을 통해 diacetyl 또는 pyruvaldehyde와 같은 단쇄 가수분해 생성물이 형성된다. 마지막 단계에서 aldol 축합반응이 일어나며 최종적으로 갈색을 띠는 heterocyclic 질소화합물인 melanoidin이 형성되며 본화합물은 건강 기능성(예: 항산화 및 항생제 효과)을 지니고 있는것으로 알려져 있다[2,3].
마이야르 반응 결과 형성된 마이야르 공액체(Maillard conjugates)는 단백질의 아미노기(amino group)와 탄수화물의 카르보닐기(carbonyl group)간의 공유결합으로 형성된다. 마이야르 공액체 형성은 유식품 가공 공정 중 하나인 열처리 공정으로 인한 단백질 변성 관련 열안정성 저하 문제를 방지할 수 있으며[4], 양친매성(amphiphilicity)을 지니고 있어 식품 적용시 우수한 유화 능력을 가지고 있는 단백질과 비교하여 마이야르 공액체는 에멀젼(예: oil in water emulsion) 적용시 단백질의 oil droplet 흡착 능력과 환원당의 정전기적 반발력(electrostatic repulsion)으로 인해 유화 특성을 향상 시킬 수 있다고 보고되었다[5]. 또한 마이야르 반응 생성물(i.e., heterocyclic 화합물 또는 고분자 melanoidin 등)은 자유 라디컬(free radical) 소거 능력, 금속이온 흡착 등을 통해 항산화 특성을 지니고 있다고 보고되었다[6,7].
마이야르 공액체 제조 공정 요인인 pH와 열처리 온도는 마이야르 반응에 영향을 미치는 주요 요인으로 pH 7.0 이상 증가와 열처리 온도 증가는 마이야르 반응을 증진시키기 때문에 본 연구에서는 pH와 열처리 온도가 마이야르 공액체의 기능적 특성(i.e., 열안정성, 유화특성, 항산화 특성)에 영향을 미치는 핵심 제조 공정 요인이라고 가설을 설정하였다. 본 연구의 목적은 건강기능성 및 물리화학적 특성을 지니고 있는 분리유청단백질(whey protein isolate, WPI)과 프리바이오틱 활성을 지닌 다당류인 이눌린(Inulin)을 사용하여 마이야르 공액체를 제조하고 제조 공정 요인인 pH와 열처리 온도가 마이야르 공액체의 기능적 특성에 미치는 영향을 연구하는 것이다.
재료 및 방법
분리유청단백질(WPI)은 Sachsenmilch Leppersdorf(Germany)에서, TNBS 용액(2,4,6-trinitrobenzene sulfonic acid) (5%, w/v)은 Thermo Fisher Scientifi(USA)에서 구입하였다. 이눌린(Inulin), ANS(8-Anilino-1-naphthalenesulfonic acid), potassium persulfate, sodium dodecyl sulfate(SDS), ABTS(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)는 Sigma-Aldrich(USA)에서 구입하였다.
분리유청단백질(WPI)과 이눌린(Inulin)을 각각 1%(w/v)농도로 증류수에 용해 시켜 1:1의 비율로 혼합용액을 제조하였다. 제조된 혼합용액은 1 N NaOH와 1 N HCl을 이용하여 각각 pH 7.0과 pH 8.4로 조절 후 항온수조(Water bath, DH.WCB00222, DAIHAN, Korea)를 사용하여 60°C와 70°C 온도로 12시간 열처리하였다. 열처리된 분리유청단백질/이눌린 혼합용액은 -80°C 초저온냉동고에서 48시간 동안 냉각 처리 후 동결건조기(Freeze dryer, FD-1000, EYELA, Japan)를 이용하여 72시간 동안 동결건조시켜 마이야르 공액체를 제조하였다[8].
WPI의 유리 아미노기 함량을 측정하는 Graft degree는 수정된 TNBS 방법[8]에 의해 평가되었다. 제조공정요인에 따라 제조된 마이야르 공액체를 0.01 M phosphate buffer에 용해시켜 0.5 mg/mL 농도의 마이야르 공액체 수용액을 준비하였다. 준비된 수용액 1 mL 및 0.1%(w/v) TNBS 용액 1 mL 및 0.1 M NaHCO3(pH 8.5) 1 mL를 혼합한 후, 40°C에서 2시간 동안 열처리하였다. 배양 후, 반응을 중지시키기 위해 10%(w/v) SDS 1 mL 및 1 M HCl 0.5 mL를 첨가하였다. 접합효율을 평가하기 위하여 분광광도계(spectrophotometer, GEN10S UV-Vis, Thermo Fisher Scientific, USA)를 이용하여 420 nm에서 흡광도를 측정하였다.
여기서, A1은 대조군 분리유청단백질의 흡광도 값을 나타내며, A2는 분리유청단백질/이눌린 마이야르 공액체의 흡광도 값을 나타낸다.
제조공정요인(i.e., pH, 열처리 온도)에 따른 분리유청단백질/이눌린 마이야르 공액체의 구조적 기능성은 소수성 형광 probe인 8-Anilino-1-naphthalenesulfonic acid(ANS)를 이용하여 표면소수성(surface hydrophobicity)을 측정하여 수정된 방법[9]에 의해 평가되었다. 마이야르 공액체는 phosphate buffer(10 mM, pH 7.0)에 0.005%–0.025%(w/v)의 다양한 농도로 희석되었다. 희석된 8 mL 샘플용액을 0.1 M phosphate buffer(pH 7.4)에 녹인 ANS 용액(최종농도 8 mM) 20 μL에 첨가하였다. 혼합용액을 15분간 반응시킨 후, 형광분광광도계(fluorescence spectrophotometer, LS-55 & Lambda 25, Perkin Elmer, USA)를 사용하여 혼합용액의 형광강도(fluorescence intensity)를 측정하였다. 측정 시, 슬릿 폭(slit width)은 0.5 nm로, excitation과 emission 파장대는 각각 390 및 470 nm로 설정하였다. 마이야르 공액체의 표면 소수성은 선형 회귀 분석(linear regression analysis)을 사용하여 상대 형광(R)값 대 마이야르 공액체의 농도(%, w/v)의 초기 기울기(S0) 값을 나타내었다. 값은 다음과 같은 수식으로 계산하였다.
여기서, F는 분리유청단백질/이눌린 마이야르 공액체와 ANS 혼합용액의 형광 강도이고, F0는 마이야르 공액체가 없는 ANS 용액만의 형광 강도이다.
분리유청단백질/이눌린 마이야르 공액체의 유화특성을 평가하는 지표인 emulsifying activity index(EAI)와 emulsifying stability index(ESI)는 탁도측정법(turbidimetric method)을 이용하여 측정하였다[10]. 제조공정 요인(i.e., pH, 열처리 온도)에 따라 제조된 마이야르 공액체를 0.01 M phosphate buffer에 용해시켜 2 mg/mL의 농도의 마이야르 공액체 수용액을 제조하였다. 에멀젼 제조를 위해 8 mL의 마이야르 공액체 수용액과 corn oil 2 mL를 혼합한 후, 균질기(Homogenizer, DAIHAN Scientific, Korea)를 이용해 13,500 rpm에서 2분 동안 균질화 하였다. 균질화 후 생성된 에멀젼을 0.1%(w/v) SDS 용액에 희석 후, 분광광도계를 이용하여 500 nm에서 흡광도를 측정하였다. 마이야르 공액체의 EAI와 ESI는 아래의 식에 따라 계산하였다.
여기서, A0는 에멀젼 생성직후의 흡광도 값, N은 희석계수(N=101), p는 단백질 용액 농도(g/mL), φ는 광학경로(φ=0.01 m), θ는 유상의 비율, At는 에멀젼 생성 t분(t=10) 후의 흡광도 값이다.
분리유청단백질/이눌린 마이야르 공액체의 항산화적 특성(antioxidant properties)을 평가하는 지표인 ABTS 라디칼 소거(ABTS radical scavenging activity) 분석은 수정된 방법[11]을 사용하여 평가하였다. 7 mM ABTS 용액과 2.45 mM potassium persulfate 용액을 1:0.5의 비율로 혼합한 후 16시간 동안 암실에서 보관하였다. 혼합된 용액은 734 nm에서 흡광도 값이 0.7±0.02가 되도록 5 mM Phosphate buffer saline(pH 7.4)에 희석하였다. 희석된 흡광도 값이 0.7±0.02인 ABTS 용액 2 mL와 5 mg/mL의 농도로 제조된 마이야르 공액체 샘플용액 200 μL을 혼합하였다. 혼합물은 0분에서 60분 동안 측정되었으며 측정전까지 암실에서 보관되었다. 측정된 흡광도값은 다음 수식을 이용하여 마이야르 공액체의 ABTS 라디칼 소거능력을 평가하였다[12].
여기서, A734 blank는 734 nm에서 흡광도 값이 0.7±0.02가 되도록 pH 7.4 PBS와 섞은 용액을 말하며, A734 sample은 734 nm에서 0분에서 60분 동안 측정된 값이다.
통 계
모든 실험결과는 3반복한 결과이며 평균±표준편차로 나타내었으며, 마이야르 공액체의 제조공정요인이 접합효율, 구조적 기능성, 유화특성 및 항산화 특성에 미치는 영향은 Fisher의 최소유의차(least significant difference, LSD)법과 이원산분산분석(two-way ANOVA)을 이용하여 유의차 95% 신뢰수준(p<0.05)에서 분석하였다. 모든 통계분석은 Statistical analysis system(SAS) 프로그램을 사용하였다.
결과 및 고찰
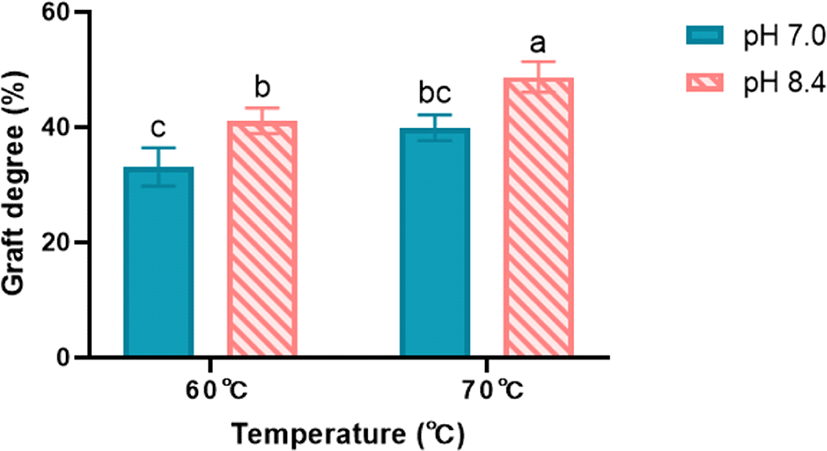
마이야르 공액체 제조공정요인(i.e., pH, 열처리 온도)에 따른 분리유청단백질(WPI)/이눌린(Inulin) 마이야르 공액체의 접합효율 평가 결과는 Fig. 1에 제시되었다. 동일한 열처리 온도에서 pH가 7.0에서 8.4로 증가함에 따라 마이야르 공액체 graft degree는 유의적(p<0.05)으로 증가하였다(Fig 1). 또한 pH 8.4 조건에서 열처리 온도가 60°C에서 70°C로 증가함에 따라 마이야르 공액체의 graft degree는 유의적(p<0.05)으로 증가함을 알 수 있었다(Fig. 1). 증가된 graft degree 값은 TNBS 시약과 반응하는 마이야르 공액체 내 유리 아미노기의 양이 적어 분리유청단백질과 이눌린과의 접합효율이 높다는 것을 뜻하며[8,13], 결과적으로 pH와 열처리 온도 증가는 WPI와 Inulin 사이의 접합효율을 증가시켜 마이야르 공액체 생성 효율을 향상시키는 주요 제조공정 요인임을 알 수 있었다.
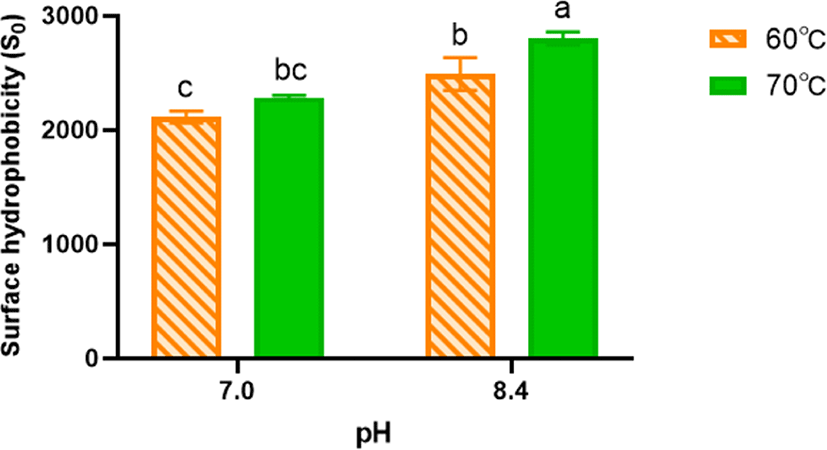
제조공정요인인 pH와 열처리 온도가 WPI/Inulin 마이야르 공액체의 표면 소수성(surface hydrophobicity)에 미치는 영향을 평가한 결과는 Fig. 2에 제시되었다. 마이야르 반응이 활발한 pH 8.4에서 열처리 온도가 60°C에서 70°C로 증가함에 따라 마이야르 공액체의 표면소수성은 유의적(p<0.05)으로 증가하였다(Fig. 2). 이러한 결과는 열처리 온도가 증가함에 따라 카르보닐기와 아미노기 사이의 반응성이 증가할 뿐만 아니라 마이야르 공액체형성에 이용되는 globular protein(구형 단백질)인 유청단백질의 내부에 존재하는 소수성 잔기들이 열처리 온도 증가에 따라 유청단백질이 변성되어 단백질 분자 내부에 있던 소수성 잔기가 외부로 노출되고 결과적으로 소수성 형광 probe인 ANS와의 반응이 증진되어 마이야르 공액체의 표면소수성이 증가되었음을 알 수 있었다[14].
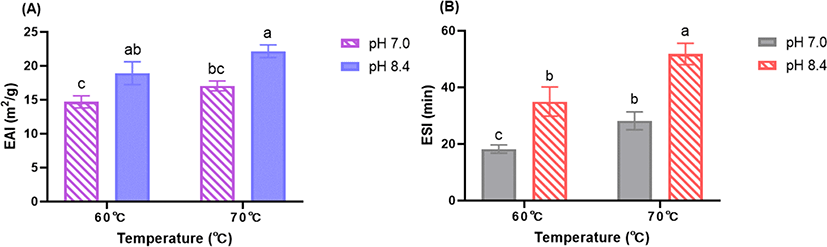
WPI/Inulin 마이야르 공액체의 유화특성은 EAI 및 ESI을 이용하여 평가하였고 제조공정 요인인 pH와 열처리 온도에 대한 유화 특성 결과는 Fig. 3에 제시되었다. EAI는 단백질 단위질량 당 안정화된 유수 계면의 면적으로 정의되며[15] 반면, ESI는 미리 결정된 시간 이후 에멀젼의 상대적 안정성에 대한 추정치로 정의된다[16,17]. WPI/Inulin 마이야르 공액체의 EAI 값은 동일한 열처리 온도에서 pH가 7.0에서 8.4로 증가함에 따라 유의적(p<0.05)으로 증가하였음을 확인하였다(Fig. 3A). 마이야르 반응은 높은 온도와 pH가 높은 알칼리 조건에서 촉진될 수 있다고 보고 되었으며 당화로 인한 형태변화는 오일-물 계면(oil-water interface)에서 빠르고 안정적인 흡착을 증진시켜 유화 활성이 높아졌음을 알 수 있었다[18]. ESI 또한 동일한 열처리 온도에서 pH가 7.0에서 8.4로 증가함에 따라 유의적(p<0.05)으로 증가하였는데(Fig. 3B) pH 증가로 인한 유화안정성 증가는 마이야르 공액체 형성에 관여하는 유청단백질 이눌린의 공유 결합이 기름 방울(oil droplet) 주변에 안정적인 계면층(interfacial layer) 형성에 기여하여 입체적 반발력(steric repulsion)과 정전기적 반발력(electrostatic repulsion)에 의한 에멀젼 응집 등을 저하시킨 결과라고 사료된다[19].
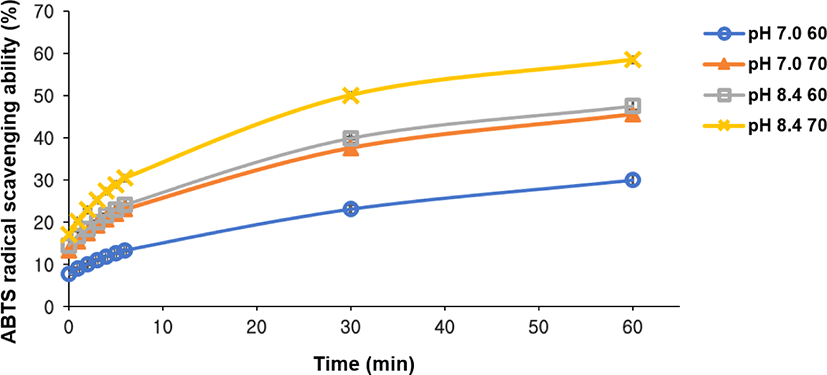
WPI/Inulin 마이야르 공액체의 항산화적 특성(antioxidant property)은 ABTS 라디컬 제거 분석법을 이용하여 측정되었고 제조공정 요인인 pH와 열처리 온도에 대한 항산화적 특성 평가 결과는 Fig. 4에 제시되었다. 마이야르 공액체의 ABTS 라디컬 제거 능력(radical scavenging ability)은 60분 동안 유의적으로 증가하였으며(Fig. 4), 결과적으로 WPI/Inulin 마이야르 공액체의 항산화 효과가 시간이 지남에 따라 증가되었음을 알 수 있었다. 동일한 열처리 온도에서 제조공정 요인인 pH가 7.0에서 8.4로 증가함에 따라 ABTS 라디컬 제거 능력은 유의적(p<0.05)으로 증가하였으며 또한 동일한 pH에서 열처리 온도 증가 또한 ABTS 라디컬 제거 능력 증진에 유의적으로 기여하였다(Fig. 4). 마이야르 반응 중 최종단계에서 형성되는 주요 화합물인 melanoidins은 ABTS 라디컬 제거 능력을 제공하는 화합물로 알려져 있으며[20,21], 알칼리 pH와 증가된 열처리 온도에서 상대적으로 melanoidin 생성이 증가하였고, 결과적으로 ABTS 라디컬 제거 능력이 증가하였다고 사료된다.