ARTICLE
반응표면법에 의한 Lactiplantibacillus plantarum K79를 이용한 ACE(Angiotensin Converting Enzyme) 억제활성 향상을 위한 탈지유 발효조건 최적화
Optimization of Skim Milk Fermentation Conditions by Response Surface Methodology to Improve ACE Inhibitory Activity Using Lactiplantibacillus plantarum K79
Yu-Kyoung Park1
,
Sang-Pil Hong1
,
Sang-Dong Lim1,*
Author Information & Copyright ▼
1Korea Food Research Institute, Wanju, Korea
*Corresponding author : Sang-Dong Lim, Korea Food Research Institute, Wanju, Korea, Tel : +82-63-219-9082, Fax : +82-63-219-9288, E-mail :
limsd@kfri.re.kr
© Copyright 2022, Korean Society of Dairy Science and Biotechnology. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Sep 21, 2022; Revised: Sep 23, 2022; Accepted: Sep 23, 2022
Published Online: Sep 30, 2022
Abstract
This study was conducted using response surface methodology (RSM) to elucidate fermentation conditions that will optimize ACE inhibitory activity using Lactiplantibacillus plantarum K79. Four independent variables [skim milk (with 1% added glucose) concentration (6%–14%), incubation temperature (32°C–42°C), incubation time (8–24 h), and amount of added starter (0.02%–0.2%)] were evaluated using five-level central composite design and response surface methodology to determine the optimum fermentation condition. The dependent variables were angiotensin converting enzyme (ACE) inhibitory activity (the value obtained from 102 diluted supernatant), and pH. The respective coefficients of determinations (R2) were 0.791 and 0.905 for ACE inhibitory activity and pH. The maximum ACE inhibitory activity was 90% under the following conditions: 10% skim milk (with 1% added glucose) concentration, 37°C incubation temperature, 17.8 h incubation time, and 0.2% added starter. Based on the RSM, using predicted best ACE conditions for fermentation of 13.49% skim milk (with 1% added glucose) with 0.0578% starter at 33.4°C for 21.5 h, the predicted ACE inhibitory activity and pH values were 86.69% and 4.6, respectively. Actual ACE inhibitory activity and pH values were 85.5% and 4.58, respectively.
Keywords: Lactiplantibacillus plantarum; angiotensin converting enzyme (ACE) inhibitory activity; blood pressure; response surface methodology (RSM); optimum fermentation condition
서 론
고혈압은 만성 질환 중 관상 동맥 심장 질환 및 뇌졸중의 위험 요소 중 하나로서, 특히 개발도상국의 주요 사망 원인이 되고 있다[1].
현재 captopril, enalapril 또는 ramipril과 같은 합성 약물은 ACE-I 활성 억제를 기반으로 하는 심혈관 질환 치료에 사용된다. 불행히도 고혈압 예방을 위해 이러한 약물을 사용하면 기침, 피부 발진, 메스꺼움, 구토 및 현기증과 같은 심각한 부작용이 발생할 수 있다[1]. 이로 인해 연구자들은 심혈관 질환의 예방과 치료 모두에 사용할 수 있는 보다 안전하고 혁신적이며 저렴한 다른 ACE(angiotensin converting enzyme) 억제제를 연구하게 되었다[2].
생리활성 천연 ACE 억제제는 거북난백, 감자, 대두 및 우유 등 식품원에서 분리되었다고 보고되고 있다[3,4].
Lactobacillus delbrueckii, Lactobacillus helveticus, Lactobacillus bulgaricus, Streptococcus salivarius와 Streptococcus thermophilus로 생산된 발효유제품은 고혈압을 억제할 수 있는 생리활성 펩타이드가 많이 함유하고 있다[5,6].
우유 발효 과정에서 형성되는 생리활성 대사체 중 펩타이드는 다양한 질병의 치료에 중요한 도구로 떠오르고 있다. 이 펩타이드는 2–20개의 아미노산으로 다양하며 그 중 일부는 다기능이며 하나 이상의 기능적 특성을 발휘할 수 있다[7-9]. ACE는 레닌 안지오텐신 경로에 의해 혈압을 조절하는 데 중요한 생리학적 역할을 한다[10]. ACE-I 펩타이드는 ACE의 활성을 억제하고 안지오텐신 I이 강력한 혈관수축제인 안지오텐신 II로 전환되는 것을 방지한다. 우유는 ACE-I 펩타이드의 좋은 공급원이며 발효 중에 단백질이 가수분해되어 생성된다[11]. ACE-I 펩타이드의 합성 및 활성에 영향을 미치는 인자로는 스타터 종류 및 기질(카제인 및 유청 단백질), 발효조건 등 다양하다. 특히 스타터 종류에 따라 ACE-I 활성이 차이가 많은데, Chen 등[12]은 전통발효유제품에서 38개의 Lb. helveticus 균주를 분리하였고, 발효유에서 50% 이상이 ACE-1 활성을 보였으며, 분리균주 중 3개 균주(IMAU80851, IMAU80852, IMAU80872)가 더 높은 활성을 보였다고 하였다. Ramachandran과 Shah[13]는 Bifidobacterium longum으로 발효된 우유를 Lactobacillus acidophilus 및 Lactobacillus casei와 같은 다른 종으로 발효된 우유와 비교했을 때 더 높은 ACE-I 활성을 보였다고 하였으며, Gonzalez-Gonzalez 등[14]은 Bifidobacterium bifidum MF20/5로 발효된 우유는 Lactobacillus helveticus DSM 13137을 포함한 다른 LAB에 비해 더 높은 ACE-I 활성을 보였다고 하였다.
ACE-I 활성은 특정 수준까지 단백질 가수분해 정도에 따라 달라지며, 그 이상에서는 ACE-I 펩타이드를 포함한 단백질의 광범위한 단백질 분해로 인해 활성이 감소된다[15].
따라서 본 연구에서는 탈지유 농도, 스타터 첨가량, 배양온도, 배양시간을 이용하여 ACE 억제활성을 극대화하기 위하여 반응표면분석법을 통해 발효조건을 확립하고자 하였다.
재료 및 방법
1. 공시재료
ACE 억제효과를 가지고 있는 L. plantarum K79 균주는 김치에서 분리되었다. 멸균된 MRS broth에 균주 1%를 접종하여 37°C, 18시간 동안 배양한 후, 1,500×g에서 15분간 원심분리하여 cell paste 형태로 회수하였다. 동결보호제로서 증류수를 첨가하여 10% skim milk를 제조한 후 110°C, 5분간 2회 간헐 멸균하여 사용하였다. 회수된 cell paste 15 g에 멸균된 10% skim milk 50 mL을 첨가하여 잘 섞고, –70°C deep freezer에 3시간 동결한 후 동결건조기에서 24시간 동안 동결 건조시켜 powder 형태로 제조하였다. 이때의 제조된 starter에 들어있는 생균수는 3.5×109 CFU/g이었다.
2. ACE(angiotensin converting enzyme) 억제 활성 측정
ACE 억제활성 분석은 ACE 억제분석킷트(ACE kit-WST, A502, Dojindo, Kumamoto, Japan)를 사용하여 수행하였다[16]. 요약하면, D0, D4, 및 D8의 펩타이드 추출물을 20 g/L의 농도로 증류수에 용해시켰다. 시료(20 μL)를 기질 완충액(20 μL) 및 효소 작동 용액(20 μL)과 혼합하였다. 37°C에서 60분 동안 배양한 후, 지시약 작업 용액(200 μL)을 첨가하고 실온에서 10분 동안 배양하였고, Captopril은 실험 내내 양성 대조군으로 사용되었다. 각 시료의 흡광도는 450 nm에서 Multi Microplate Reader(SpectraMax, Molecular Devices, San Jose, CA, USA)를 사용하여 측정하였고, ACE 억제율(%)은 다음 방정식을 사용하여 구하였다.
Ablank1: blank의 흡광도
Ablank2: 효소 작업용액
Asample: 시료 또는 양성대조군 흡광도
3. 반응표면분석법(RSM, response surface methodology)을 이용한 배양조건의 최적화
1) 조건설정
조건설정은 배양조건을 최적화하기 위하여 독립변수(Xi)로 skim milk 농도(X1), 배양온도(X2), 배양시간(X3), starter 첨가량(X4)을 설정하고 5단계로 부호화하여 27개 구간으로 설계하여 배양조건을 실시하였다. 종속변수(Yn)로는 ACE 억제율(Y1), pH(Y2)을 설정하였다. 통계처리는 MINITAB statistical software(Version 13, Minitab, State College, PA, USA)를 사용하였다.
2) 배양조건의 최적화를 위한 반응표면실험법
배양조건의 최적화를 위한 반응표면실험법은 중심합성계획[17]을 적용하였다. 독립변수로는 예비실험과 마찬가지로 포도당 1% 첨가된 skim milk 농도(X1), 배양온도(X2), 배양시간(X3), starter 첨가량(X4)을 설정하였다. 독립변수의 중심값과 범위는 예비실험을 바탕으로 설정되었으며, –2, –1, 0, 1, 2의 5가지 수준으로 부호화하였고(Table 1), 이에 따른 실험조건은 Table 2와 같다. 종속변수로는 ACE 억제율(Y1), pH(Y2)을 설정하였다. 이때 ACE 억제율은 조건별 발효원액에서 100배 희석하여 나타낸 값이다. 통계분석 결과를 바탕으로 반응표면 모델식을 구하고 반응표면 그래프(response surface plots)는 Maple software(Version 7, Maplesoft, Waterloo, ON, Canada)를 이용하여 3차원으로 나타내었다.
Table 1.
Independent values, their coded and actual values for optimization condition of fermented milk by Lactiplantibacillus plantarum K79
| Independent variable |
Symbol |
Level |
| –2 |
–1 |
0 |
1 |
2 |
| Skim milk conc. (%) |
X1 |
6 |
8 |
10 |
12 |
14 |
| Incubation temp. (°C) |
X2 |
32 |
34.5 |
37 |
39.5 |
42 |
| Incubation time (h) |
X3 |
8 |
12 |
16 |
20 |
24 |
| Starter added amount (%) |
X4 |
0.02 |
0.065 |
0.11 |
0.155 |
0.2 |
Download Excel Table
Table 2.
Central composite design and responses of dependent variables for fermented milk by Lactiplantibacillus plantarum K79 to independent variables
| Run no. |
Coded levels of variables |
Response |
| X1 |
X2 |
X3 |
X4 |
Y1 |
Y2 |
| 1 |
–1 |
–1 |
–1 |
–1 |
64.5 |
5.94 |
| 2 |
1 |
–1 |
–1 |
–1 |
78.1 |
5.93 |
| 3 |
–1 |
1 |
–1 |
–1 |
73.5 |
5.40 |
| 4 |
1 |
1 |
–1 |
–1 |
83.4 |
5.46 |
| 5 |
–1 |
–1 |
1 |
–1 |
80.1 |
4.85 |
| 6 |
1 |
–1 |
1 |
–1 |
86.5 |
5.07 |
| 7 |
–1 |
1 |
1 |
–1 |
75.2 |
4.73 |
| 8 |
1 |
1 |
1 |
–1 |
87.7 |
4.86 |
| 9 |
–1 |
–1 |
–1 |
1 |
72.1 |
5.67 |
| 10 |
1 |
–1 |
–1 |
1 |
77.3 |
5.81 |
| 11 |
–1 |
1 |
–1 |
1 |
68.5 |
5.25 |
| 12 |
1 |
1 |
–1 |
1 |
81.5 |
5.41 |
| 13 |
–1 |
–1 |
1 |
1 |
79.6 |
4.48 |
| 14 |
1 |
–1 |
1 |
1 |
89.4 |
4.63 |
| 15 |
–1 |
1 |
1 |
1 |
79.1 |
4.71 |
| 16 |
1 |
1 |
1 |
1 |
85.6 |
4.86 |
| 17 |
–2 |
0 |
0 |
0 |
78.4 |
4.84 |
| 18 |
2 |
0 |
0 |
0 |
82.9 |
5.08 |
| 19 |
0 |
–2 |
0 |
0 |
86.1 |
4.43 |
| 20 |
0 |
2 |
0 |
0 |
73.6 |
5.04 |
| 21 |
0 |
0 |
–2 |
0 |
39.7 |
6.39 |
| 22 |
0 |
0 |
2 |
0 |
89.5 |
4.40 |
| 23 |
0 |
0 |
0 |
–2 |
85.2 |
5.05 |
| 24 |
0 |
0 |
0 |
2 |
87.4 |
4.97 |
| 25 |
0 |
0 |
0 |
0 |
84.1 |
5.15 |
| 26 |
0 |
0 |
0 |
0 |
85.6 |
5.14 |
| 27 |
0 |
0 |
0 |
0 |
87.3 |
5.15 |
Download Excel Table
3) 통계분석
모든 반응 변수는 다중회귀분석과 분산분석을 수행하였고, 이로부터 얻은 이차회귀식을 통하여 반응모델의 적합성을 검증하였으며, 통계분석은 MINITAB 통계 소프트웨어(Version 13, Minitab, State College, PA, USA)를 이용하였고, 다음 이차 다항식 방정식을 통하여 수행하였다.
Y는 독립변수(ACE 억제활성, pH), β0은 상수, βi, βii, βij 는 회귀계수, Xi, Xj 는 독립변수의 수준이다. 두 개의 종속변수(Y1 및 Y2)를 동시에 만족할 수 있는 조건을 찾기 위해 다중 응답 최적화를 수행하였다. 응답 표면 플롯은 Maple 소프트웨어(Maple 7, Maplesoft)를 사용하여 개발되었으며 두 개의 독립 변수를 최적의 값으로 유지하면서 두 개의 독립 변수의 함수를 나타내었다.
결과 및 고찰
1. 장착된 모델의 진단 검사
MINITAB 통계 소프트웨어를 사용하여 2차 다항식 방정식을 실험 데이터에 맞추었고, 선형(X1, X2, X3, X4), 정사각형(X11, X22, X33, X44) 및 상호작용(X12, X13, X14, X23, X24, X34)의 모든 계수는 t-통계로 유의성을 위해 계산하였다. 배양조건을 최적화하기 위하여 4가지 독립변수들의 조합에 대한 종속변수의 반응 값을 Table 3에 나타내었다. 그 결과 Y1은 X1과 X3가 일차항에서 유의수준(p-value) 0.05보다 낮게 나와 통계적으로 유의성을 나타내었으며 종속변수에 대한 영향이 큰 것으로 나타난 반면 교차항은 X3X3를 제외하고 통계적으로 유의성이 없는 것으로 나타났다. Y2는 X3만이 일차항에서 유의수준(p-value)이 0.05보다 낮게 나와 통계적으로 유의성이 나타났고, 종속변수에 대한 영향이 큰 것으로 나타났으며, 교차항은 X2X3만이 통계적으로 유의성이 있는 것으로 나타났다. 상기에서 얻어진 결과를 바탕으로 구한 반응식은 Table 4와 같다. 실험 결과 얻어진 data를 Minitab software를 이용하여 반응표면분석한 결과를 바탕으로 적합한 2차 다항식의 모델을 구하였다. 각각의 독립변수에 대한 각각의 식은 아래 모델식과 같으며, 종속변수인 Y1과 Y2의 결정계수(R2)는 각각 0.791과 0.905로 나타났으며, 두 경우 모두 p-value=0.000으로 나타났다.
Table 3.
Estimated effects and coefficients for ACE inhibitory activity and pH (coded units) about fermented milk by Lactiplantibacillus plantarum K79
| Variable and interaction |
Y1 |
Y2 |
| Coefficient |
p-value |
Coefficient |
p-value |
| Intercept |
85.6667 |
0.000 |
5.14667 |
0.000 |
| X1 |
3.5792 |
0.026 |
0.06167 |
0.200 |
| X2 |
–0.7542 |
0.601 |
–0.02000 |
0.668 |
| X3 |
6.8292 |
0.000 |
–0.44417 |
0.000 |
| X4 |
0.3542 |
0.805 |
–0.06583 |
0.173 |
| X1X1 |
–1.0823 |
0.482 |
–0.01896 |
0.701 |
| X2X2 |
–1.2823 |
0.407 |
–0.07521 |
0.145 |
| X3X3 |
–5.0948 |
0.005 |
0.08979 |
0.087 |
| X4X4 |
0.3302 |
0.828 |
–0.00646 |
0.896 |
| X1X2 |
0.4313 |
0.806 |
0.00000 |
1.000 |
| X1X3 |
–0.4062 |
0.817 |
0.01875 |
0.742 |
| X1X4 |
–0.4937 |
0.779 |
0.01250 |
0.826 |
| X2X3 |
–1.4313 |
0.422 |
0.12250 |
0.048 |
| X2X4 |
–0.8938 |
0.613 |
0.06125 |
0.293 |
| X3X4 |
0.2687 |
0.879 |
–0.01500 |
0.792 |
Download Excel Table
Table 4.
Response surface model for making condition
| Responses |
Quadratic polynomial model |
R
2
|
p-value |
| Y1 |
Y1=85.6667+3.5792X1–0.7542X2+6.8292X3+0.3542X4+0.4313X1X2–0.4062X1X3–0.4937X1X4–1.4313X2X3–0.8938X2X4+0.2687X3X4–1.0823X12–1.2823X22–5.0948X32+0.3302X42 |
0.791 |
0.000 |
| Y2 |
Y2=5.14667+0.06167X1–0.02000X2–0.44417X3–0.06583X4+0.0000X1X2+0.01875X1X3+0.01250X1X4+0.12250X2X3+0.06125X2X4–0.01500X3X4–0.01896X12–0.07521X22+0.08979X32–0.00646X42 |
0.905 |
0.000 |
Download Excel Table
2. 분산 분석(analysis of variance)
이차 다항식 모델 방정식의 통계적 유의성은 분산 분석(ANOVA)을 수행하여 평가하였다. Table 5는 두 종속변수 Y1(ACE inhibitory activity(%))과 Y2(pH)의 반응을 설명하는 모델에 대한 ANOVA 결과를 나타내었다. 종속변수 Y1에서 Linear는 유의수준이 0.003으로써 매우 유의성이 높게 나타났으며, Regression과 Square는 각각 0.024와 0.043으로 유의성이 있었다. 반면, 2-way interations는 0.971로 0.05% 수준에서 유의성이 없는 것으로 나타났다. 종속변수 Y2에서 Regression과 Linear는 각각 유의수준이 0.000으로써 매우 유의성이 높게 나타났으나 Square와 2-way interations는 각각 0.122와 0.443으로 0.05% 수준에서 유의성이 없는 것으로 나타났다.
Table 5.
Analysis of variance for ACE inhibitory activity, pH (coded units) about fermented milk by Lactiplantibacillus plantarum K79
| Response |
Sources |
DF |
SS |
MS |
F-value |
p-value |
| Y1 |
Regression |
14 |
2,152.78 |
153.770 |
3.24 |
0.024 |
| Linear |
4 |
1,443.41 |
360.853 |
7.61 |
0.003 |
| Square |
4 |
653.14 |
163.286 |
3.44 |
0.043 |
| Interaction |
6 |
56.23 |
9.371 |
0.20 |
0.971 |
| Residual error |
12 |
568.97 |
47.414 |
- |
- |
| Lack of fit |
10 |
563.85 |
56.385 |
22.00 |
0.044 |
| Pure error |
2 |
5.13 |
2.563 |
- |
- |
| Total |
26 |
2,721.76 |
- |
- |
- |
| Y2 |
Regression |
14 |
5.70276 |
0.40734 |
8.21 |
0.000 |
| Linear |
4 |
4.93970 |
1.23493 |
24.89 |
0.000 |
| Square |
4 |
0.45121 |
0.11280 |
2.27 |
0.122 |
| Interaction |
6 |
0.31185 |
0.05198 |
1.05 |
0.443 |
| Residual error |
12 |
0.59540 |
0.04962 |
- |
- |
| Lack of fit |
10 |
0.59533 |
0.05953 |
1,786.00 |
0.001 |
| Pure error |
2 |
0.00007 |
0.00003 |
- |
- |
| Total |
26 |
6.29816 |
- |
- |
- |
Download Excel Table
3. 최적 반응 조건
반응표면분석 결과, 나타난 최적 조건에서의 coded 값과 uncoded 값을 Table 6에 나타내었다. 최적 조건일 때의 code 값은 X1=13.49, X2=33.4, X3=21.5013 그리고 X4=0.0578로 나타났다. 즉 skim milk 농도(X1)는 13.49%, 배양 온도(X2)는 33.4°C, 배양시간(X3)은 21.5013시간, 스타터 첨가량(X4)은 0.0578%일 때 최적 ACE 억제능과 pH를 보였다.
Table 6.
Optimal conditions of ACE inhibitory activity and pH
| Dependent |
Independent variables |
Critical value (uncoded) |
Predicted value |
Stationary point |
| Y1 |
X1 |
10.0 |
90.0000 |
Target |
| X2 |
37.0 |
| X3 |
17.8304 |
| X4 |
0.200 |
| Y2 |
X1 |
6.0000 |
4.6 |
Target |
| X2 |
32.0017 |
| X3 |
14.1670 |
| X4 |
0.200 |
| Multiple response optimization |
Y1, Y2 |
X1 |
13.4931 |
- |
- |
| X2 |
33.4057 |
| X3 |
21.5013 |
| X4 |
0.0578 |
Download Excel Table
4. 반응 표면도 및 요인의 영향
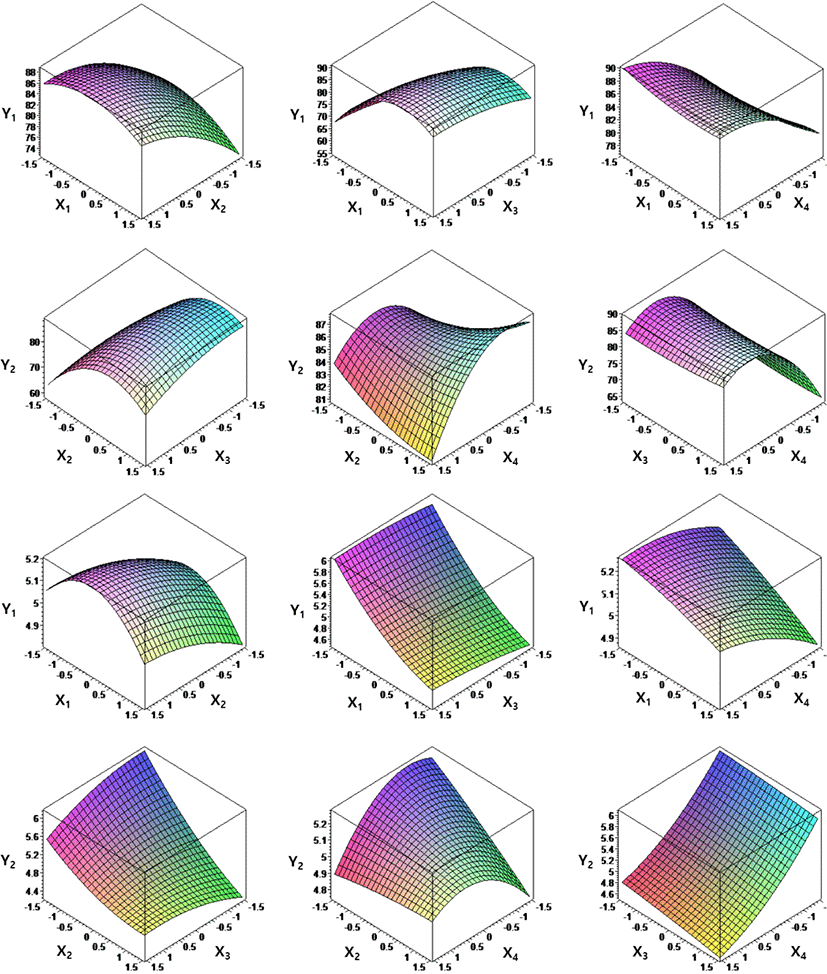
Fig. 1은 추정된 반응함수와 독립변수(X1, X2, X3, X4)와 종속변수(Y1, Y2)의 영향을 보여준다. 반응 표면 그림은 두 개의 독립 변수와 하나의 종속 변수 사이의 상호 관계를 나타내고 나머지 두 개의 독립 변수는 최적의 값을 보였다. ACE 억제활성이 높은 탈지유 발효조건 중 탈지유 농도, 배양온도, 배양시간 및 스타터 첨가량 등 4가지 요인이 ACE 억제활성(Y1)에 영향을 미치며, 4가지 독립변수 모두 pH(Y2)에 영향을 미치는 것으로 판단된다.
Fig. 1.
Response surface plots for the effect of independent variables on dependent (ACE inhibitory activity and pH) in Lactobacillus plantarum K79. X1, skim milk conc. (%); X2, temperature (°C); X3, incubation time (h); X4, starter conc. (%); Y1, ACE inhibitory activity (%); Y2, pH; ACE, angiotensin converting enzyme.
Download Original Figure
5. 예측 및 확인시험
반응표면분석법(RSM, response surface methods)은 여러 개의 독립 변수들이 복합적인 작용을 하여 한 개 또는 여러 개의 반응 변수들에 영향을 줄 때 그 작용의 관계를 통계적으로 분석하는 방법으로, 제품개발, 공정개발, 품질관리, 분석방법 개발 등의 분야에서 널리 이용되고 있다[18, 19]. 반응표면분석법을 활용한 최적 예측된 추출조건에 의한 반응변수 값과 확인시험 결과값은 Table 7과 같다. 이 때 예상되는 ACE 억제능은 86.69%, pH는 4.6이었으며, 실험값은 ACE 억제능은 85.5%, pH는 4.58이었다.
Table 7.
Predicted results of verification under optimized conditions
| Dependent |
Predicted value |
Experimental value |
| Y1 |
86.6916 |
85.5 |
| Y2 |
4.60 |
4.58 |
Download Excel Table
요 약
본 연구는 L. plantarum K79를 이용하여 ACE 억제활성 향상을 위한 최적의 발효조건을 RSM을 이용하여 예측하고자 하였다. 4개의 독립변수[탈지유(포도당 1% 첨가) 농도(6%–14%), 배양 온도(32°C–42°C), 배양 시간(8–24시간), 스타터 첨가량(0.02%–0.2%)] 5단계 중심 합성 설계 및 반응 표면 분석법을 사용하여 최적의 발효 조건을 결정하는 데 사용하였다. 종속변수는 ACE 억제 활성과 pH였다(이때 ACE 억제율은 조건별 발효원액에서 100배 희석하여 나타낸 값이다). 결정 계수(R2)는 ACE 억제 활성, pH에 대해 각각 0.791, 0.905이었다. 최대 ACE 억제 활성은 10% 탈지유(포도당 1% 첨가) 농도, 37°C 배양 온도, 17.8 h 배양 시간 및 0.2% 스타터 첨가량 조건에서 90%이었다. RSM에 기초하여 예측된 최적 발효 ACE 조건은 탈지유(포도당 1% 첨가) 농도 13.49%, 스타터 0.0578%, 배양온도 33.4°C에서 21.5시간 동안 배양할 때 ACE 억제 활성 및 pH의 예측 값은 86.69% 및 pH 4.6이었으며 실제 값은 각각 85.5%와 pH 4.58이었다.
감사의 글
본 연구는 농림축산식품부의 재원으로 농림수산식품기술기획평가원의 기술사업화 지원사업의 지원을 받아 이루어진 것으로 이에 감사 드립니다(No. 821028-03).
References
Lin L, Lv S, Li B. Angiotensin-I-converting enzyme (ACE)-inhibitory and antihypertensive properties of squid skin gelatin hydrolysates. Food Chem. 2012;131:225-230.


Wijesekara I, Qian ZJ, Ryu B, Ngo DH, Kim SK. Purification and identification of antihypertensive peptides from seaweed pipefish (Syngnathus schlegeli) muscle protein hydrolysate. Food Res Int. 2011;44:703-707.


Daliri EBM, Lee BH, Park MH, Kim JH, Oh DH. Novel angiotensin I-converting enzyme inhibitory peptides from soybean protein isolates fermented by Pediococcus pentosaceus SDL1409. LWT-Food Sci Technol. 2018;93:88-93.


Yamamoto N, Akino A, Takano T. Antihypertensive effect of the peptides derived from casein by an extracellular proteinase from Lactobacillus helveticus CP790. J Dairy Sci. 1994;77:917-922.


Schanbacher FL, Talhouk RS, Murray FA, Gherman LI, Willett LB. Milk-borne bioactive peptides. Int Dairy J. 1998;8:393-403.


Saito T, Nakamura H, Kitazawa H, Kawai Y, Itoh T. Isolation and structural analysis of antihypertensive peptides that exist naturally in Gouda cheese. J Dairy Sci. 2000; 83:1434-1440.


Rai AK, Jeyaram K. Health benefits of functional proteins in fermented foods. In: Tamang JP, editor. Health benefits of fermented foods and beverages. Boca Raton, FL: CRC Press; 2015. p. 455-474.

Ong L, Henriksson A, Shah NP. Angiotensin converting enzyme-inhibitory activity in Cheddar cheeses made with the addition of probiotic Lactobacillus casei sp. Le Lait. 2007;87:149-165.


Li M, Fan W, Xu Y. Identification of angiotensin converting enzyme (ACE) inhibitory and antioxidant peptides derived from Pixian broad bean paste. LWT-Food Sci Technol. 2021;151:112221.


Box GEP, Wilson KB. On the experimental attainment of optimum condition. J R Stat Soc Ser B. 1951;13:1-38.


Jeong JE, Shim SP, Jeong YS, Jung HK, Kim YC, Hong JH. Optimization of extraction conditions for ethanol extracts from Citrus unshiu peel by response surface methodology. Korean J Food Preserv. 2011;18:755-763.


Gontard N, Guilbert S, Cuq JL. Edible wheat gluten films: influence of the main process variables on film properties using response surface methodology. J Food Sci. 1992;57:190-195.