ARTICLE
티베트 요거트에서 분리한 유산균의 병원성 세균 항균 효과 연구
고주영1
,
이지연1
,
최한희1
,
박선우1
,
강석성1,*
Antimicrobial Effects of Lactic Acid Bacteria Isolated from Tibetan Yogurt against Foodborne Pathogenic Bacteria
Ju Young Gho1
,
Jiyeon Lee1
,
Hanhee Choi1
,
Sun Woo Park1
,
Seok-Seong Kang1,*
Author Information & Copyright ▼
1Department of Food Science and Biotechnology, College of Life Science and Biotechnology, Dongguk University, Goyang, Korea
*Corresponding author : Seok-Seong Kang, Department of Food Science and Biotechnology, College of Life Science and Biotechnology, Dongguk University, Goyang, Korea, Tel : +82-31-961-5150, Fax : +82-31-961-5108, E-mail :
sskang@dgu.ac.kr
© Copyright 2021, Korean Society of Dairy Science and Biotechnology. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Sep 23, 2021; Revised: Sep 27, 2021; Accepted: Sep 27, 2021
Published Online: Sep 30, 2021
Abstract
Yogurt is produced by bacterial fermentation of milk and contains lactic acid bacteria (LAB), which produce various metabolites such as organic acid, hydrogen peroxide, and bacteriocin. This study aimed to investigate cell-free supernatants (CFS) of LAB isolated from Tibetan yogurt. CFS (TY1, TY2, TY3, TY4, TY5, TY6, and TY7) from selected strains of LAB were co-incubated with four different foodborne pathogenic bacteria, namely E. coli O157:H7, Listeria monocytogenes, Salmonella typhimurium, and Staphylococcus aureus. Inhibition of foodborne pathogenic bacterial growth was not affected in the presence of CFS (pH 6.5). In contrast, CFS without neutralization completely inhibited the growth of the bacteria. Furthermore, when the concentration of CFS (without neutralization) was changed to 1:4 and 1:8, a difference in inhibition was observed between Gram-positive and Gram-negative bacteria. CFS more effectively inhibited the growth of Gram-negative E. coli O157:H7 and S. Typhimurium than Gram-positive L. monocytogenes and S. aureus. These results suggest that organic acids in LAB may inhibit the growth of foodborne pathogenic bacteria, particularly Gram-negative bacteria.
Keywords: Tibetan yogurt; lactic acid bacteria; foodborne pathogenic bacteria; antimicrobial activity
서 론
최근 건강에 대한 사람들의 관심이 증대되면서 건강지향성을 강조한 식품들이 소비자들에게 높은 관심을 받고 있다. 그 중 요거트는 유산균의 효능이 알려지면서 소비자들의 관심이 높아지고 있는 건강 기호식품 중의 하나이다[1]. 요거트는 원유 또는 탈지유에 유산균을 배양하여 특유의 향미를 강화시킨 발효 유제품이다. 현재 요거트 제품 개발 연구들은 단지 영양성과 기호도를 높이는 것뿐만 아니라, 항산화, 항균활성 등과 같은 새로운 생리활성이 강화된 요거트를 개발하는 추세로 이에 많은 연구들이 진행되고 있다[2]. 유산균은 식품의 발효에 관여하는 주된 미생물로 정장 작용[3,4], 항콜레스테롤[5], 면역증강 효과[6], 유당불내증 완화[7], 항암 작용[8] 등의 다양한 생리활성을 지니고 있어 건강증진 및 질병예방을 위한 probiotics로 사용되고 있다[9]. 유산균은 포도당 발효의 최종 대사 산물로 젖산 및 초산과 같은 유기산을 생산하고, hydrogen peroxide, bacteriocins, 그리고 과산화수소 등을 생산한다. 유산균의 항균효과는 주로 이러한 대사산물의 상호작용에 기인한다[10]. 최근 식생활 환경 변화와 함께 식중독 원인 식품은 점차 다양해지고, 식중독 사고의 규모가 대형화되고 있기에 식품안전 확보를 위한 식중독균 관리에서는 원재료를 비롯한 전 단계에서의 제어, 관리가 중요하다[11]. 식중독을 유발하는 주요 원인균으로는 Escherichia coli O157:H7, Listeria monocytogenes, Salmonella Typhimurium, Staphylococcus aureus 등이 알려져 있다[12]. E. coli O157:H7은 거의 모든 식품 즉, 물, 고기, 주스 등을 통하여 감염되며, 분쇄고기가 가장 중요한 오염원으로 알려져 있다[13]. L. monocytogenes의 주된 감염경로는 오염된 식품의 섭취이다[14]. 이 균에 의한 감염증은 설사, 복통을 일으키는 비침습성 감염증과 패혈증, 뇌수막염으로 진행되는 침습성 감염증의 형태로 증상이 나타난다[15]. 대표적인 식중독균 중 하나인 Salmonella 속 균은 가축의 장관에 상존하며, 축산물 등 오염식품을 통하여 감염하여 급성 위장염, 식품 질환증 또는 몇몇 장기의 패혈증을 동반한 국소형 병소 등을 일으키는 중요한 장관 내 감염 세균으로 공중위생상 중요한 지표 세균으로 알려져 있다[16]. S. aureus 역시 대표적인 식중독균으로서 공기, 토양 등의 자연계에 광범위하게 분포한다[17]. 특히 식품에 오염된 S. aureus는 내열성의 장독소(enterotoxin)를 생성하여 구토, 설사, 위경련 등의 증상을 동반하는 독소형 식중독을 일으킨다[18, 19]. 유산균의 산 생성에 의한 병원균 억제는 가장 많이 연구된 항균활성의 기전이다. 대부분의 유산균은 젖산 및 초산과 같은 대사산물을 생산함으로써 pH를 낮추어, 유해균의 생성을 억제한다[20]. 따라서 본 연구에서는 티벳 요거트(Tibetan yogurt)로부터 분리한 유산균을 이용하여, 식중독을 유발하는 주요 원인균으로 알려진 E. coli O157:H7, L. monocytogenes, S. Typhimurium, S. aureus에 대한 항균효과를 확인하고자 하였다.
재료 및 방법
1. 균주 및 시약
본 실험에서는 티벳 요거트(Tibetan yogurt)에서 분리한 유산균주를 de Man, Rogosa and Sharpe(MRS, Neogen, USA)에 37℃, 48시간 배양하여 사용하였다. 실험에 사용한 병원균 E. coli O157:H7 ATCC 35150, S. Typhimurium KCTC 1925, S. aureus ATCC 29213은 Nutrient Broth(NB, Becton, Dickinson and Company, USA)에서, L. monocytogenes KCTC 3569은 Brain Heart Infusion(BHI, Becton, Dickinson and Company, USA)의 37℃에 24시간 동안 배양하였다.
2. Cell-free supernatants(CFS) 회수
7개의 균주 TY1, TY2, TY3, TY4, TY5, TY6, TY7을 MRS agar에 37℃, 48시간 동안 각각 배양하였다. 이후 16,000×g으로 4℃에서 10분 동안 원심분리 후 얻은 각 균주의 상등액을 0.2 μm Syringe filter(Samchun Chemical, Korea)로 차례대로 여과한 후 –80℃에서 보관하였다. pH를 보정한 CFS를 제조한 경우에는 동일한 방법으로 7개의 균주를 배양하여 16,000×g으로 4°C에서 10분 동안 원심분리 후 얻은 각 균주의 상등액의 pH를 1N NaOH를 사용하여 6.5로 보정하였다. 이후 0.2 μm Syringe filter로 차례대로 여과하여 –80℃에 보관하여 실험에 사용하였다.
3. 항균효과 분석
600 nm에서 흡광도를 0.06으로 맞춘 E. coli O157:H7 배양액 100 μL와 각 균주의 CFS 시료 100 μL를 96-well plate에 처리한 뒤, serial dilution하여 37℃, 24시간 배양하였다. 대조군은 접종하지 않은 fresh MRS broth를 사용하였고, 시료는 TY1, TY2, TY3, TY4, TY5, TY6, TY7로 pH를 보정하지 않은 CFS sample과 pH를 6.5로 보정한 CFS sample로 나누어 시료마다 항균효과 분석을 독립적으로 진행하였다. 이후 microtiter plate reader(AMR-100, Allsheng, China)로 595 nm에서 흡광도를 측정하였다. 동일한 방법으로 600 nm에서 흡광도를 0.06으로 맞춘 L. monocytogenes, S. Typhimurium, S. aureus 각각의 배양액을 fresh MRS broth를 대조군으로 사용하였으며, 각 CFS sample에 대하여 독립적으로 항균효과를 분석하였다.
4. 통계분석
모든 실험결과는 GraphPad prism 5(GraphPad SoftWare, USA)를 사용하여 3회 반복실험을 실시한 평균치와 표준편차를 나타냈다. 각 군 간의 유의성은 IBM SPSS Statistics 25(IBM, USA)를 사용하여 분산분석법(ANOVA)으로 나타냈다. 분산분석법 후 던컨시험(Duncan’s multiple range test)으로 p<0.05 수준에서 검정하였다.
결과 및 고찰
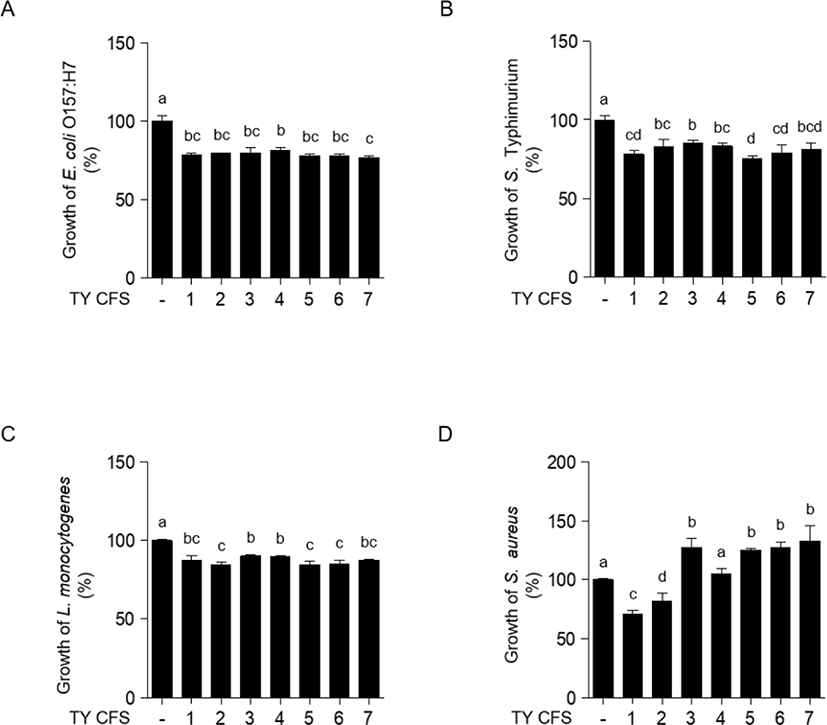
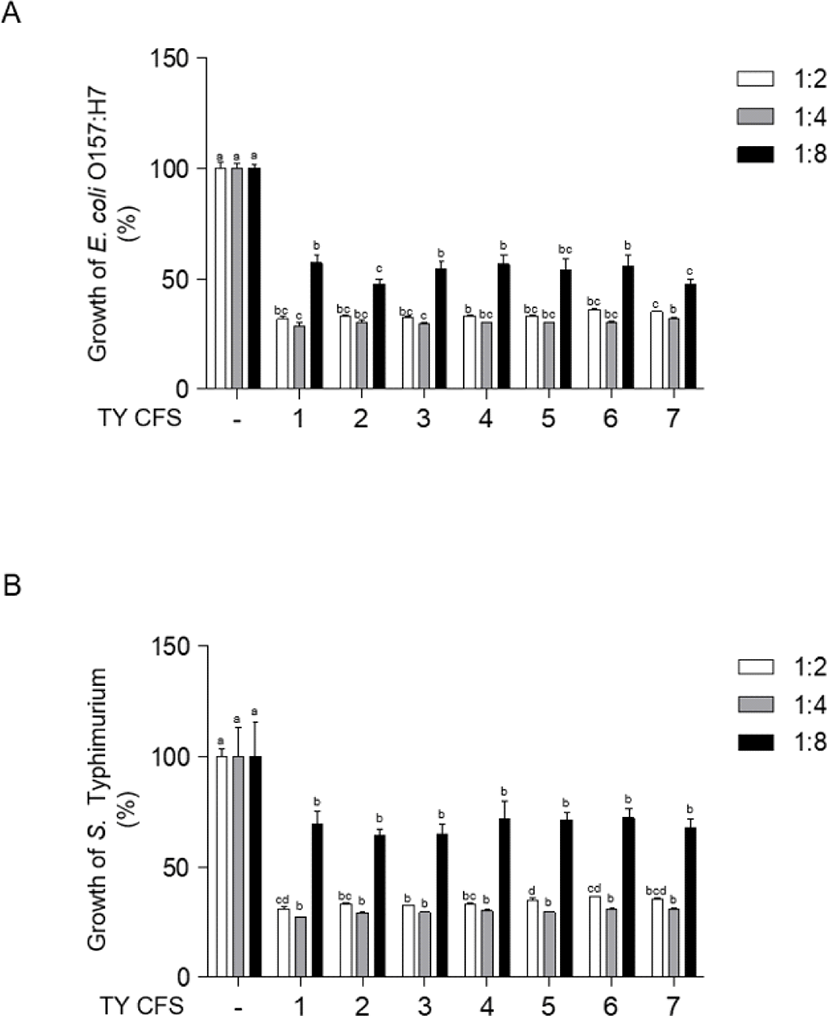
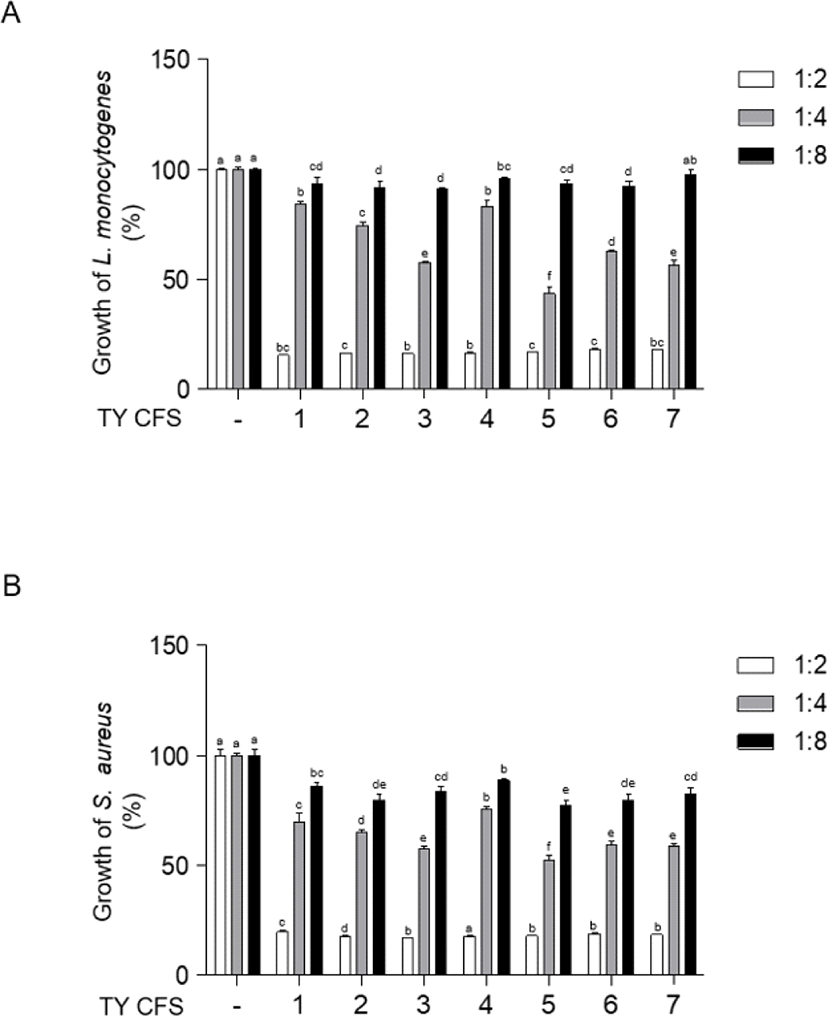
pH를 6.5로 보정한 7종의 CFS의 E. coli O157:H7, L. monocytogenes, S. Typhimurium, S. aureus에 대한 항균효과는 Fig. 1과 같다. 4개의 병원균에 대해 CFS 처리 후 595 nm에서 흡광도를 측정하였다. S. aureus에 대해 TY4 CFS를 1:2의 농도로 처리한 결과(Fig. 1D)를 제외하고는 4개의 병원균에 대해 1:2의 농도로 7종의 CFS를 독립적으로 처리한 결과(Fig. 1), 대조군과 통계적으로 유의미한 차이가 나타났다(p<0.05). Fig. 2와 Fig. 3은 E. coli O157:H7, L. monocytogenes, S. Typhimurium, S. aureus에 pH를 보정하지 않은 7종의 CFS를 각각 1:2, 1:4, 1:8의 농도로 처리한 후 독립적으로 항균효과를 분석한 결과이다. pH를 보정하지 않은 CFS 처리에 따른 흡광도 측정 결과, 4개의 균주에서 모두 대조군과 통계적으로 유의미한 차이가 나타났다(p<0.05). E. coli O157: H7, L. monocytogenes, S. Typhimurium, S. aureus에 대해 pH를 보정하지 않은 CFS를 처리한 결과(Fig. 2, Fig. 3)와 pH를 6.5로 보정한 CFS의 처리 결과(Fig. 1) 모두 CFS에 의해 유의미하게 억제되는 경향을 보였지만, pH를 보정하지 않은 CFS를 처리한 경우에서 더 큰 폭으로 억제되는 것을 확인하였다. Fig. 2와 Fig. 3에서는 1:4와 1:8의 농도로 각각 처리한 7종의 CFS와 4개의 균종을 독립적으로 24시간 처리하였을 때, 대조군과 비교하여 유의미한 생장 억제 효과를 확인하였다(p<0.05). 4개의 균종과 CFS를 1:8의 농도로 처리한 결과가 1:4의 농도로 처리한 결과에 비해 낮은 생장 억제 효과를 나타내었다. L. monocytogenes와 S. aureus는 E. coli O157:H7, S. Typhimurium보다 CFS를 1:4, 1:8의 농도로 각각 처리한 결과, 비교적 더 낮은 생장 억제 효과를 확인하였다. 티벳 요거트(Tibetan yogurt)에서 분리한 유산균의 CFS를 이용하여 그람음성균인 E. coli O157:H7, S. Typhimurium과 그람양성균인 L. monocytogenes, S. aureus에 대한 생장 억제 효과 특성을 확인하였다. 유산균의 CFS 제작 시 pH를 보정하지 않은 CFS와 pH를 6.5로 보정한 CFS를 각각 제작하여 4가지 병원균의 생장 억제에 관여하는 유기산의 생성에 대한 영향을 보고자 하였다. 따라서 pH를 6.5로 보정한 CFS를 사용하여 처리한 실험은 유기산을 제외한 유산균의 생성물질에 의한 생장 억제 효과임을 뒷받침한다. E. coli O157:H7, L. monocytogenes, S. Typhimurium, S. aureus에 대해 pH를 6.5로 보정한 CFS를 1:2의 농도로 처리했을 때 분리균주(TY1–7)는 미약한 생장 억제 효과를 나타내었다. 반면에, pH를 보정하지 않은 CFS를 1:2의 농도로 처리한 경우에는 4개의 병원균에 대하여 분리균주(TY1–7)가 뚜렷한 생장 억제 효과를 나타내었다. 이와 같은 결과는 티벳 요거트(Tibetan yogurt)에서 분리한 유산균주의 CFS에 포함된 유기산에 의해 병원균의 생장이 억제된 것이라고 생각된다. 또한, 본 연구의 균 생장 억제 결과(Fig. 2, Fig. 3) 모든 균주에서 비슷한 억제 양상을 확인하였다. 이는 4가지 병원균에 대해 1:2로 처리했던 CFS의 농도가 모든 병원균의 생장을 저해하기에 충분하여 나타난 결과라고 판단된다. 저농도에서의 TY CFS의 항균효과를 알아보기 위해, 추가적으로 pH를 보정하지 않은 CFS의 농도를 1:4, 1:8로 바꾸어 진행한 실험에서는 그람양성균, 그람음성균에 따라 억제 정도의 차이가 있음을 확인하였다(Fig. 2, Fig. 3). 그람음성균인 E. coli O157:H7, S. Typhimurium이 그람양성균인 L. monocytogenes, S.aureus에 비해 더 효과적으로 생장이 억제되었다. 유기산은 그람양성균에 비해 그람음성균을 더 잘 억제한다고 알려져 있다[21]. 본 연구 결과를 통해 그람음성균인 E. coli O157:H7, S. Typhimurium에 대한 억제 효과가 더 높은 것은 그람음성균을 더 효과적으로 억제하는 유기산의 성질에 의한 것이라고 추측한다.
Fig. 1.
Inhibition of foodborne pathogenic bacterial growth in the presence of CFS. E. coli O157:H7 ATCC 35150 (A), S. Typhimurium KCTC 1925 (B), L. monocytogenes KCTC 3569 (C), S. aureus ATCC 29213 (D) were co-incubated in the presence of neutralized CFS (pH 6.5) of TY1, TY2, TY3, TY4, TY5, TY6, TY7 at 37℃ for 24 h. The bacterial growth was determined at OD595. -, The growth rate of foodborne pathogenic bacteria without CFS was assigned to 100%. CFS, cell-free supernatants.
Download Original Figure
Fig. 2.
Inhibition of foodborne pathogenic bacterial growth in the presence of CFS. E. coli O157:H7 (A), S. Typhimurium (B) were co-incubated in the presence of CFS without neutralization of TY1-7 at 37℃ for 24 h. 1:2 is treated in the same ratio of volume as CFS and subcultured pathogenic bacteria. 1:4 and 1:8 are treated in the 1:4, 1:8 volume of CFS which is diluted with fresh MRS broth media. -, The growth rate of foodborne pathogenic bacteria without CFS was assigned to 100%. CFS, cell-free supernatants; MRS, de Man, Rogosa and Sharpe.
Download Original Figure
Fig. 3.
Inhibition of foodborne pathogenic bacterial growth in the presence of CFS. L. monocytogenes (A), S. aureus (B) were co-incubated in the presence of CFS without neutralization of TY1-7 at 37℃ for 24 h. 1:2 is treated in the same ratio of volume as CFS and subcultured pathogenic bacteria. 1:4 and 1:8 are treated in the 1:4, 1:8 volume of CFS which is diluted with fresh MRS broth media. -, The growth rate of foodborne pathogenic bacteria without CFS was assigned to 100%. CFS, cell-free supernatants; MRS, de Man, Rogosa and Sharpe.
Download Original Figure
감사의 글
본 연구는 동국대학교 식품생명공학과 연구지원사업에 의해 진행되었음.
References
Noh YH, Jang AS, Pyo YH. Quality characteristics and antioxidant capacities of Korean commercial yogurt. Korean J Food Sci Technol. 2020;52:113-118.

Yang J, Choi I. Comparisons of the physicochemical characteristics, antioxidant properties, and consumer acceptance of Greek-style yogurt enhanced with black tea syrup instead of sugar syrup. J East Asian Soc Diet Life. 2021;31:36-49.


Ann YG, Jang BC, Park SJ. Biological activity and improvement effect on irritable bowel syndrome of wax gourd extract and probiotic lactic acid bacteria. Korean J Food Nutr. 2013;26:137-145.


Lee KE, Choi UH, Ji GE. Effect of kimchi intake on the composition of human large intestinal bacteria. Korean J Food Sci Technol. 1996;28:981-986.

Ko KH, Liu W, Lee HH, Yin J, Kim IC. Biological and functional characteristics of lactic acid bacteria in different kimchi. J Korean Soc Food Sci Nutr. 2013;42:89-95.


Ham JS, Kim HS, Noh YB, Chae HS, Ahn CN, Han GS, et al. Anti-allergy effect of lactic acid bacteria. J Dairy Sci Biotechnol. 2007;25:21-25.

Seo JH, Lee H. Characteristics and immunomodulating activity of lactic acid bacteria for the potential probiotics. Korean J Food Sci Technol. 2007;39:681-687.

Kato I, Endo K, Yokokura T. Effects of oral administration of Lactobacillus casei on antitumor responses induced by tumor resection in mice. Int J Immunopharmacol. 1994;16:29-36.


Ryu EH, Yoon HH, Jung JH. Characteristics of lactic acid fermentation of black raspberry juice using the Lactobacillus plantarum GBL17 strain. Korean J Food Cook Sci. 2015;31:773-780.


Lee JY, Hwang KY, Kim G, Sung SI, Park YS, Baek MJ, et al. Characteristics of antimicrobial organic acids produced by Lactobacillus pentosus K34 isolated from small intestines of Korean native chickens. Microbiol Biotechnol Lett. 2002;30: 241-246.

Lee HA. Antimicrobial activity of Maesil (Prunus mume) juice against selected pathogenic microorganisms. Korean J Food Nutr. 2003;16:29-34.

Oussalah M, Caillet S, Saucier L, Lacroix M. Inhibitory effects of selected plant essential oils on the growth of four pathogenic bacteria: E. coli O157:H7, Salmonella typhimurium, Staphylococcus aureus and Listeria monocytogenes. Food Control. 2007;18:414-420.


Ahn YT, Shin PK, Kim HU. Growth inhibition of Escherichia coli O157:H7 and Salmonella typhimurium by lactic acid bacteria and bifidobacteria. Korean J Food Hyg Saf. 1997;12:181-187.

Kim SH, Park YH. Reemergence of foodborne pathogen Listeria monocytogenes. Safe Food. 2010;5:13-18.

Ahn YT, Lim JH, Kang HJ, Jang YH, Kim HU. Survival of Escherichia coli O157:H7 and Salmonella ser. Typhimurium in fermented milk products. J Food Hyg Saf. 1997;12:175-180.

Yum SJ, Kim SM, Yu YC, Jeong HG. Inhibition of growth and biofilm formation of Staphylococcus aureus by corosolic acid. Korean J Food Sci Technol. 2017;49:146-150.


Park HJ, Bae HJ. Hazard analysis of Staphylococcus aureus in ready-to-eat sandwiches. J Korean Soc Food Sci Nutr. 2007;36:938-943.


Vandenbergh PA. Lactic acid bacteria, their metabolic products and interference with microbial growth. FEMS Microbiol Rev. 1993;12:221-237.


Reis JA, Paula AT, Casarotti SN, Penna ALB. Lactic acid bacteria antimicrobial compounds: characteristics and applications. Food Eng Rev. 2012;4:124-140.