서 론
간은 인슐린 등의 호르몬과 영양 상태에 따라 잉여 당을 글리코겐 형태로 저장하고, 당 부족 시에는 저장된 글리코겐 분해를 통해 혈당을 일정하게 유지한다[1]. 간 내 글리코겐 대사의 정확한 조절은 혈당을 낮추고, 에너지가 필요한 주변 세포로 전달하여 에너지 대사에 참여하여 항상성을 유지한다[2]. 고지방식이에 의한 비만 유도는 비정상적인 글리코겐 대사와 고혈당 상태를 유발하여 궁극적으로는 제2형 당뇨 및 심혈관계 질환의 원인이 될 수 있다[3].
글리코겐 합성과정에서 포도당은 glucose transporter 2(GLUT2)를 통해 혈액에서 간세포로 이동하며, 세포 내에서 활성화된 glucokinase(GCK)에 의해 포도당-6-인산으로 인산화되고 glycosyltransferase 2(GYS2)에 의해 우리딘이인산포도당에 글리코실기가 결합하여 최종적으로 글리코겐으로 전환하게 된다[4]. 이와 반대로, glucose-6-phosphatase(G6PC)이 활성화되면 글리코겐 분해가 촉진되어 포도당-6-인산이 포도당으로 전환하게 된다[5]. 또한, 공복 상태일 때 간세포 핵 내에서 glucokinase regulatory protein(GCKR)이 활성화되어 GCK와 결합하여 GCK의 활성을 억제하여 포도당 저장을 억제하는 반면, 식후 상태에는 활성화된 GCK가 세포질로 이동하여 세포질 내 포도당과 결합하여 글리코겐 합성의 초기 단계인 포도당-6-인산 생성을 촉진한다[6]. 간에서 글리코겐 대사를 조절하는 GYS2, GCK 효소와 포도당 운반단백질인 GLUT2의 결핍 및 이상은 식후 글리코겐 합성 감소, 혈액 내 포도당 농도의 과다한 증가를 유발하거나 반대로 공복 상태에서 글리코겐이 포도당으로 전환이 저해되어 저혈당을 동반하는 당원 저장증(glycogen storage disease)을 유발하는 것으로 보고되었다[7].
유산균은 대표적인 프로바이오틱스 미생물로서 유제품, 김치, 장류 등의 발효식품의 제조에서 널리 쓰이고 있다[8]. 현재까지 많은 유산균 균주가 프로바이오틱스로서 비만, 당뇨, 급성설사증 예방 및 고콜레스테롤 혈증 억제, 면역력 강화 등의 효능을 가지는 것으로 보고되고 있다[9]. 또한 고지방식이에 의해 유발되는 비만과 제2형 당뇨와 같은 대사질환의 예방 방안의 하나로 유산균의 연구가 활발히 진행되고 있으며, 최근 우리의 연구에서는 유산균주인 Lactobacillus acidophilus NS1(LNS1)와 Lactobacillus amylovorus KU4의 경구투여가 고지방식이(high-fat diet, HFD) 마우스에서 각각 간의 지질대사 개선, 백색지방의 갈색화를 통한 에너지소모 증가를 통해 체중증가율 감소, 혈당증가 억제 및 인슐린 저항성 개선을 유도하여 고지방식이에 의한 비만, 당뇨 유발을 억제시키는 것으로 확인되었다[10,11].
특히 본 연구에 사용된 LNS1은 고지방식이 마우스의 간에서 SREBP-1c, PPARα의 전사활성 조절을 통해 지질합성은 억제하고, 지방산 산화를 촉진하여 고지방식이에 의해 유도되는 비만을 억제하고, 인슐린저항성을 개선하는 효능을 가지는 것으로 보고되었으며, 또한 간의 또 다른 주요 전사조절자인 HNF4α의 활성 조절을 통해 당신생합성의 주 효소 중 하나인 phosphoenol pyruvate carboxykinase(PEPCK) 발현을 억제함을 밝혔다[11–13].
본 연구에서는 LNS1이 간 내 글리코겐 대사에 미치는 효과를 검증하기 위하여 고지방식이 마우스에서 간의 글리코겐 대사에 참여하는 주요 유전자들의 발현과 글리코겐 함량에 대한 LNS1의 영향을 조사하였다. LNS1은 고지방식이 마우스의 간과 간암 세포주인 HepG2 세포에서 포도당-글리코겐 전환 과정에 참여하는 GLUT2와 GYS2의 발현은 증가시키고, GCKR과 G6PC의 발현은 감소시켜 간 내 글리코겐 함량을 높이는 것으로 조사되었다.
재료 및 방법
모든 동물실험 절차는 전남대학교 동물실험윤리위원회의 승인을 받은 방법에 따라 수행되었다(CNU IAUCC-YB-2012-40). 7주령의 C57BL/6 수컷 마우스(무게 19±2 g; 중앙실험동물, Korea)를 고지방식이(HFD; 열량비 45% 지방 식이; Research Diets, USA)를 섭취시켰다. PBS에 희석된 300 μL의 유산균 LNS1(1.0×108 CFU/mL) 또는 PBS를 고지방식이 마우스에 12주 동안 매일 경구 투여하였다.
HepG2 세포는 10% Fetal bovine serum(Gibco, USA)과 1% penicillin/streptomycin (Gibco)이 포함된 Dulbecco’s Modified Eagle Medium(HyClone, USA) 배지에서 37℃, 5% CO2 조건에서 배양하였다.
마우스 간과 HepG2 세포에서 RiboEXTM(GeneAll, Korea)를 사용하여 total RNA를 회수하여 MMLV-RTase(Promega, USA)와 Oligo dT primer(Promega)를 사용하여 cDNA를 합성하였다. cDNA는 eTaq polymerase(Solgent, Korea)을 사용하여 각 유전자의 프라이머 서열에 따라 증폭시켰으며, Gel doc XR system(Bio-Rad, USA)을 사용하여 36B4 발현에 대조하여 각 유전자의 발현 정도를 정량하였다. 프라이머의 서열은 Table 1과 같다.
결과 및 고찰
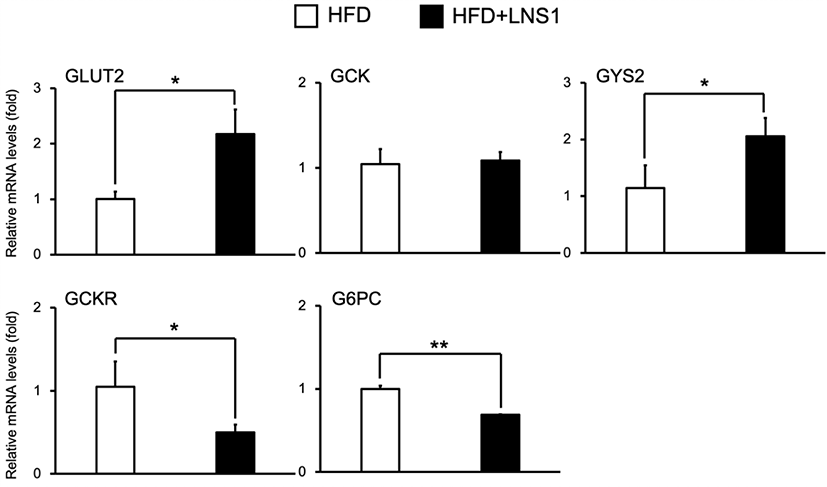
이전의 연구에 따르면 고지방식이(HFD) 마우스에서 LNS1의 경구 투여는 고지방식이에 의한 체중 증가 감소, 간 내 지방산 합성 억제 및 지방산 산화 활성, 혈당 감소 및 인슐린 저항성 개선 효과를 가지는 것으로 보고되었다[11,13]. 특히 LNS1은 고지방식이 마우스의 간에서 전사 인자 HNFα의 전사 활성을 억제하여 PEPCK의 발현을 감소시켜 당신생합성을 조절하는 것으로 확인되었다[12]. 고지방식이에 의해 유도되는 인슐린 저항성 상태는 포도당 대사의 이상을 불러일으켜 포도당-글리코겐 전환 과정을 억제하여 글리코겐 합성의 저하로 이어진다[14]. 글리코겐 대사에 참여하는 주요 운반체단백질 및 효소인 GLUT2, GCK 그리고 GY2의 유전자 발현은 일반 식이 마우스와 비교하여 고지방식이에 의해 감소하며, GCKR과 G6PC의 유전자 발현은 증가하는 것으로 알려져 있다[15–18]. 고지방식이에 의한 글리코겐대사 이상 상태에서 LNS1이 간에서 글리코겐대사의 주요 역할을 하는 운반체단백질 및 효소들의 발현조절에 미치는 영향을 조사하기 위하여 고지방식이 마우스(HFD 마우스)와 고지방식이와 함께 LNS1을 경구투여 한 마우스(HFD+LNS1 마우스)의 간에서 RT-PCR을 통해 이들 유전자의 발현을 비교하였다. HFD와 함께 LNS1의 경구 투여는 간 조직에서 글리코겐 합성과정의 주요 유전자인 GLUT2와 GYS2의 mRNA 수준을 HFD 마우스와 비교하여 각각 약 2배, 1.8배 증가시켰으며, GCK의 발현에는 영향이 없는 것으로 나타났다(Fig. 1). 이와 반대로, HFD+LNS1 마우스의 간 조직에서는 글리코겐 분해과정의 주요 유전자들인 GCKR와 G6PC의 발현이 HFD 대비 각각 53%, 32% 감소시키는 것으로 나타났다. 이는 LNS1이 HFD 마우스의 간 내 글리코겐 합성 과정에서 GLUT2의 발현 증가를 통해 혈액에서 간세포로 포도당 흡수를 촉진하고, GYS2의 발현 증가를 통해 글리코겐 합성을 촉진시킬 수 있음을 제시한다. 한편, LNS1의 투여는 간 내에서 GCK 활성화를 억제하는 GCKR의 발현 감소를 유발하는 것으로 조사되어 GCK의 발현 변화와 상관없이 GCK 활성이 증가되어 세포 내로 운반된 포도당의 글리코겐 전환을 촉진할 것으로 예상된다. 이와 함께, LNS1은 글리코겐 분해 과정에서 포도당-6-인산이 포도당으로 전환되는 것을 억제하는 G6PC의 발현도 감소시키는 것으로 확인되었다. 위의 결과들은 LNS1이 HFD 마우스의 간에서 포도당 운반, 글리코겐 대사에 참여하는 주요 단백질 유전자들의 발현의 조절을 통해 혈액 내 포도당의 간 조직으로의 운반 및 글리코겐 합성의 증가를 유발시켜 궁극적으로는 HFD에 의한 혈당 증가를 억제시키는 기작으로 작용할 것으로 사료된다.
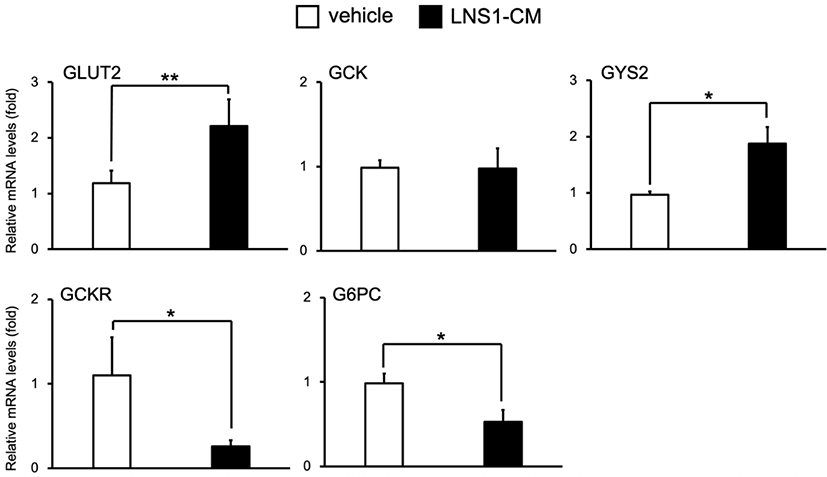
HFD 마우스의 간에서 LNS1의 에너지대사 조절 역할과 마찬가지로 HepG2 세포에서 LNS1 배양 조건배지(LNS1-CM, LNS1-conditioned media)의 처리는 지방산 합성 및 지방산 산화과정에 참여하는 주요 전사조절인자와 당신생합성 전사조절인자의 발현 및 활성을 조절하는 것으로 나타났다[11–13]. 고지방식이 마우스 간에서 LNS1이 포도당 운반체 단백질과 글리코겐 합성 및 분해 과정에 참여하는 주요 효소 유전자들의 발현 조절을 확인하였으므로, LNS1-CM이 HepG2 세포의 글리코겐 합성 및 분해 과정에 참여하는 주요 유전자들 발현에 있어서 LNS1과 동일한 효과를 가지는지 알아보기 위하여 HepG2 세포에 LNS1-CM을 24시간 처리 후 RT-PCR을 진행하였다. 실험 결과, HFD 마우스의 간 조직에서와 마찬가지로 LNS1-CM은 HepG2 세포에서 GLUT2와 GYS2의 발현을 vehicle 대비 각각 약 1.9배, 2배 증가시켰으며, GCK의 발현에는 영향을 주지 않는 것으로 확인되었다(Fig. 2). GCKR과 G6PC의 발현 또한 vehicle과 비교하여 LNS1-CM에 의해 각각 77%, 47% 감소됨을 보였다. 이 결과들은 in vivo와 in vitro 모두에서 각각 LNS1, LNS1-CM에 의해 포도당 운반체, 글리코겐 합성 및 분해 경로 효소 유전자들의 발현이 조절됨을 보여주고 있다.
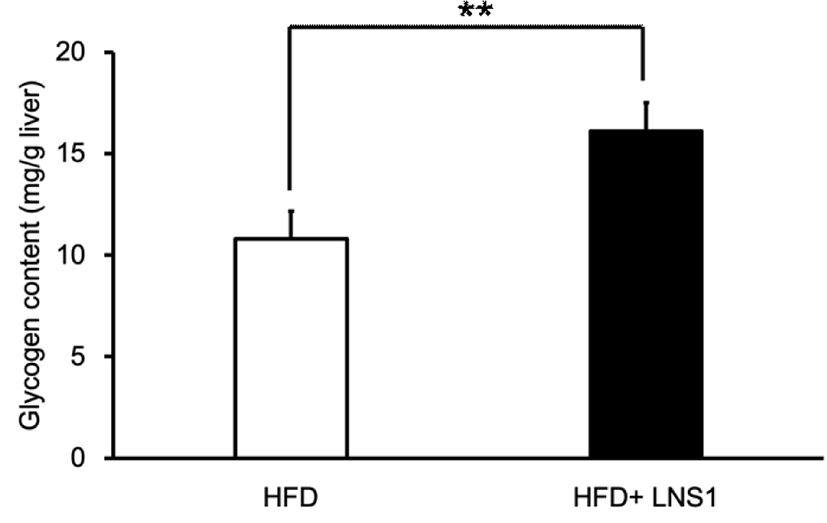
일반식이와 비교하여 고지방식이를 실시한 마우스의 간에서 글리코겐 함량이 다소 낮게 나타난다는 연구결과가 보고된 바 있다[19,20]. LNS1이 고지방식이 마우스의 간에서 글리코겐 대사에 참여하는 주요 유전자들의 발현을 조절하는 것으로 확인되었으므로 LNS1 투여가 실제로 고지방식이 마우스 간의 글리코겐 함량에 영향을 주는지를 확인하기 위하여 HFD 마우스와 HFD+LNS1 마우스의 간에서 글리코겐 함량을 측정하여 비교하였다. Fig. 3에서 보는 바와 같이, HFD 마우스의 간 조직의 글리코겐 함량은 10.8 mg/g(liver weight)인데 비하여 HFD+LNS1 마우스의 간 조직 내 글리코겐 함량은 16.1 mg/g(liver weight)으로 조사되어 LNS1 경구 투여가 HFD 마우스에서 간 조직 내의 글리코겐 함량을 약 1.5배 증가시키는 것으로 확인되었다. 이러한 LNS1의 글리코겐 함량의 증가는 Fig. 1, 2에서 볼 수 있는 바와 같이 LNS1에 의한 GLUT2 및 GYS2의 발현 증가로 인해 혈액으로부터 간세포로의 포도당 운반 증가와 글리코겐 합성 최종단계인 우리딘이인산포도당의 글리코실화 촉진을 통해 이루어졌을 가능성이 제시된다. 또한 LNS1에 의해 GCK의 발현은 변화하지 않았으나, GCK 억제자인 GCKR의 발현이 감소된 것으로 보았을 때 GCK 활성화로 인한 포도당의 포도당-6-인산으로의 전환 촉진도 글리코겐 함량 증가에 기여했을 것으로 사료된다. 특히, LNS1에 의해 발현이 감소되는 G6PC와 PEPCK의 경우, AMPK에 의해 활성이 억제되는 것이 알려져 있고, 이전의 연구에서 고지방식이 마우스의 간에서 LNS1에 의해 AMPK의 인산화가 촉진되는 것이 확인되었으므로[11,21], Fig. 3에서 보여준 LNS1에 의한 간의 글리코겐 함량 증가는 LNS1의 AMPK 활성화가 글리코겐 분해 및 당신생합성과정에 참여하는 G6PC와 PEPCK의 활성을 억제하여 나타나는 결과일 가능성도 있다. LNS1에 의한 글리코겐 함량 증가에 있어서 AMPK 역할에 대한 결론은 앞으로 추가적인 연구를 통해 밝혀져야 할 것이다.
또한, 인슐린 신호 경로에서 중요한 역할을 하는 AKT 인산화는 하위신호조절자인 GSK3의 인산화를 촉진하고 GSK3 활성을 억제하여 GSK3에 의해 억제되는 글리코겐의 합성을 촉진하는 것으로 알려져 있다[11,22]. LNS1은 AKT의 인산화도 촉진하는 것으로 보고되었으므로, LNS1의 간 글리코겐 함량 증가에 있어서 AKT의 연관성에 관한 추가적인 연구 또한 필요할 것으로 사료된다.
요 약
본 연구는 고지방식이 마우스에서 체중 감소, 혈당 감소 및 인슐린 저항성 개선 효과를 가지는 LNS1 균주의 간 내 글리코겐 함량에 미치는 영향을 조사하여 고지방식이에 의한 비정상적인 글리코겐 대사 개선을 위한 활용 가능성을 검토하고자 실시하였다. LNS1을 12주간 경구 투여한 고지방식이 마우스의 간에서 포도당 운반체 단백질인 GLUT2와 글리코겐 합성의 주요 효소인 GCK, GYS2의 유전자 발현 변화를 확인한 결과, LNS1의 경구 투여는 고지방식이 마우스에 비해 GLUT2와 GYS2의 유전자 발현을 각각 약 2배, 1.8배 증가시켰으며, GCK의 발현에는 영향을 주지 않는 것으로 확인되었다. 또한, GCK의 regulatory unit으로 작용하여 GCK의 활성을 억제하는 GCKR와 글리코겐 분해 과정의 주요 효소인 G6PC의 발현은 LNS1 투여에 의해 HFD마우스에 비해 각각 약 53%, 32% 감소함을 보였다. 간 조직에서의 결과와 마찬가지로 HepG2 세포에 LNS1-CM의 처리는 GLUT2와 GYS2의 유전자 발현을 약 1.9배, 2배 증가시켰으며, GCK의 발현 변화에는 영향을 주지 않는 것으로 확인되었다. GCKR과 G6PC의 유전자 발현 또한 LNS1-CM 처리에 의해 각각 77%, 47% 감소함을 보였다. 또한, 간 조직 내 글리코겐 함량은 고지방식이와 LNS1 투여를 병행한 마우스에서 고지방식이 마우스에 비해 약 1.5배 증가한 것으로 조사되었다. 위의 결과들을 종합해 볼 때, LNS1은 GLUT2, GYS2, GCKR와 G6PC의 발현 조절을 통해 간 조직내 글리코겐 함량을 증가시켜 고지방식이에 의한 글리코겐 대사 이상을 개선시키는 효과를 가지는 것으로 사료된다.






