서 론
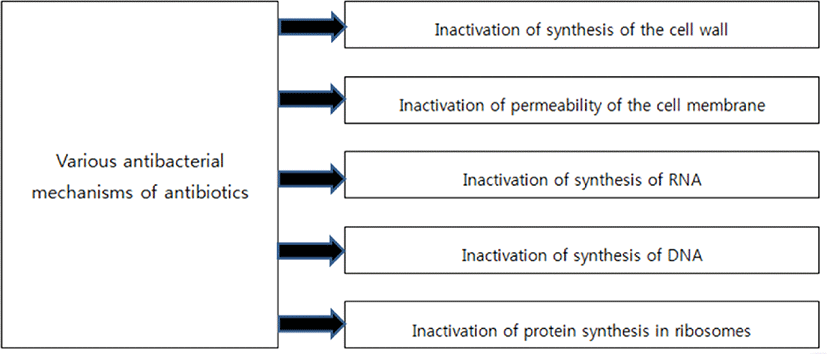
항미생물(또는 항균) 저항은 인류의 주요 안전 문제 중 하나가 되었고, 세계보건기구(WHO), 식품농업기구(FAO), 미국 식품의약국(FDA), 유럽식품안전청(EFSA) 등 여러 기관이 이 문제에 대한 인식을 높이고 있다[1,2]. 항균 저항은 미생물(박테리아, 곰팡이, 바이러스, 기생충)이 항균제(항균제, 항바이러스, 항진균제 등)에 지속적으로 노출될 때 발생할 수 있으며, 적응 과정의 결과 보통의 상태에서는 비활성화 시킬 수 있지만 일부 미생물은 항균제 존재하에서도 생존하고 자랄 수 있다[1–3]. 특히 항생제는 인간과 동물의 세균 감염을 치료하기 위해 사용되는 약으로, 세균의 번식을 막거나 여러 메커니즘을 통해 불활성화한다[3]. 예를 들면, cyloserine과 fosfomycine는 peptidoglycan 합성을 위한 전구체를 억제하고, bacitracin과 mueridomycins는 세포막을 통한 세포벽 전구체의 운반 중지한다[1,4]. β-lactams(cephalosporins, penicillin derivates 등)와 glycopeotides(vancomycin, teicoplanin)은 penicillin 결합단백질(PBP) 수준에서 세포벽 peptidoglycan의 중합 및 교차결합 과정의 차단 등이 세포벽에서 일어난다[5]. Polymyxins은 작은 대사산물의 연속적인 손실로 막투과성을 증가시키고, lipopetides(daptomycin)은 단백질과 DNA 합성을 감소시키는 세포질막을 탈극화하며, 그리고 ionophores(valinomycin, tirocydins)와 gramicydins는 모공 형성에 의한 막의 변화 등이 세포질막에서 일어난다[1,4,5]. Mupirocin은 단백질 활성화 과정을 불활성화시키며, 또한 oxazolidiones와 aminoglycosides는 단백질 합성 시작을 억제하며, 또한 tetracycline와 glycylcyclines는 tRNA 아미노산 복합체이 리보솜에 붙는 것을 차단하고, 그리고 amphenicols, lincosamides, macrolides, ketolides는 50S 리보솜 서브유닛의 peptidyl 전달효소를 차단하여 단백질 최종 신장단계의 변형 등이 단백질 합성에서 일어난다[4,5]. Nitroimidazoles와 nitrofurans는 DNA 의존 RNA 중합효소에서의 DNA 복제 과정을 변형시키고, 또한 quinolones는 최종 DNA 코일링 공정의 비활성화 등이 DNA 합성에서 일어난다[4,5]. 그리고 clavulanic acid, sulbactam, tazobactam은 β-lactam 항생제에 대한 내성을 제공하거나 또는 항생제 활성 유출 과정을 차단하는 박테리아 효소 β-lactamases부터 보호 등이 저항메커니즘에서 일어난다[1,4,5]. 간단히 정리하면 세포벽 또는 세포질 막의 합성을 억제하거나 단백질 합성이나 DNA 복사 과정을 차단하거나, 물질대사를 변경하거나, 박테리아 저항 경로에 직접 작용하기 때문이다(Fig. 1).
인간의 cephalosporins, broad-spectrum penicillins, fluoroquinolones 등과 같은 항생제 사용은 2000년부터 2010년까지 36% 증가했는데, 주로 박테리아의 감염에 의한 원인보다는 바이러스 치료에 대한 부적절한 처방과 소비 때문이다[6]. 이러한 사실은 항균 저항과 관련하여 매년 70만 명 이상의 사망자가 발생한다는 세계적인 항균 저항 보고서와 관련이 있을 수 있으며, 2050년까지 매년 1,000만 명의 사망자가 발생할 것으로 전망되고 있다[7]. 항균 저항은 능동 항균 분자의 직접적인 비활성화를 가능하게 하는 저항성 유전자의 존재와 관련된 여러 메커니즘뿐만 아니라, 항생제의 타겟 사이트(target site)를 변형시켜 항생제의 결합력을 저하시키거나, 항균 흡수 감소에 의한 항균에 대한 민감성 상실 등이 포함한다[1,4,5]. 따라서 항균제는 효력이 없어지고, 저항성 미생물이 살아남아 다른 미생물에 저항성 시스템(resistant machinery)을 옮겨 공중 보건에 위협이 될 수 있다[2,3,6]. 항균 내성 미생물의 존재는 인간과 동물의 건강 모두에 영향을 미칠 뿐만 아니라, 식품, 농작물, 가축, 양식업의 확산과 오염 위험도를 증가시킬 수 있다[3,8].
특히 FAO는 정확한 보고와 체계적 관리없이 농축산용 동물에 빈번하게 사용되고 있는 27종의 항생제에 대해서 항생제 사용 및 통제와 관련된 데이터를 수집하도록 요구하고 있다[9]. 따라서, WHO 관련 기관들은 2017년에 전세계에서 항균 저항성에 대한 인식을 글로벌 프로그램의 일환으로 높이기 위한 캠페인을 시작하였다[9]. 이 캠페인은 항생제와 항생제 내성에 대해 배우기를 원하는 정부, 보건 전문가, 식품 및 사료 산업가, 그리고 사회가 참여하는 국제활동으로 구성되어저 있다. 여기에는 건강관리시설에서 항생제 내성을 가지는 Acinetobacter, Enterobacteriaceae, Pseudomonads 등의 예방과 통제에 관한 일부 지침도 포함하고 있다. 또한, WHO는 현재 인간의 약으로 사용되는 항생제의 효과를 보존하기 위해서 농부들과 식품산업분야에 건강한 동물들에게 항생제 사용을 중지할 것을 권고하고 있다[4,9]. 항균 저항성에 대한 세계적 실천 계획은 이 문제가 사회와 정부가 참여해야 하는 공공 보건과 지속 가능한 식량 생산에 점점 더 심각한 위협이 되고 있다. 또한 보건, 식품, 농업 분야 및 환경 전문가는 공통 병원균(특히 병원균 및 일반 감염균)에 의한 항균 저항의 확산을 대비할 수 있는 방법을 적극적으로 장려해야 된다고 언급하고 있다[9,10]. 세계 인구가 증가함에 따라 식품에 대한 수요가 증가하게 되는데, 여기서 항생제, 살균제와 같은 항균제가 농작물뿐만 아니라 식량을 생산하는 동물(소, 돼지, 가금류, 생선)의 감염을 치료하기 위해 자주 사용되며, 질병을 예방 목적과 동시에 성장 촉진제로써도 사용되고 있다[4]. 이러한 관행은 개발도상국에서 자주 발생하는데, 예를 들면 인도의 가금류에서 분리된 다중 항생제에 내성이 있는 Enterococcus와 Lactobacillus 균주의 발생은 허가받지 않고 다량의 항생제가 사용되었기 때문이다[4,9]. 또한, FAO는 항생제의 90%가 물과 토양으로 배설되어 환경을 오염시킬 수 있으며, 이로 인해 노출이 증가하고 다른 미생물에 내성 유전자를 옮길 수 있는 항생제내성 미생물이 발생될 수 있다고 보고한다[9]. 예를 들어 penicillin, polymyxins, sulfonamide, tetracycline 등과 같은 항생제에 노출된 동물의 장내세균들은 저항성이 대략 5배나 더 높았다[1]. 내성 미생물은 오염된 음식과 물 또는 환경으로부터 인간에게 전파될 수 있다[4,9]. 예를 들어, 적절한 동물 백신 접종, 사료 변환의 효율과 건강을 증진시키는 첨가제의 사용과 병행하여 동물들이 깨끗한 환경에 놓여 있도록 다양한 노력을 한다면 식품 생산을 위한 항생제 및 항균제의 사용량을 줄일 수 있을 것이다[7].
LAB(Lactic acid bacteria, 유산균)는 여러 서식지에 존재하는 가장 중요한 미생물군 중 하나를 구성하고 있으며, LAB는 동물과 인간의 위장관에 많은 수가 있고 몇몇 음식에서 장내세균(microbiota)의 일부를 형성한다[2,3,6,8]. 역사적으로 LAB는 FDA와 EFSA 당국이 부여한 GRAS (generally recognizes as safe)와 QPS(qualified presumption of safety) 상태를 통해 안전하다고 인정받아 왔다. 그러나 최근 항생제 내성 LAB의 검출과 환경조건에 대한 지속적인 노출은 LAB가 항생제 내성 유전자에 대한 내성적 또는 외성적 저장장소로 되는 것을 촉진할 수 있으며, 이는 식품 가공공정을 통해 병원균이 수평적으로 전염될 수 있음을 의미한다[4]. 미생물이 항균의 타겟 사이트를 가지고 있지 않을 경우, 특정 항균에 대한 저항은 내재가 되거나 획득될 수 있다. 획득된 저항은 더 복잡하며, 타겟 사이트의 항균, 전사후, 또는 번역후 변형을 불활성화하는 효소의 존재 또는 항균의 감소 흡수 및 활성 유출을 포함한다. 이러한 메커니즘은 외생 DNA의 이득이나 내생 DNA의 돌연변이를 통해 유래된다[11]. 일반적으로 항생제 유전자는 한 미생물에서 다른 미생물로 형질도입에 의해 박테리오파지를 통하거나 또는 다른 미생물이 DNA를 방출했을 때 미생물간 변환에 의해 수평적으로 전달될 수 있다. 그러나, 내성을 획득하는 일차적인 메커니즘은 세포와 직접 접촉하거나 다른 박테리아의 생성 간 결합에 의한 것이며, 특히 플라스미드와 트랜스폰스(transposons)와 같은 이동 유전 요소에 저항 유전자가 존재할 때 더 활발하게 일어난다[5,11]. LAB는 적응성이 뛰어나고 항생제에 대한 내성을 가질 수 변화하게 된다. 대부분의 항생제 내성 연구는 병원성 미생물에 초점을 맞추어져 있었지만, 그러나 최근 일부 연구자들은 발효식품에서 분리된 Enterococci, Lactococcus lactis, Lactobacillus 균의 일부 변종이 erythromycin, tetracycline, vancomycin 등에 저항성을 부여한 유전자를 보여주었기 때문에 동식물에 공생하는 LAB의 안전성에 의문을 제기하고 있다[1,2,4,5,8]. 항생제에 대한 박테리아 저항성은 전염병 치료에 사용되는 약제의 효능을 손상시킬 수 있는 새로운 대중적 관심사다[3,6].
따라서 본 총설의 목적은 식품산업에서 널리 사용되는 LAB 종류, 항생제 내성 LAB의 개요 그리고 항생제 내성 LAB를 검사하는 몇 가지 방법을 등을 제시하여, 현재 사용되고 있는 LAB 제품의 품질과 안전성에 관한 현황과 전망을 제시하고자 하는데 있다. 또한 모든 자료들은 이미 발표된 문헌 등을 조사하여 재정리하였다.
LAB이라는 용어는 Gram 양성 박테리아, 통성혐기성, 비포자성형성, 비운동성, 그리고 산에 대한 내성이 있는 원형 또는 구형으로 분류학적으로 다양한 집단으로 이루어져 있다[1]. 심지어는 하나 또는 4개 또는 긴사슬로 연결되어져 있기도 하며, 특히 당(예를 들면, 설탕 등)을 발효하여 유산을 생성할 수 있는 일반적인 물질대사를 한다. LAB 종은 Firmicutes와 Actinobacteria 두 개의 문(Phylum)에서 발견되는데, 먼저 Aerococcus, Alloiococcus, Carnobacterium, Enterococcus, Lactobacillus, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus, Weissella 등은 낮은 G+C(31%–49%) 함량으로 Bacilli class와 Lactobacillales order에 속하며, 그 다음으로 Bifidobacterium genus는 높은 G+C content(58%–61%) 함량으로 Actinobacteria phylum에 속한다[12].
일반적으로 LAB는 포도당 대사에서 파생된 최종 산물에 따라 동형발효(homofermentative)와 이형발효(heterofermentative)로 분류된다. 동형발효는 주로 Embden-Meyerhof 경로에 의해 포도당을 유산으로 변환시키고, 이형발효 LAB는 6-phosphogluconate 경로에 의해 포도당을 유산, 이산화탄소, 에탄올 또는 아세트산으로 변환시킨다. LAB는 높은 내산성과 redox 변화에 적응할 수 있는 능력 때문에 영양소와 접착되는 환경(adhesion niches) 경쟁에 근거하여 부패균과 병원성 박테리아의 성장을 억제할 수 있다[12]. 또한 LAB는 유산 및 아세트산, 에탄올, 과산화수소, 디아세틸, 항진균제(지방분해 반응에서 파생된 짧은고리 지방산), 박테리오신으로 알려진 항균 펩타이드, 그람 양성 박테리아와 그람 음성 박테리아의 peptidoglycan 세포벽을 분해할 수 있는 펩티오글리칸 하이드롤레이트(peptidoglycan hydrocolate, PGH)와 같은 항균 단백질을 생산할 수 있다[12]. 박테리오신은 리보솜 항균 펩타이드로서 세포질 막에 모공을 형성하여 밀접하게 관련되거나 또는 관련이 없는 민감한 박테리아 균주에 대해서 작용을 하고, 스트레스 조건에서 미생물 LAB의 경쟁균을 감소시키는데 역할을 한다. 몇몇 연구들은 박테리오신이 식품 보존과 제약 산업에서 Listeria monocytogenes와 Staphylococcus aureus과 같은 병원균과 미생물에 대한 작용에 적용될 가능성을 입증하기도 하였다[8,13].
LAB는 수세기 동안 유제품, 야채, 육류, 커피, 코코아, 사일리지, 사워도우 빵, 와인의 합성(동화) 과정에서부터 실제 현대 산업에 이르기까지 수많은 식품 발효에 안전하게 사용되어 왔으며, LAB는 이러한 발효 제품의 맛, 향, 조직감에 기여할 뿐만 아니라 항균제의 산화와 생산에 의한 부패 및 병원성 미생물 발생을 억제하기도 하였다[1,12]. 따라서 LAB는 유제품(경질 및 반경질 형태의 치즈, 요구르트, 버터, 크림), 육류, 사워도우 빵, 야채 등 여러 발효식품의 합성 및 보존을 위해 숙성을 가속화하거나, 돌발적으로 생성하는 미생물을 통제하기 위해 식품산업에서 스타터 배양균으로 널리 활용되고 있다. LAB는 디아세틸, 아세토인, 아세트알데히드, 아세트산 등 다양한 방향성 화합물로 전환될 수 있는 구연산 및 피루브산 중간체의 지방분해, 단백질 분해, 유당 변환을 포함한 여러 반응의 결과로 발효 제품의 맛, 향 및 질감에 기여한다[1]. 단백질 분해 과정은 알코올, 알데히드, 산, 그리고 발효식품의 향미 성질과 관능 특성을 담당하는 에스테르로 더욱 변형되는 작은 펩타이드와 유리 아미노산의 축적을 유도한다[12]. 또한 Lactobacillus helveticus, Lactococcus lactis, Lactobacillus rhamnosus, Lactobacillus sakei, Streptococcus thermophiles와 같은 일부 LAB 균들은 exopolysaccharide(EPS)를 생산할 수 있다. 이 EPS는 세포 생산자에게 보호를 제공할 뿐만 아니라, 요구르트와 저지방유제품에서의 점도와 단단함을 향상시키고, 조직과 식감을 개선하여 식품 산업에 적용될 수 있다. LAB가 생성하는 EPS의 크기는 10–2,000 kDa 범위이며, 단량체 구성에 따라 호모다당류 또는 이형다당류로 분류할 수 있으며, 가장 일반적인 단량체는 갈락토스, 포도당, 람노스 등이 있다[14].
일부 LAB는 인간과 동물의 호흡기, 위장, 생식기 등에 존재한다. 따라서 일부일지라도 감염의 예방과 관리를 위해 면역체계에 영향을 줄 뿐만 아니라, 건강증진을 위해서 프로바이오틱스로 사용되는데, 예를 들면, 임신중일때 또는 항생제 유래 설사, 변비, 장내 염증 치료의 일환으로 이용된다. 또한 알레르기, 유당 불내증 그리고 요로감염의 예방을 위해서도 이용된다[1,2]. WHO와 FAO는 프로바이오틱스를 적절한 양으로 숙주에게 건강상 이익을 주는 살아있는 미생물로 설명된다[6]. 식품과 식이 보조식품에 존재하는 Bifidobacterium, Enterococcus, Lactobacillus, Lactoccocus, Pediococcus, Propionibacteria,Streptococcus 등의 여러 균주들은 프로바이오틱스로 흔히 사용되며, 그리고 백신과 다른 대사물을 위장관에서 직접 전달하는 데 사용할 수 있는 장내 미생물 중 바람직한 구성원으로 간주된다[2]. LAB 프로바이오틱스의 섭취는 면역체계 조절과 병원균 감소에 도움을 줄 수 있으며, 따라서 장관의 기능성을 향상시킨다. 그 밖에 LAB 프로바이오틱스 섭취와 관련된 건강상의 이점으로는 고혈압 효과, 혈청 콜레스테롤 수치 감소, 항산화 효과, 대장암 예방, 알레르기 증상 감소, 치아 교정 감소, 비만 지수 감소 등이 있다[2]. 또한 건강증진 특성을 가진 2차 대사물에는 Lactobacillus helveticus, Lactobacillus acidophilus, Lactobacillus delbrueckii의 단백질 분해 시스템을 통해 생성되는 항고혈압 안지오텐신전환효소(angiotensin-converting enzyme, ACE)가 포함된다[2,12].
LAB는 여러 항생제에 자연적으로 내성이 있는 것으로 간주되고, 그리고 LAB는 다른 항균제에 대한 저항력을 획득하거나 동물과 인간의 위장관에 존재하는 병원균에 대한 저항력을 확산시킬 수 있는 잠재력을 가질 수 있다[6,8]. 예를 들어 Shao 등[15]은 두 개의 L. plantarum 분리균은 streptomycin 저항성과 관련된 aaadA와 ant(6) 유전자를 소유하고 있으며, 이 항생제에 대한 과다 노출은 최소 억제농도(MIC)를 급격하게 증가시키고, 같은 등급의 다른 항생제에 대한 교차저항을 증가시켰다는 것을 입증하였다. 반면, 이집트의 일부 제약 및 유제품에서 분리된 6%의 균주에서 tetracycline[tet(M)] 및/또는 erythromycin[erm(B)] 저항 유전자를 가지고 있다고 보고되었다[2]. 비슷한 연구에서 터키 발효 유제품에서 ciprofloxacin(26%), erythromycin(10.8%), gentamicin (48%), tetracycline(4.3%), vancomycin(58%)에 내성이 있는 Lactobacillus균의 높은 발생률이 보고되었다[16]. 그러나 Flores와 Mayo[17]는 요구르트의 생산과 저장 동안 tetracycline[tet(M)]과 erythromycin[erm(B)] 내성 유전자가 L. delbrueckii와S. thermophilus에 전달되지 않았다고 보고하였다. 또한, 먹이 사슬은 동물, 음식, 그리고 사람 사이의 항생제 내성 박테리아의 전염을 촉진할 수 있는데, 예를 들면, 어떠한 열처리 과정없이 소비되는 발효유와 육류제품은 위장관의 고유의 장내세균에 항생제 내성 박테리아를 전파할 수 있는 가장 흔한 매개체이다[18]. 일부 보고서에서 내성 결정요인의 전달을 확인한다고 해도, LAB에서 가장 흔한 저항 유전자는 tetracycline [tet(M)]과 erithromycin [erm(B)] 저항 유전자이며, 다음으로는 chloramphenicol 저항성을 가지는 cat 유전자 코딩이다[19]. 산업적으로 사용되는 LAB의 잠재적 적용 범위와 인간과 동물의 건강 상태를 고려할 때, 항생제내성 유전자의 검출과 관련된 상세한 검사가 반드시 필요하다.
항생제가 기능을 발휘해 미생물 성장을 억제하려면 세포벽을 넘어 목표물과 상호작용할 수 있도록 적절한 농도를 유지해야 한다. 앞에서 언급한 바와 같이, 항생제 내성은 유사한 박테리아 종의 정상적인 민감성을 넘어 미생물이 항생제의 억제 활동을 저해하는 능력이다[2,5,9,18]. 한편, 항생제 내성의 다른 메커니즘은 항생제 타겟 사이트의 변형뿐만 아니라, 표적 세포를 작용하는 항생제 농도가 감소하기 때문이다.
LAB는 다른 메커니즘을 통해 환경과 음식 사이의 먹이 사슬 내에서 유전자를 번식시킬 수 있는 저항 유전자의 매개체로 간주되고 있다[20]. FAO와 WHO에 따르면, 사람 또는 동물 섭취를 목적으로 사용되는 스타터 또는 프로바이오틱스 배양균에서 다른 미생물로 전이될 수 있는 이동 저항 유전자(mobile resistance genes)를 가지고 있는지 여부를 판단하는 것은 중요하다[21]. 또한, 일부 연구자들은 성장 촉진제 또는 병원균 저해제를 사용하기로 예정된 동물에 항생제를 사용하는 것이 인간의 위장관에 항생제 내성 균총의 존재와 직접적인 관련이 있다는 것을 입증하였다[22]. 한편, Gad 등[2]은 일부 Lactobacillus, Lactococcus, Streptococcus 균주를 제약 및 프로바이오틱스 유제품에서 분리하였지만, 제약에서 분리한 프로바이오틱스 균주에서는 어떠한 항생제 저항도 보이지 않았지만, 하지만 유제품에서 분리한 LAB는 Escherichia coli, Salmonella spp., Staphylococcus spp. 같은 병원균의 저항 특성과 비교할 수 있는 정도의 저항력을 보였다. 더욱이 일부 Enterococcus faecium 균은 생쥐의 장내에서 "체외" 및 "체내" 연구를 통해 vancomycin 저항성 유전자가 Lactobacillusacidophilus La5로 전이되는 것을 입증하였다[23]. 항생제에 노출되면 박테리아가 살균 효과를 상쇄하기 위한 다른 메커니즘을 생성할 수 있다. 단일 박테리아일지라도 다양한 유형의 저항을 생성할 수 있다. 이러한 시스템은 내재적 또는 선천적 및 후천적 저항 방식 등이 포함된다[1]. 이 중에서 박테리아 내에 존재하는 메커니즘은 항생제의 특성, 타겟 사이트, 박테리아 종류 등에 따라서 다양하다. 또한 저항 유전자가 플라스미드 또는 트랜스폰스 같은 것들이 이동요소(mobile elements) 또는 염색체의 일부인지에 따라서도 달라질 수 있다[18].
항생제-표적 상호작용에는 두 가지 관련 요소가 있어야 하는데, 첫째는 항생제가 표적을 인식해야 하며, 둘째는 표적 내 항생제 농도는 박테리아 성장을 억제하기에 충분해야 한다는 것이다. 저항 메커니즘은 비효율적인 항생제-표적 상호작용에 의하여 세균성장을 억제하는 항생제 기능을 상실하게 만드는데, 여기에는 수동과 능동으로 분류할 수 있다. 수동 메커니즘은 항생제 구조에 영향을 주지 않고 표적 부위의 변형이나 항균 흡수 감소를 수반하는 클론 전달(clonal transfer)에 의해서만 다른 세포로 전달될 수 있다. 이러한 저항은 내재적(intrinsic) 저항으로 알려져 있다. 이와는 대조적으로, 활성 메커니즘은 효소와 함께 구조를 변형 또는 분해하거나, 유출 펌프의 작용을 통해 세포 내 항생제의 농도를 감소시키는 것을 포함하기도 한다[24].
또한 박테리아가 항생제에 대한 내성을 가지는 반응은 일반적으로 3가지로 설명될 수 있는데, 첫째는 항생제와 표적과의 상호작용을 방지하는 효소 복합체에 의한 항생제 변형이며(효소의 변형), 둘째는 세포내 또는 세포외 항생제의 효소적인 분해(효소의 분해), 그리고 셋째로 유량 펌프의 활성화 또는 세포벽 투과성 변화에 의한 세포내 항생제 농도 감소(효소의 유량펌프) 등이다[25].
LAB가 제시한 항생제에 대한 내성의 주요 메커니즘은 구조적으로 관련이 없는 화합물의 배출과 관련된 다중약물내성(multidrug-resistant, MDR) 배출 펌프와 관련이 있다[21,24]. Wacher-Rodarte 등[26]은 pozol(전통 발효 옥수수 음료)에서 분리된 LAB를 분석하였는데, Lactococcus lactis와 Lactobacillus plantarum 균과 같이 MDR 균들은 활성 유출 펌프를 나타내는 것으로 판단되었으며, 또한 LmrA 트랜스포터(lmrA 유전자)와 함께 염색체로 부호화된 ABC 유형을 포함하였다. 반면, Poelarends 등[27]은 Lactococcus lactis에 LmrA 트랜스포터의 존재는 aminoglycosides (kanamycin과 gentamicin), lincosamines(clindamycin), macrolides(erythromycin), quinolones(ciprofloxacin), tetracyclines을 포함하여 임상적으로 관련된 17개에서 최대 21개까지의 선천적인(innate) 저항과 관련이 있음을 입증하였다. Casado Muñoz 등[28]은 발효 올리브에서 분리한 Lactobacillus pentosus와 Leuconostoc pseudomesenteroides가 cephalosporins, streptomycin, kanamycin 등에 내성이 있다고 보고하였는데, 이것의 주요 저항 메커니즘은 세포벽 투과성의 변화로 인한 것이다. 그들은 또한 두 균주 모두 β-lactams, fluoroquinolones, chloramphenicol, tetracycline에 대한 MDR 유출 펌프와 관련된 복잡한 AcrAB-TolC 시스템뿐만 아니라 chloramphenicol과 fluoroquinolones에 저항성을 부여하는 염색체 인코딩 슈퍼패밀리 펌프 norA 및 Mde와 관련된 다른 유전자가 존재함을 밝혔다.
LAB의 aminoglycosides에 대한 저항은 보고되지 않았지만, 최근 몇 년 동안 농장에서 분리한 LAB는 비록 gentamicin, kanamycin, streptomycin 등에 저항성을 보이긴 하였지만, 이러한 저항 메커니즘은 세 가지 주요 아미노글리코시드변형효소(aminoglycoside-modifying enzymes, AMEs)에 의해 손상된 상태로 전달되거나 또는 효소 불활성화와 관련되어 있다[29]. 트랜스포존과 삽입 시퀀스 같은 MGE(이동 유전적 요소)에 의해 인코딩된 N-acetyl transferase(AACs), O-phosphotransferase(APPs), O-nucleotidyl transferase(ANTs) 등이 세 가지 주요 아미노클로코시드변형효소(AMEs)이다.
Bifidobacterium, Entococcus, Lactobacillus, Pediococcus에 속하는 박테리아는 내인성(intrinsic) 또는 선천성(innate) 그리고 외인성(extrinsic) 또는 후천성(acquired) 항생제 내성을 모두 가지고 있는데, 이는 다른 박테리아에 대한 저항성을 수직전이(종(species) 간) 또는 수평 전이(세균 속(genera) 간)로 확산시킬 수 있기 때문에 식품 안전의 한 요인이 될 수 있다[17,21].
내인성(intrinsic) 저항은 박테리아 생리적 상태의 변화 또는 항생제에 대한 통제되지 않은 노출에 의해 도출된 돌연변이의 결과로 항생제의 효과에서 살아남기 위한 박테리아의 자연적 또는 선천적(innate) 능력이다[30]. 내인성(intrinsic) 저항은 박테리아 생성 사이에 최소 전파 잠재력을 가지고 있는데, 저항 유전자가 다른 속(genus)과의 제한된 전이를 가진 염색체에 위치하기 때문에 비병원성 박테리아 내에서 낮은 위험을 나타낸다. 내인성 저항을 담당하는 어떤 유전자는 다른 박테리아로 전파되고 옮겨질 수 있는데, 이것은 움직임을 활발하게 촉진하는 삽입 시퀀스에 의해 좌우될 수 있기 때문이다[18]. 예를 들어, 비록 Bifidobacterium 균주가 quinolones(ciprofloxacin과 nalidixic acid), mupirocin, tetracyclines, streptomycin 같은 aminoglycosides에 내재적 저항을 가지고 있을지라도, Bifidobacterium 균주는 일반적으로 전통적이고 산업화된 발효 식품에서 스타터 배양균 및/또는 프리바이오틱스로 사용되고 있다. 그러나 모든 유전자들은 다른 속(genus)과의 제한된 전이를 가진 염색체에 위치하고 있다[31]. 일부 LAB 속(genera)은 bacitracin, kanamycin, quinolones, teicoplanin, vancomycin 등에 내인성(intrinsic) 저항을 가지고 있다고 보고되었다[28]. LAB가 제시하는 이러한 내재적 저항 메커니즘은 다음과 같은 2가지 있다. 첫째, 세포벽의 변형, glycopeptides(vancomycin과 teicoplanin) 그리고 비리보솜성(non-ribosomal) 항생제(bacitracin)에 대한 저항성이 흔히 관찰된다. 특히 Lactobacillus plantarum과 Enterococcus faecium은 vancomycin에 선천적인 저항성을 가지고 있다. 이것은 peptidoglycan의 화학구조에서 D-lactate(높은 수준의 저항) 또는 D-serine(낮은 수준의 저항)에 의한 muramyl pentapeptide 세포벽의 D-alanie 잔류물 대체로 인하여 발생한다. 따라서 항생제 상호작용을 회피할 수 있다[24,32]. 그리고 둘째, aminoglycosides(neomycin, kanamycin, streptomycin) 또는 quinolones (ciprofloxacin, norfloxacin, nalidixic acid) 같은 효소 불활성화는 이러한 항생제가 특정 표적과 결합되는 것을 방지한다. 이것은 30S 리보솜 박테리아 서브유닛(subunit)의 16S rRNA와 DNA 자이라제(gyrase)에 대해 Lactobacillus와 Enterococcus에서 각각 관찰된 바와 같다.
외인성(extrinsic) 또는 후천성(acquired) 저항성은 박테리아가 특정 항생제에 내성을 부여할 수 있는 세포구조에 이동성유전인자(mobile genetic material)를 통합시키기 때문이다. 내인성(intrinsic) 저항과는 달리, 후천적인 저항은 일부 개체 또는 박테리아 일부 집단에서만 발견된다. 유전자 전파는 다른 속(genera)의 박테리아들 사이에서 또는 다른 생물체들 사이에서도 일어날 수 있다. 수평 유전자 전달(horizontal gene transfer, HGT)은 박테리아가 내적 저항 스펙트럼을 증가시킬 수 있는 새로운 유전자를 획득할 수 있을 때 발생하며, 세계보건기구인 WHO에 따르면, 그들은 다른 미생물에 대한 저항력을 이전할 수도 있고, 또는 이미 건강상 위험이 있는 인간이나 동물에게 직접 전달할 수도 있다. 따라서 LAB가 항생제 저항을 획득할 수 있는 높은 능력을 가지고 있는 만큼, LAB의 저항 유전자 분석을 위한 프로토콜이 증가하고 있다. 왜냐하면 LAB는 식품 가공과 밀접한 관계를 가지고 있기 때문이다[6,21,25]. 일반적으로 HGT와 관련해서는 세 가지 주요 메커니즘이 있다. 일부 LAB에 있어서 항생제에 대한 내성의 전이는 관련성이 없는 것으로 밝혀졌다. 예를 들어, (박테리아파지를 통한) 형질도입(transduction)과 변형(transformation)(DNA가 한 박테리아에서 방출되어 다른 박테리아에 의해 흡수되는 경우), 그리고 접합(conjugation)은 유산균에 있어서 관찰되는 주요한 메커니즘이다[18,25,33]. 다시 정리하면 LAB에 있어서 수평 유전자 전달(HGT)의 메커니즘은 크게 3가지 있는데, 첫째는 접합(세포 표면 섬모(pili)를 통한 세포와 세포의 접촉이 필요한 과정)이며, 둘째는(세포외 DNA 통합에 의한) 세포 변환이며, 셋째는 형질도입(박테리오파지는 이전에 감염된 기증자 세포에서 수신자 세포로 박테리아 DNA를 전파) 등이 있다[25,33].
이 접합은 플라스미드나 트랜스포존으로부터 이동 유전 물질이 성섬모(sexual pilus)라고 불리는 단백질의 관을 통해 전달되는 것이다[1]. 플라스미드는 자율적 복제가 가능한 세포외 DNA 분자이며, 미생물에 항생제에 대한 내성을 부여할 수 있다. 또한 β-lactams, aminoglycosides, tetracyclines, chloramphenicol, macrolides, quinolones, sulfonamides, trimethoprim에 대한 항생제 내성 유전자의 보급을 위한 주요 이동 요소 중 하나이다[33]. 플라스미드는 접합에 의해 저항성을 부여할 수 있는 많은 유전적 결정인자를 가지고 있고, 그리고 단일 박테리아가 다수의 플라스미드를 가질 수 있다는 것을 고려하는 것이 중요하다[34].
일부 연구자들은 저항의 유전적 다양성이 환경에 존재하는 플라스미드의 수에 비례한다고 보고하였는데, 이것은 트랜스포존이나 항균제내성유전자(integrons) 같은 다른 이동 요소가 있다는 것을 포함하고 있다. 비록 이러한 요소들은 스스로 복제되지 않기에 적절한 플라스미드나 파이지에 의해서 운반되어야 한다[34]. LAB에서 항생제 내성 유전자의 매개체로 사용되는 일부 접합 트랜스포존에는 Tn916, Tn918, Tn920, Tn925, Tn2702(E. faecalis), Tn5233(E. faecium), Tn5276, Tn5301 (Lactococcus lactis) 등이 있다[25].
이미 언급하였듯이, LAB에 저항 유전자의 존재는 공중 보건 문제로 간주되고 있다. 그래서 FEEDAP(EFSA Panel on Additives and Products or Substances used in Animal Feed, 동물 사료에 사용되는 첨가제 및 제품 또는 물질에 관한 협의체)를 통해 EFSA는 ampicillin, chloramphenicol, clindamycin, erythromycin, gentamicin, kanamycin, streptomycin, tetracyclines, vancomycin과 같은 항생제에 대한 내성을 보이는 박테리아를 식별하기 위한 기술 가이드를 개발하였다[35]. 식품 생산 과정에서 후천적으로 저항력을 나타내는 대부분의 LAB 등에는 절대호모발효성인 Lactobacillus genera(L. helveticus, L. acidophilus, L. delbrueckii), 절대이형발효성인 Lactobacillus(L. reuteri, L. fermentum), 통성혐기성 이형발효성인 Lactobacillus(L. plantarum, L. rhamnosus, L. paracasei), Lactococcus lactis, Streptococcus thermophilus, Pediococcus spp., Leuconostoc spp., Enterococcus spp. 등이 포함된다[21,35]. 반면에, LAB는 프로바이오틱스 또는 스타터 배양균의 형태로 식품에 포함될 수도 있고, 전통적인 발효식품의 자연적인 미생물군의 일부가 될 수도 있지만, 일부 연구자들은 이러한 박테리아의 대다수가 항생제에 내성이 있다는 것을 발견하였다[21,25,29]. 지금까지 다양한 연구에 의하면 장내 미생물 개선을 위해서 권장되는 전통적인 발효 식품, 산업화된 제품 그리고 프로바이틱에서 분리된 LAB가 특정 항생제에 대한 내성을 가지고 있음을 보여주고 있다[14,26,34]. 예를 들면, chorizo(스페인이나 라틴 아메리카의 양념을 많이 한 소시지), fuet(Cataluña 특유의 소시지)와 소시지에 분리한 Lactobacillus sakei, Lactobacillus curvatus, Leuconostoc mesenteroides는 vancomyin, gentamicin, ampicillin, erythromycin, tetracycline에 저항을 보였으며, 이탈리안 소시지에서 분리한 Lactobacillus sakei, Lactobacillus plantarum, Lactobacillus paraplantarum, Pediococcus pentosaceus는 streptomycin, gentamicin, tetracycline에 저항을 보였으며, 남부 포르투갈의 전통적인 건조 발효 소시지에서 분리한 Lactobacillus sakei, Lactobacillus plantarum은 chloramphenicol, quinupristin-dalfopristin, lincomycin, erythromycin(erm A, erm B, erm C), rifampicin, tetracyclein(tetM, tetO, tetS, tetW, tetK, tetL genes), gentamycin, vancomycin, penicillin에 저항을 보였으며, 소시지에서 분리한 Enterococcus faecium, Enterococcus faecalis, Lactobacillus reuteri, Lactobacillus acidophilus, Lactobacills delbrueckii subsp. bulgaricus, Lactobacillus johnsonii, Lactobacillus plantarum은 gentamycin, tetracycline(tetM), clindamycin, vancomycin(vanA), chloramphenicol(cat gene), ciprofloxacin, penicillin, nitrofurantoin에 저항을 보였으며, 비살균치즈에서 분리한 Lactococcus lactis K214는 chloramphenicol, streptomycin, tetracycline(tetS, tetM), erythromycin(ermT)에 저항을 보였으며, 원유에서 분리한 Streptococcus thermophilus는 tetracycline(tetS), erythromycin(ermB), clindamycin, streptomycin, neomycin에 저항을 보였으며, 초록 올리버에서 분리한 Lactobacillus pentosus, Leuconostoc pseudomesenteroides는 amoxicillin, ampicillin, chloramphenicol, gentamicin, erythromycin, streptomycin, vancomycin, teicoplanin에 저항을 보였으며, 그리고 상업적으로 판매되는 프로바이오틱스에서 분리한 Bifidobacterim spp., Lactobacillus spp., Streptococcus thermophilus는 vancomycin, streptomycin, azteronamine, gentamicin, ciprofloxacin에 저항을 보였다[14,26,34].
특히, 장내구균(enterococcal)과 Lactobacillus속 균들은 건강상의 위험과 연관될 수 있는데, 그들이 선천적이고 후천적인 저항 유전자를 가지고 있기 때문이다. 예를 들면, 식품 그리고 인간과 동물의 위장관 미생물균총에서 높은 저항성을 보여주고 있다[31,36].
Enterococcus는 야채, 유제품, 조제식품, 육류제품 등에 널리 분포하며, 프로바이오틱스로 사용되고 있지만, 그러나 β-lactams와 aminoglycoside와 같은 많은 항생제에 대한 내성을 가지고 있다. 병원에서 새롭게 발생하는 병원균으로 인식되는 장내구균과 비슷한 저항특성을 나타내기도 한다. 인간 숙주에서 생존을 촉진할 수 있도록 약리학적 목표물의 변형, 치료제의 불활성화, 배출 펌프의 과압, 세포외피의 복잡한 적응반응 등이 포함된 저항 메커니즘을 가지는 여러 가지 약물 내성(MDR)을 나타낼 수 있다[36,37]. Streptomycin은 장내구균에서 나타나는 저항을 보여준 최초의 aminoglycoside이며, 2,000 μg/mL보다 높은 농도를 보였다. 이러한 저항은 streptomycin의 아데닐화, streptomycin adenyltransferase 효소의 작용, aadA 유전자에 의한 암호화 등의 다양한 작용에 의해서 수행된다[24]. Gentamicin, kanamycin, neomycin, netilmicin(aminoglycosides 포함) 등에 대한 저항성은 주로 아미노글리코사이드의 ATP 의존 인산화를 촉진하는 다기능효소인 2′-phosphotransferase-6′-acetyltransferase의 생산에 기인한다[38].
인간에서 분리한 장내구균중에서 대략 60%–65%는 tetracyclines에 대한 내성을 나타내고 있지만, 이러한 항생제는 장내구균에 의한 감염 치료시 일반적으로 사용되지는 않는다. 장내구균에 있어서 tetracyclines에 대한 저항의 두 가지 기본 메커니즘이 있는데, 유량 펌프와 리보솜의 보호로 인하여 항생제의 결합을 방지할 수 있다는 것이다. tetK와 tetL 유전자는 세포 밖에서 항생제를 제거할 책임이 있는 유량 펌프와 관련된 단백질에 대한 코드이며, 반면 tetM, tetO, tetS 유전자는 리보솜 보호를 위해 tetracyclines에 저항성을 제공하는 단백질을 코드이다. tetL과 tetM 유전자는 염색체 및 이동 결정인자에서 가장 많이 존재한다[37,38]. 마지막으로, vancomycin(글리코펩타이드)이 주요 관심사인데, 왜냐하면 이 항생제는 그램 양성 박테리아 치료를 위한 항생제 치료의 마지막 옵션으로 고려되기 때문이다. 장내구균에 대한 저항은 다양하며, vanA, vanB, vanC, vanD, vanE, vanG로 명칭되는 6개의 유전자형이 있다. 그 중에서 장내구균 속(genus)에서 가장 많이 존재하는 것은 유전자형 vanA이다[38].
일반적으로 Lactobacillus는 bacitracin, cefoxitin, metronidazole, nitrofurantoin, sulfadiazine, vancomycin뿐만 아니라, chloramphenicol, erythromycin, quinupristin/dalfopristin, lincomycin, clindamycin, tetracyclines과 같은 단백질 합성을 억제하는 항생제에 대해서도 저항상을 나타낸다[39]. Guo 등[40]은 식품에서 분리한 Lactobacillus 균주에서 vancomycin 저항의 발병의 85%를 관찰하였다. 특히 Lactobacillus plantarum와 Lactobacillus casei에서는 높은 비율을 보였지만 Lactobacillus helveticus에서는 낮은 비율을 보였다. 그러나 유전자가 염색체에 위치하기 때문에 이러한 저항은 전이될 수 없다[40]. 최근에는 프로바이틱스와 식품에서 분리된 다른 종류의 Lactobacillus 균주에서 tetracycline과 erythromycin에 대한 내성을 암호화하는 유전자가 검출되었다[21,39,40].
Lactobacillus 속(genus)은 접합에 의한 외생 유전자의 훌륭한 수용체이다. 왜냐하면 Abriouel 등[39]은 장내구균과 연쇄상구균으로부터 분리할 수 있는 Lactobacillus plantarum에서 접합 pAMβ1 플라스미드를 발견하여 입증하였기 때문이다. Lactobacillus는 일반적으로 항생제에 민감하다. 예를 들면 penicillins(ampicillin, oxacillin, piperacillin), β-lactamase의 저해제, cephalosporins(cephalothin과 cefuroxime, ceftriaxone과 cefoxitin) 등이다. 그러나 최근 몇 년 동안 일부 연구자들은 Lactobacillus rhamnosus, Lactobacillus reuteri, Lactobacillus plantarum의 일분 균주에서 페니실린 G에 대한 저항성을 보고하였다[39,41]. 다른 연구보고에 의하면 비록 Lactobacillus rhamnosu균이 vancomycin에 대한 저항 유전자를 가지고 있음에도 불구하고, Lactobacillus rhamnosu는 스타터 또는 프로바이오틱스 배양균으로 사용하기에 안전하다고 하였는데, 왜냐하면 vancomycin 저항 유전자는 일반적으로 염색체에 암호화되어 있기 때문이다[39,40].
수평 유전자 전달(HGT)은 플라스미드, 접합된 트랜스포존, 항균제내성유전자, 박테리오파지 등과 같은 이동 DNA 요소들을 통해서 서로 다른 박테이라 사이에서 유전자 교환을 관여한다[33,34,42]. HGT에 의한 저항 유전자의 전달은 질병을 예방하기 위해 성장 촉진제로 사용되는 항생제로 치료된 가축으로부터 시작되었다. 그러나 이러한 통제되지 않은 치료(또는 사용)는 장내 미생물에서 저항을 유발할 수 있다. 나중에 이 생물체는 식품의 형태로 가공되어 결국 인간에게까지 전달될 수 있다[4]. 식품 매트릭스에서의 접합은 공생하는 박테리아(Enterococcus faecalis와 Lactocococcus lactis)에서부터 발효유에서 잠재적으로 병원성균주(Listeria spp., Salmonella spp., Staphylococcus aureus, E. coli)에 이르기까지 보고되었다[7]. 또한, LAB가운데 tetracycline 저항 유전자의 전달은 발효유와 발효 소시지에서 보고되었다[42]. Martínez와 Baquero[43]는 치즈와 소시지의 발효 과정 중 Enterococcus faecalis에서 tetracycline과 vancomycin 저항 유전자의 HGT를 보고하였다. Bonham 등[20]은 숙성된 치즈에서 항생제 내성 Lactobacillus과 Lactococcus가 항생제 내성이 있음을 밝혔다. 즉, 식품 생산과 숙성과정에서 비록 엄격한 조건하에 있을지라도, 유도된 HGT를 통해 저항을 획득할 수 있다는 것을 보여주고 있다.
인간의 위장관에서 발견될 수 있는 다양한 항생제 내성 균들(species)은 HGT에 의해 항생제 내성 유전자를 획득할 수 있음을 보여주고 있다. 이 사실은 인간 미생물균총에서 발견되는 대부분의 저항 유전자가 가축에 사용되는 승인된 항생제와 관련이 있다는 것은 메타게놈 비교에 의해서 밝혀졌다. 이것은 저항 유전자가 농장에서부터 소비자에게 전달될 수 있다는 가설을 뒷받침하고 있다[43]. 따라서, 세계보건기구에서는 대부분의 항생제 내성이 HGT를 통해 획득되기 때문에 HGT 유전자가 건강 문제에 중요하게 역할을 할 것으로 보고하였다[20,42,44].
미국 FDA는 안전성, 분류학, 병원성 독소 생성 가능성, 항생제에 대한 저항성, 식품 안전의 역사적 배경 등의 일반적인 측면에서 평가한 후 미생물을 GRAS로 분류하였다. LAB는 발효식품에 널리 사용되어 왔으며 보통 안전하다고 인정되고 있다. 그러나, 항생제 내성 유전자의 전파는 GRAS 범주를 다른 맥락에 놓이게 하였다. 특히 Lactobacills균과 같이 항생제에 저항을 가질 수 있도록 전이이동유전자(mobile genes of transfer)가 존재하는 박테리아에서는 더욱더 그렇다. 왜냐하면 미국에서는 여전히 식품 가공에 사용되는 미생물의 저항 유형을 고려하는 지침이 없기 때문이다[45]. 한편, EU 집행위원회는 유럽 대륙에서 스타터 또는 프로바이오틱스 배양균으로 사용되는 LAB의 안전을 규제하기 시작하였다. 이는 EFSA를 통해 2003년 이후 LAB는 QPS(qualified presumption of safety quality to the organisms, 미생물에 대한 품질에 대한 안전자격조건) 조건에 맞추도록 지침을 수립하여 권고하였다. 앞에서 언급한 바와 같이 QPS라는 용어는 특정 제한을 허용하는 합리적이고 검증된 증거에 기초하고 있으며 GRAS 개념과 유사할 수 있지만 박테리아를 신뢰할 수 있는 안전성이 검증되도록 보다 엄격한 지침으로 “농장에서 식탁까지”라는 문구를 명확하게 명시하였다[46]. QPS 조건을 살펴보면 박테리아들은 EFSA BIOHAZ 협의체에 의해 다음과 같은 4가지 측면이 반드시 고려되어야 한다. 첫째, 속(genus) 수준에서 분류 단위의 규명하고, 둘째, LAB의 안전과 관련된 문서로서, 과학적 증거 및 사용 이력에 기초하며, 셋째, 속(genus)의 어떤 종(species)이 병균성 요소가 있다면 병원성은 평가되어야 하며(만약 정보를 이용할 수 있는 경우 병원성 균들은 제외), 그리고 넷째, 미생물의 최종 사용에 대한 정보, 박테리아가 식품 가공중에서 어느 부분 사용되는지 또는 어떤 다른 제품을 생산에 사용되는지를 밝혀야 한다[46,47].
QPS 목록에 속해있는 균주들은 Lactobacillus sakei, Lactobacillus curvatus, Lactobacillus plantarum, Lactobacillus fermentum, Lactobacillus brevis, Lactobacillus rhamnosus, Lactobacillus alimentarius, Leuconostoc lactis, Leuconostoc citreum, Leuconostoc mesenteroides, Leuconostoc pseudomesenteroides, Pediococcus acidilactici, Pediococcus dextrinicus, Pediococcus pentosaceus, Lactococcus lactis, Streptococcus thermophilus 등이다[47]. Enterococcus 경우, QPS 범주를 모든 종에 할당할 수 없다. 각 종은 개별적으로 분석해야 한다[47].
한국의 경우, “프로바이오틱스: 건강기능식품의 기준 및 규격 고시전문”에 의하면 프로바이오틱스 균종은 총 19종이다(식약청 고시 제 2011-68호, 2011.11.17)[48]. 자세히 살펴보면, Lactobacillus는 11종으로 L. acidophilus, L. casei, L. gasseri, L. delbrueckii spp. bulgaricus, L. helveticus, L. fermentum, L. paracasei, L. plantarum, L. reuteri, L. rhamnosus, L. salivarius이며, Lactococcus는 1종으로 Lc. lactis이며, Enterococcus는 2종으로 E. faecium, E. faecalis이며, Streptococcus는 1종으로 S. thermophilus이며, 그리고 Bifidobacterium은 4종으로 B. bifidum, B. breve, B. longum, B. animalis ssp. lactis이다.
앞에서 언급한 내용 중에서 한국과 외국에서 사용이 허가된 유산균의 목록 비교를 간단하게 Table 1에서 정리되어져 있다.
| List of lactic acid bacteria by QPS of EFSA, EU [47] | List of lactic acid bacteria by MFDS, Korea [48,49] | |
|---|---|---|
| Lactobacillus |
Lactobacillus alimentarius,
Lactobacillus brevis, Lactobacillus curvatus, Lactobacillus fermentum, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus sakei |
Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii spp. bulgaricus, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus helveticus, Lactobacillus paracasei, Lactobacillus plantarum, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus salivarius |
| Pediococcus |
Pediococcus acidilactici,
Pediococcus dextrinicus, Pediococcus pentosaceus |
- |
| Leuconostoc |
Leuconostoc citreum,
Leuconostoc lactis, Leuconostoc mesenteroides, Leuconostoc pseudomesenteroides |
- |
| Lactococcus | Lactococcus lactis | Lactococcus lactis |
| Streptococcus | Streptococcus thermophilus | S. thermophilus |
| Bifidobacterium | - | Bifidobacterium animalis spp. lactis Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum |
| Enterococcus | The category of QPS can't be assigned to all species, hence each specie should be individually analyzed [47] | Enterococcus faecalis Enterococcus faecium (From April 1, 2019, Enterococcus faecalis and Enterococcus faecium can only be used without antibiotic resistance and toxic genes [49]) |
| Total | 16 | 19 |
그런데, 식품의약품안전처는 2019년 4월 1일부터 건강기능성식품 중 프로바이오틱스는 “건강기능식품의 기준 및 규격(식약처 고시 제2018-67호, 2018.09.05)” 개정을 통해 항생제 내성 및 독성 유전자가 없는 “Enterococcus 속 균주(장구균)”를 사용하도록 제한하였다[49]. 개정이유를 살펴보면, Enterococcus 속 균은 기회감염균으로 주로 병원에서 감염이 빈번하게 발생하며, vancomycin뿐만 아니라 다른 항생제에도 저항을 가진 다재내성균(MDR)으로 알려져 있다. Vancomycin에 내성이 있는 Enterococcus 속 균은 비교적 독성은 약하여 정상인에게는 문제를 발생시키지 않지만, 만약 병원에 장기간 입원한 환자와 중환자, 면역이 저하된 사람, 만성 질환자가 Enterococcus속 균에 감염된다면, 치료가 매우 어렵고 더 나아가서 균혈증, 심내막염, 요로감염, 창상감염 등을 유발하는 것으로 보고되었기 때문이다[49].
그래서 식품의약품안전처에서 권고한 Enterococus속 균주의 항생제 내성에는 총 10개의 항생제가 이용되며 기준은 다음과 같다[49]. Ampicillin은 2 mg/L(microbiological cut-off value), vancomycin은 4 mg/L, gentamycin은 32 mg/L, kanamycine은 1,024 mg/L, streptocomycin은 128 mg/L, erythromycin은 4 mg/L, clindamycin은 4 mg/L, tylosin은 4 mg/L, tetracycline은 4 mg/L, 그리고 chloramphenicol은 16 mg/L이다. 그리고 Enterococus속 균주의 독성유전자 확인 검사는 cytolysin, aggregation substance, hyaluronidase, gelatinases 등 4가지가 포함된다[49]. 참고로, 미국 FDA GRASE(generally recognized as safe & effective)와 유럽 EFSA QPS 목록에서 종으로 E. faecium, E. faecalis은 제외되어 있으며, 일본의 JPC(일본약전외규격) 중 E. faecium은 목록에 있지만 내성에 대한 기준은 설정되어 있지 않다[49].
가장 널리 사용되는 항생제 민감성 시험 방법은 첫째가 시험된 항생제가 존재하는 곳에서 박테리아 성장을 측정하여 항생제 내성을 표현형으로 검출하고, 둘째가 중합효소 연쇄반응(PCR)을 통한 내성 유전자형의 분자 식별에 기초한다[17,28,40]. 유산균 내 항생제에 대한 표현 감수성의 평가는 공인된 방법을 사용하여 이루어져야 하며, 특히 가장 일반적으로 사용되는 항생제에 대한 최소억제농도(MIC)를 식별할 수 있어야 한다. 식품에 사용되는 대부분의 LAB 균들은 ISO 10932: 2010에 설명된 방법으로 평가될 수 있으며[50], 이때 장내구균 속(genus)에 속하지 않는 Bifidobacteria와 LAB의 조건과 배양 배지 등도 고려되어야 한다[45]. Enterococcus 균주가 있는 경우에는 CLSI(the Clinical and Laboratory Standards Institute)에 설명된 방법으로 사용할 것을 권장하고 있다[1,2]. LAB에서 최소억제농도를 결정하기 위한 권장 방법으로는 E-test, Kirby-Bauer test(확산 방법), 미량액체배지희석법 등이 있다[51]. 특히, 컷오프 값은 Bifidobacteria, Lactobacillus, Lactococcus, Pediococcus, Streptococcus, 속(genera) 등이 알려져 있다. 미량액체배지희석법은 몇 가지 한계가 있을 지라도, 많은 수의 균주와 항생제를 위한 최소억제농도를 평가하는 데 널리 사용된다. 미량액체배지희석법이 가지는 몇 가지 한계 중에서 하나를 소개하면, 특히 세균이 빠르게 저항력을 획득할 수 있는 항생제의 경우에는 한계를 나타내기도 한다는 것이다[51]. 그러나, 연구자들 사이에서는 최소억제농도 평가가 다소 일관성이 없는데, 이것은 주로 검사 결과를 방해하지 않고 LAB의 적절한 성장을 보장할 수 있는 배양 배지가 부족하기 때문이다. 따라서 보완적 기법에는 PCR 기법과 마이크로어레이(microarray)를 이용한 항생제내성 유전자의 검색이 포함된다[17,40]. 또한, 이러한 유전자의 위치를 확인하면 그들의 잠재적인 전이를 결정할 수 있는 동시에, 그들의 염기서열은 그들의 세균 분류군(bacterial taxa)과 유전자의 정체성에 대한 증거를 제공할 수 있고, 이것은 그들의 게놈의 기원을 추적하는데 도움을 준다[52].
기능성 메타지노믹스(metagenomics)는 항생제 내성 유전자(antibiotic resistance genes, ARG) 연구에 있어 중요한 접근법이다. 왜냐하면, 이전에는 항생제 내성과 관련되지 않았던 것들을 포함할 뿐만 아니라 새로운 항생제 내성 유전자를 식별하고 특성화하는 데 사용될 수 있기 때문이다[44,52,53]. 또한 순수 박테리아 집단 또는 식품과 같은 보다 복잡한 샘플에서의 저항성 연구에 있어 가장 최근의 기술 중 하나이다. 연구보고에 의하면, 식품에 존재하는 다양한 저항 시스템을 나타낼 수 있을 뿐만 아니라 특히 배양할 수 있는 박테리아뿐만 아니라, 배양할 수 없는 박테리아에 대한 정보도 얻을 수 있다고 하였다[52,53]. 메타게놈 연구는 그러한 방식으로 저항의 메커니즘을 이해하는 데 도움이 된다. 왜냐하면, 새로운 약품의 식별뿐만 아니라, 새롭고 능동적인 항생제 분자의 합성에 직접적으로 응용이 가능하기 때문이다[52,53].
2018년 한국의 식품의약품안전처 식품의약품안전평가원에서는 차세대 염기서열 분석(Next Generation Sequencing, NGS) 장비를 통해 확보되어진 미생물 염기서열 정보와 식품에 존재하는 유산균을 비교․분석하여 정확한 유산균종을 구분할 수 있는 “메타게놈 분석프로그램”을 개발하였으며, 이 프로그램의 장점은 대용량 유전체 염기서열 정보 입력만으로 유산균종과 유산균종간 비율을 손쉽게 분석할 수 있도록 제작되었으며, 식품의약품안전처고시 유산균 19종을 분석할 수 있다. 따라서 향후 이 프로그램은 정부, 산업체, 학계 등에서 유산균 함유 식품표시사항 관리 및 품질관리 업무에 적극적으로 이용될 것으로 기대된다. 또한 최근에 널리 이용되고 있는 Raman spectroscopy 그리고 MALDI-TOF(matrix-assisted laser desorption/ionization time of flight mass spectrometry)를 이용한 LAB의 미생물 형별 결정시험(microbial typing), 항균제 감수성 시험, 병독성 검출 등에 관한 연구도 진행되어야 할 것이다[54,55].
FEEDAP 협의체는 앞서 언급한 바와 같이 식품 가공에서 프로바이오틱스 또는 스타터 배양액으로 사용될 수 있는 유산균에 존재하는 저항성을 평가하는 방안을 제안하였으며, 유산균의 식품 안전의 일부로서 내인성(intrinsic)과 후천성(acquired) 저항을 구별하는 것은 필수적이다[46]. 분자 분류법에 의한 박테리아(국제 데이터베이스에서 16S rDNA 유전자의 순서 및 비교)의 정확한 식별은 저항의 유형을 평가하는데 필수적이다. 왜냐하면 내인성(intrinsic) 저항은 특정 종(specie) 또는 속(genus)에만 한정적이기 때문이다. 연구를 통해서 균(specie)이 분리동정 및 확인이 되면, 항생제 분석을 통해서 LAB가 가장 민감하게 반응하는 최소억제농도(MIC)를 결정할 수 있다. 세균은 최소억제농도가 컷오프(cut-off) 값보다 낮을 때 안전한 것으로 간주하고(MIC<cut-off), 반면, 최소억제농도가 컷오프(cut-off) 값보다 높을 때는 박테리아는 항생제에 내성이 있는 것으로 간주한다(MIC>cut-off). 그리고 PCR과 같은 분자방법으로 저항은 반드시 확인되어야만 한다[28,40]. 그러나 저항 유전자가 항상 발현하는 것은 아니지만, 다른 박테리아로 전이될 수가 있다. 이러한 반응은 환경 조건이 이러한 유전자들의 발현을 자극할 때 가능하다는 것이다[43]. 만약 박테리아가 내인성(intrinsic) 내성을 가지고 있을지라도, 이것은 음식에서 사용해도 좋다고 여겨진다. 그렇지 않으면, 획득한 저항이 이동유전물질(mobile genetic material) 있는지 또는 박테리아 염색체의 돌연변이 과정에서 획득되었는지를 반드시 증명해야 식품에서 사용이 가능해 진다. 마지막으로, 만약 저항이 외생적(exogenous)이고 쉽게 전달 가능하다는 것이 입증된 경우에는, 그 박테리아는 식품에 적용되는 어떤 규제 기관에도 받아들여지지 않는다.
결 론
LAB는 동물과 인간의 장내 미생물균총을 조절하기 위해 프로바이오틱스로 널리 사용되는 것 외에도, 발효식품의 제조 등을 포함하여 식품산업에서 매우 중요하면서도 널리 사용되고 있다[56,57]. 그러나 다른 미생물에 수평으로 전달될 수 있는 항생제 내성 유전자의 유무를 확인하기 위해서는 적절한 검사를 실시하는 것이 중요하다[58]. 또한 위장관의 미생물균총에 병원성균으로 또는 이로운 균으로 작용하는지도 조사되어야 한다[59]. 왜냐하면 공중보건과 식량 생산을 위협하는 저항 확산에 우호적인 환경 조건에 지속적인 노출이 된다면 이것은 향후 건강 문제를 일으킬 수 있을 것이기 때문이다.






