서 론
모유 수유는 신생아와 영아의 건강에 긍정적인 영향을 미친다. 모유는 영양 공급원일 뿐만 아니라, 전염성 질병으로부터 영아를 보호해주기 때문이다. 미성숙한 장내 점막은 염증을 일으키기 쉽지만, 모유수유아는 괴사성 장염 같은 염증성 질병 발병률이 대체적으로 낮았다[1]. 모유수유아와 분유를 섭취한 영아의 염증성 질병 발병률을 비교해보면 모유성분에는 항감염성과 프리바이오틱 기능 외에도 장내 기능과 장 발달을 촉진시키는 물질이 있음을 알 수 있다[2].
우유 성분의 장 발달과 면역 촉진 기능이 밝혀지면서 여러 우유 유래 생리 활성 물질이 발견되었다. 현재 이 우유 유래 화합물들은 새로운 임상 치료 요법으로 적용이 가능한지 확인하기 위해 활발한 연구가 진행되고 있다. 우유 생리활성 물질은 가격이 비싸지 않고 식품에서 유래했기 때문에 다른 화합물에 비해 안정성이 높고, 적용 범위가 넓다. 비록 소화관 질환 치료에 중점을 두고 있긴 하지만, 암, 인지 저하 및 고혈압과 같은 비소화관 질환 치료에도 유용할 수 있다. 하지만 특성 모유 성분의 임상 적용은 생산 기술 부족으로 인해 제한받고 있다. 모유 유래 생리 활성 물질이 원유 화합물과 동등한 기능을 나타내는 경우, 대체 경로를 통해 대량 생산이 가능하다. 유제품에서 우유 화합물을 대규모로 분리하거나, 수유기에 모유 성분을 발현할 수 있는 형질 전환 가축 생산 등의 대체 경로가 존재한다. 우유의 풍부한 단백질, 탄수화물 그리고 지방은 유아에게 최적의 영양과 면역력을 제공한다. 이 원고에서는 우유의 각 성분인 탄수화물, 단백질, 지방의 대표적인 생리 활성 물질 락토페린, 올리고당, 알파 락트 알부민, 인지질과 스핑고리피드의 기능, 역할과 임상 적용 현황을 설명하고자 한다.
본 론
산모의 초유에는 수용성 면역글로불린이 1 L 당 12 g, 성숙유에는 1 L 당 1 g 함유되어 있다. 따라서 모유 수유 시 어머니의 항체가 영아에게 전달되면서 병원성 미생물에 대한 방어 능력을 갖게 된다. 어머니의 항체는 면역력이 부족한 유아의 소화관에 면역력을 제공하며, 병원균의 장내 부착, 정착을 억제한다. 표준 분유와 비교했을 때 소의 초유 속 항체가 첨가된 영아용 분유는 이라크 아이들의 설사와 설사 관련 병들을 크게 줄여주었다. 장내 대장균에 면역력을 가진 소의 초유에서 추출한 초유 항체의 섭취는 건강한 성인 집단에서의 여행자 설사 발병률을 90%까지 감소시켰다. 이는 소의 초유가 특정 항균제로 사용될 수 있다는 것을 보여준다.
우유는 다양한 항균성 단백질을 함유하고 있다. 그 중에서 락토페린은 비헴 철 결합 단백질에 속하며, 80 kDa 크기의 양이온 당단백질이다. 철과 높은 친화도로 결합해 철에 민감한 장내 미생물에 미생물 압력을 가한다. 생체 외 실험에서 재조합된 락토페린은 Escherichia. coli, Staphylococcus aureus, Pseudomonas aeruginosa, Helicobacter pylori, Bacillus subtilis, Vibrio cholerae, Candida albicans를 포함한 병원성 미생물들의 성장을 억제하였으며, human cytomegalovirus, HIV, herpesvirus, hepatitis B, hepatitis C, hantavirus, human papillomavirus, rotavirus, adenovirus, influenza A의 증식을 억제했다[3,4].
락토페린의 대량 생산이 가능해지면서 다양한 형태의 락토페린에 대한 임상 적용이 고안되고 평가되었다(Table 1) [5–15]. 유청에서 소의 락토페린을 정제하는 것이 가장 두드러지며, 모유 유래 재조합 락토페린은 박테리아, 곰팡이, 식물, 동물벡터에서 성공적으로 발현되었고, 형질전환을 통해 상업적 대량생산이 가능해졌다.
| Milk component | Organism | Result of clinical trial | Reference |
|---|---|---|---|
| SlgA | Not specified | Reduced incidence of diarrhea | Tawfeek et al., 2003 [6] |
| SlgA | Enterotoxic Escherichia coli | Reduced incidence of infection by 90% | Otto et al., 2011 [7] |
| Lactoferrin | Not specified | Reduced duration and severity of diarrhea | Ochoa et al., 2012 and Laffan et al., 2011 [8,9] |
| Not specified | Reduced incidence of bacterial and fungal sepsis in premature infants | Manzoni et al., 2009 and Manzoni et al., 2012 [10,11] | |
| Not specified | Reduced mortality in patients with acute bacteremia by 46%. | Guntupalli et al., 2013 [12] | |
| Helicobater pylori | Improved infection resolution rate when added to standard therapy | de Beortoli et al., 2007 [13] | |
| Hepatitis C virus | Improved treatment response when used in combination with standard therapy | Kaito et al., 2013 [14] | |
| 3’-Sialyllactose | Helicobacter pylori | No benefit | Parente et al., 2003 [15] |
Adapted from Hill & Newburg [5].
동물 실험에서 대장균에 감염된 쥐에게 소의 락토페린을 경구 투여한 결과, 장내 패혈증이 감소하였다[16]. 대규모 무작위 연구에서 과저체중으로 태어난 미숙아에게 소의 락토페린을 투여한 결과, 생후 45일 동안 위약 치료에 비해 세균성 패혈증 발생률이 70% 감소하였다[11]. 또한, 일반 분유와 비교했을 때 재조합 모유 유래 락토페린을 첨가한 분유는 생후 1년 동안 호흡기 질환 발병률을 감소시켰다[17]. 우유의 생활성 물질들은 시너지 효과를 발휘할 수 있다. 143명의 어린이를 대상으로 한 이중 맹검 실험에서 재조합 락토페린과 라이소자임의 경구 투여는 급성 설사의 중증도와 기간을 두드러지게 감소시켰다[18]. 또한, 재조합 락토페린은 만성 C형 간염(HCV)을 포함한 기타 바이러스 감염에 효과적인 보조제로 사용될 수 있다. 감기증상을 빈번하게 보이는 환자 90명에게 락토페린을 90일 동안 날마다 600 g 투여한 결과, 락토페린 치료 그룹이 대조군에 비해 증상의 지속 기간이 두드러지게 감소했다[19]. 따라서, 락토페린은 임상적 효능이 입증되었으며, 인간의 질병 치료에 항균제로 적용될 수 있다.
락토페린은 면역 조절 면역 조절, 혈관생성억제(antiangiogenic), 세포 자살 활성 그리고 항염증기능을 가지고 있다[20]. 결과적으로, 락토페린은 세포 성장과 분화 조절 그리고 면역 반응에 영향을 미쳐 미생물 환경에서 중요한 역할을 하기 때문에 종양 성장을 억제하여 암 치료제로 적용될 수 있다. 재조합 락토페린의 투여는 폐암 환자의 평균 생존률을 65%까지 연장시켰으며, 동일한 락토페린을 화학 요법의 보조제로 사용하자 폐암 환자의 생존율이 현저히 향상되었다[21]. 소의 락토페린을 하루에 3 g씩 섭취한 성인은 결장에서 선정 폴립(adenomatous polyps) 성장이 두드러지게 억제되었다[22]. 그뿐만 아니라 락토페린은 유방암 화학치료요법 효과를 향상시킬 수 있다고 제안되었다[23]. 따라서, 폐암과 다른 악성 종양 치료에 락토페린을 적용하기 위해 추가 연구가 필요하다.
우유는 올리고당과 글리코사미노글리칸과 같은 다당류의 함량이 높다. 비소화성 올리고당은 우유 성분 중 3번째로 많은 성분으로 초유는 1 L 당 20 g, 성숙 모유에는 1 L당 5–10 g이 존재한다. 모유 올리고당은 환원 말단이 락토오스, 중심에는 polylactosamine, 비환원 말단에 푸코오스나 시알산이 있는 구조를 가진다. 모유 올리고당은 소화가 잘 되지 않고 직접적인 영양학적 기능이 나타나지 않는다[24]. 소화관 내 병원성 바이러스, 박테리아, 원생 동물들은 글리칸과 렉틴 같은 특정 세포 표면 구조의 발현에 의존하는데, 이는 숙주상피세포에 부착하고 침투하기 위함이다. 지금까지 모유에서 200종류 이상의 독특한 올리고당 구조가 밝혀졌다[25]. 특히, 모유 올리고당의 탄수화물 구조는 세포 표면 구조와 유사하다. 따라서 병원균이 장 점막에 부착되는 것을 막아준다[26]. 모유 올리고당은 배양된 상피세포에서 장 질환을 일으키는 대장균의 장 부착을 억제했고 장내 독소 결합 억제를 통해 대장균의 장 독소와 관련된 세포 독성을 감소시켰다[27].
모유 올리고당은 장내 미생물총과 무관하게 독립적인 면역 조절 효과를 보여준다. 특히 모유 올리고당이 혈액순환할 경우 두드러진 면역 조절 효과를 보여준다. 쥐에게 모유 올리고당인 lactoN-fucopentose Ⅲ를 복강 주사하자 CD4+ T 세포를 억제하였다. 그뿐만 아니라 NK 세포의 활성을 개시하는 복막 대식 세포 증식을 촉진시켰다[28]. Lacto-N-neotetraose 의 주입 후에도 유사한 결과가 얻어졌는데, 이는 대식세포에 의해 분비된 IL-10과 IL-13을 통해 숫 CD4+ T 세포 증식을 억제 했기 때문이다[29]. 또한, 산성 모유 올리고당은 사람의 제대혈에서 유래한 단핵 세포에서 IL-13과 IFN- 분비 발현을 향상시켰다[30]. 렉틴은 우유 글리칸의 잠재적인 세포 표면 수용체로 여겨진다[31]. 시알산이 첨가된 모유 올리고당은 내피에서 렉틴을 매개로한 백혈구의 부착과 혈소판-호중구 복합체의 형성을 억제하여 혈류로의 백혈구 유입을 막아 면역 반응 확장을 방해한다[32,33]. 또한, 모유의 올리고당은 내피와 다른 면역 세포의 렉틴 매개 상호작용 경쟁을 통해 백혈구의 침투와 괴사성 장염, 다른 면역 질병과 관련된 면역 반응의 단계적 상승을 억제할 수 있다[34]. 그 예로, 모유 올리고당이 함유된 분유를 괴사성 장염을 가진 설치류 모델에게 위관 급여하자 일반 분유에 비해 병원균 수치가 낮았으며 생존율은 더 높았다[35].
글리코사미노글리칸은 세포 외 기질에 가장 많은 성분으로 아미노당과 우론산 또는 갈락토스로 구성된 이당류가 이어진 선형 다당류이다. 프로테오글리칸을 형성하기 위한 단백질 코어 구조에 공유 결합으로 연결되며, 상처 치료, 응고 작용, 숙주 방어 등 많은 기능들에 기여한다[36]. 질량분석법에 의해 밝혀진 모유의 글리코사미노글리칸 조성은 콘드로이틴황산과 헤파린황산 함량이 제일 높았으며, 상대적으로 히알루론산과 데르마탄황산은 낮았다[37]. 모유의 콘드로이틴은 HIV와 동종 수용체인 CD4의 상호 작용을 특이적으로 억제했으며, 대장염에 걸린 쥐 모델에서 히알루론산의 복강 내 주사는 면역 활성을 억제하고, IL-10을 분비하는 항염증성 조절 T 세포 증식을 촉진했다[38]. 이 외에도 임상 실험 결과, 글리코사미노글리칸은 장내 상처 치료에도 효과가 있었다[39]. 특정 그리코사민글리칸과 프로테오글리칸을 기반으로 한 면역조절제의 발전을 위해 모유의 글리코사미노글리칸과 프로테오글리칸의 특성 규명이 필요하다.
알파 락트알부민은 모유에서 가장 풍부한 단백질 중 하나다. 알파 락트알부민과 갈락토스 전달 효소를 함유하는 복합체는 락토오스 생합성의 최종 단계를 촉진시킨다. 동물에서의 간질 치료 전임상 연구는 알파 락트알부민의 적용 가능성을 보여준다. 쥐에게 12일 동안 알파 락트알부민을 매일 투여한 결과, 청각 자극 때문에 생긴 발작의 심각도와 지속 기간이 감소하고, 화학적으로 유도된 발작을 예방하였다. 마찬가지로, 간질 예방을 위한 알파 락트알부민의 투여는 화학적으로 발작을 유도했을 때 발작 발생을 감소시켰다. 화학적으로 유도된 급성 발작 중에 알파 락트알부민의 알약 투여는 발작 활성을 90%까지 감소시켰다[40]. 이 효과는 트립토판이 풍부한 알파 락트알부민의 단백질 구조가 트립토판 전구체로부터 세로토닌 합성을 촉진할 수 있기 때문이다[41]. 간질은 전 세계적으로 약 6천 5백만 명의 사람들에게 영향을 주고 있다. 우유의 알파 락트알부민을 기반으로 한 내성 좋은 간질 치료제는 매일 일어나는 증상 관리를 위한 치료 옵션이 될 수 있다.
모유로부터 분리된 햄릿(Human α-lactalbumin made lethal to tumer cells, HAMLET)은 알파 락트알부민 변이체로 특유의 다중 결합 형태는 성숙한 상피를 보호하면서 형질전환된 상피, 배아세포, 임파상세포, 빈약한 성숙한 상피의 세포사멸사를 유도한다[42]. 햄릿은 종양 세포에 빠르게 흡수되어 세포 예정사를 유도한다. 햄릿은 히스톤 H3, H4, H2A, H2B와 결합하여 핵에 축적되며, 히스톤 아세틸화를 촉진해 세포 사멸 경로와 핵 염색질의 불용성을 야기한다[43]. 또한, 20S 단백질 효소 복합체와의 상호 작용은 단백질 분해 효소를 억제하고, 햄릿의 반감기를 연장시켜 자가소화작용(autophagy)을 유도해 종양세포를 파괴한다[44]. 종양 세포 표적화는 현대 암 치료에 필수적이다. 햄릿은 건강한, 분화된 세포 계통같은 비암성 조직에서 해로운 효과는 최소한으로 하면서 40종 이상의 림프종과 암종에 광범위한 항암 활성을 보였다[45].
암 질환 치료를 위한 햄릿의 임상 적용은 현재 집중적으로 연구되고 있다. 악성 뇌종양 치료 옵션은 중추 신경계를 보호하면서 화학 요법 민감성이 낮은 교아종(glioblastomas) 때문에 선택의 폭이 좁다. 사람의 교아세포종을 이종 이식한 쥐의 뇌 조직에 햄릿을 주입하자 종양 진행을 상당히 지연시켰다[46]. 마찬가지로, 방광암 수술 전에 환자의 방광에 햄릿을 주입하면 소변으로 종양세포가 많이 배출되고, 종양 크기가 감소하였다. 그뿐만 아니라 인접한 건강한 조직은 영향 받지 않으면서 종양 세포 자멸사가 증가하였다[47]. 비악성 유두종 바이러스(HPV)에 감염된 각질 세포, 피부 유두종에 햄릿을 국소 처리한 결과, 햄릿 치료 환자 90% 이상이 병변이 완전히 없어졌다. 부작용은 없었으며 치료 중단 후 햄릿 치료 환자의 83%가 2년 동안 효과가 지속되었다. 따라서 햄릿 치료는 인간 피부 유두종의 획기적인 치료법일 뿐만 아니라, 우유에서 유래한 햄릿은 놀라운 임상 잠재력을 지닌 새로운 항암 치료법이다. 햄릿은 적합한 분리 시스템을 갖춘 미생물이나 형질 전환 소에서의 재조합 단백질 등을 통해 대규모 생산이 가능하다[48].
우유는 필수 영양소뿐만 아니라, 칼슘, 지용성 비타민 A, D, E, K, 카로티노이드, 생리 활성 펩타이드, 스핑고지질 같은 기능성 화합물을 함유하고 있다. 우유의 지방산은 트리아실글리세라이드, 디아실글리세라이드, 모노아실글리세라이드 또는 인지질과 스핑고리피드 같은 글리세롤 지질로 에스테르화 될 수 있다. 포스파티틸에탄올아민, 포스파티딜이노시톨, 포스파티딜세린, 포스파티딜콜린으로 분류되는 인지질 그리고 스핑고지질은 모든 세포막의 유지 및 기능에 결정적인 역할을 하는 극성 지방질이다[49]. 인지질은 동물과 식물 세포의 구성 성분이기 때문에 식품에도 함유되어 있다. 그러나 원료에 따라 조성이 다르기 때문에 과일, 채소에는 인지질이 거의 존재하지 않지만, 난황, 대두, 오징어는 인지질 중 하나인 포스파티딜콜린 함량이 높다[50]. 반추 동물의 뇌 조직은 극성 지방질의 공급원이 될 수 있지만, 해면뇌병증(spongiform encephalopathy)을 일으킬 수 있기 때문에 제한된다. 하지만 인지질과 스핑고 지질은 유지방과 유지방구막의 구성 성분이므로 유제품을 통해 섭취가 가능하다.
유지방은 영양 공급원일 뿐만 아니라, 항암성을 가지고 있다. 유제품 유래 인지질의 항암 활성은 (i) 우유의 생리 활성 지방산을 방출하는 포스포리파아제 A의 활성 증가[51], (ii) 혈장에서의 HMG-CoA 환원 효소 억제와 지방산, 중성 지방 합성 억제를 통한 콜레스테롤과 트리아실글리세라이드 저하 효과[52], (iii) 스핑고미엘린의 Bcl-2 단백질 활성화를 통한 세포 자살에 의존한다[53]. 대장암 발생 1 단계에 해당하는 이상 잠복 병소(Aberrant foci cyrpts)를 가지고 있는 344 마리의 피셔(Fischer) 쥐에게 유지방구막과 유지방을 1:1로 섞어(25 g/kg) 3주간 식이 요법을 진행하자 암의 발병률을 감소시켰다[54]. 생체 외 실험에서는 우유에서 분리된 유지방구막이 HT-29와 Caco-2 대장암 세포의 증식을 억제했다[55]. 이 결과는 유지방구막과 유지방이 의료 식품으로 사용될 수 있음을 시사한다. 스핑고지질은 대장암의 치료제로 제안되고 있다. 이상 잠복 병소의 수를 감소시키고 대장암이 유도된 마우스에서 보호 효과를 제공하기 때문이다. 종양 유도 전에 유제품 유래 스핑고지질을 쥐에게 투여하자 화학 요법뿐만 아니라, 화학 예방 효과가 있었다. 이러한 화학적 예방효과는 스핑고 지질의 주요 대사 산물인 스핑고신, 스핑고신 인산염 및 세라미드가 조절 인자 유전자의 발현 변이에 기인한 세포 사멸을 유도하기 때문에 가능하다.
결 론
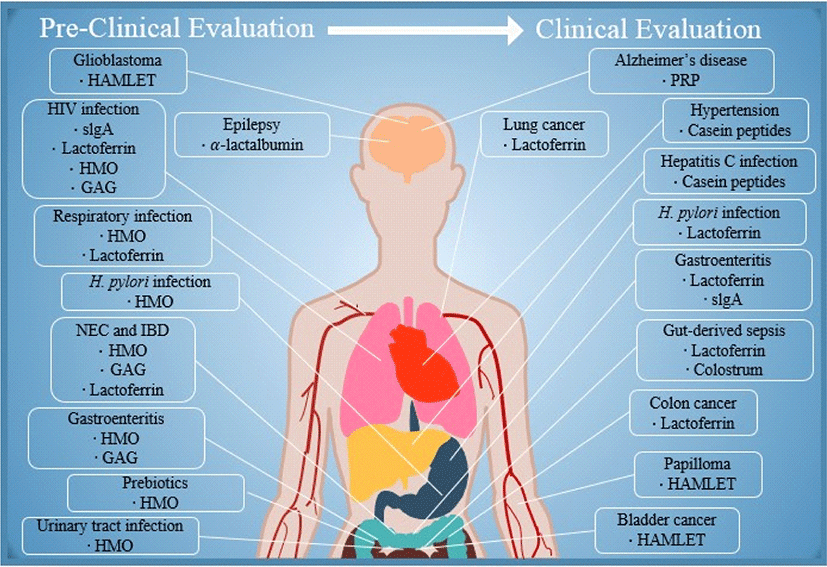
모유의 생리 활성 물질을 임상에 접목시킨 모유 연구는 중개 의학(translational medicine)과 모유 유래 치료 제제 개발을 가능하게 했다(Fig. 1) [5]. 몇몇 모유 유래 치료 제제는 이미 임상의가 이용할 수 있다. 많은 모유 성분이 전임상 연구에서 효과를 보였고, 유효한 임상 평가를 받았다. 경미한 임상 효과를 나타내는 경우 기능성 식품으로 개발되었다. 이 기능성 식품들은 모유 올리고당, 글리코사미노글리칸과 같이 생체 외 실험과 동물 모델에서 주목할만한 생리 활성과 잠재적 치료 유용성을 나타내는 물질을 포함한다. 실제로, 우유 섭취 시 여러 많은 질병으로부터 보호받을 수 있음을 시사한다. 소규모 임상 시험에서 서로 다른 매커니즘으로 작용하는 우유의 복합 화합물이 복합 보호 효과를 나타낼 수 있다고 제안했다. 따라서 우유 생리 활성 물질의 복합, 연계 응용을 평가가 필요하다. 우유 생리 활성 물질의 구조와 생물학적 기능이 특정 지어져도, 대규모 생산이 불가능할 경우 임상 적용이 어렵다. 락토페린과 모유 올리고당을 예로 들 수 있다. 재조합 락토페린 생산은 임상 평가를 가속화했지만, 모유 올리고당의 대규모 생산은 최근에서야 고안되었다. 임상 시험은 반드시 질병 동물 모델에서의 전임상 데이터를 기반으로 해야 하며, 적절한 환자 집단에서 수행되어야 한다. 우유 생리 활성 물질은 다른 화학 약품에 비해 이점이 있다. 우유 생리 활성 물질은 식품에서 유래했기 때문에 부작용이 적고 안정성이 높다. 이는 주체 기간과 피험자의 임상적, 재정적 위험을 최소화 한다. 따라서, 우유 생리 활성 성분의 임상 적용은 1) 우유 생리 활성 물질 분리와 생화학적 특성 확인, 2) 생체 외 실험과 관련된 동물 질병 모델에서의 전임상 시험, 3) 우유 생리 활성 물질의 합성이나 정제를 통한 대규모 생산, 4) 전임상 데이터를 기반으로 한 적절한 임상 시험 설계로 요약된다.