서 론
유산균은 탄수화물을 이용하여 젖산을 생성하는 미생물로서 오랫동안 산업에 이용되어 왔으며, 발효공정을 통해 탄수화물과 단백질 및 지방성분 등을 분해하여 풍미를 증진시키고, 영양학적 가치를 높여준다(Leroy and De Vuyst, 2004). Elie Mechinikoff가 불가리아 사람들이 장수를 누리는 이유가 Lactobacillus로 발효된 발효유의 섭취 때문이라는 것을 밝혀내어 노벨상을 받은 이래로 유산균과 프로바이오틱스의 기능성은 지속적으로 연구되어 오고 있다(Mercenier et al., 2003).
프로바이오틱스(Probiotics) 유산균은 체내에 들어가서 정장효과를 포함하는 유익한 기능성을 가지는 살아있는 균을 말하는 것으로, 장내에서 젖산을 생성하여 장내환경을 산성으로 만들어 산성에 견디지 못하는 유해균을 억제시키고, 산성에서 생육이 잘 되는 유익균의 증식 여건을 조성하여 정상 장내 세균총의 균형을 유지하고, 배변활동 원활에 도움을 줄 수 있다(Ouwehand et al., 2002). 유산균을 비롯한 세균들이 프로바이오틱스로 인정받기 위해서는 위산과 담즙산에 살아 남아 소장까지 도달하여 장에서 증식하고 정착하여야 하며, 장관 내에서 유효한 효과를 나타내어야 한다. 또한, 발효공정을 통해서는 추가적으로 유당불내증을 개선하고, 면역기능 개선 등 다양한 효능을 기대할 수 있어 소비자들의 관심이 높으며, 이에 대한 다양한 연구가 진행되고 있다. 이와 같이 다양화 되고 있는 제품 유형과 소비자 성향을 충족시켜주기 위해서는 우수한 프로바이오틱스의 지속적인 개발이 필요하다.
국내에서 사용되고 있는 유산균 종균의 경우, 대부분 수입에 의존하고 있는 실정으로 덴마크, 미국, 프랑스 및 독일 등 낙농선진국으로부터 수입하고 있는 실정이다. 이는 서구유럽의 유산균주 개량기술이 크게 앞서고 있기 때문으로 볼 수 있으며, 또한 국내적으로 산업적 이용가능한 유산균의 개발이 부족한 것도 유산균의 경쟁력 저하 요인으로 볼 수 있다.
김치는 우리나라의 대표적인 전통 발효식품(Choi and Hwang, 2000)이면서 세계 5대 건강발효식품 중 하나로 평가되고 있다. 최근에는 김치의 효능에 관한 연구가 활발해지면서 김치 발효과정에 관여하는 유산균에 대한 관심이 높아지고 있다. 김치 발효 젖산균으로는 Lactobacillus sp., Pediococcus sp., Leuconostoc sp., Weissella sp. 등의 주요 발효균이 있으며, 이들이 김치 발효에 있어 중요한 역할을 하는 것으로 알려져 있다(Han et al., 1990; Han, 1991; Park and Cheigh, 2000; Choi et al., 2002; Lee et al., 2002).
한편, 2018 식품연감에 따르면 생활수준의 향상과 의료기술의 발달은 고령화 사회를 급속하게 구성시키고 있으며, 우리나라의 경우에도 2026년에 65세 이상의 노인인구의 비율은 전체 인구의 20.8%로 5명 중 1명이 노인이 되는 초고령사회에 도달할 것으로 예측되고 있다. 고령인구는 노화가 진행됨에 따라 인체를 구성하는 조직 및 기관의 생리적 기능은 성숙기에 비해 비가역적으로 저하되며, 이러한 신체변화에 따라 만성 퇴행성질환의 위험률이 증가하며, 저작장애, 연하장애, 소화흡수율 저하, 미각감소 등의 현상이 나타나게 된다. 이중 저작능력 저하는 섭취할 수 있는 음식에 제한이 생기고, 식사의 양과 질이 떨어질 수도 있는데, 발효유 소재는 섭취 용이성과 함께 영양을 효과적으로 제공해줄 수 있을 것이며 특히, 단백질 분해특성이 우수한 유산균을 이용한 발효는 단백질과 같은 고분자물질의 저분자화로 소화용이성을 제공할 수 있을 것이다(Food Yearbook, 2018).
본 연구에서는 강원지역에서 제조된 전통김치로부터 lactose와 raffinose를 포함하여 분해능을 가지며 또한, 내산성 및 내담즙성과 우유단백질 분해능이 우수한 유산균을 분리 선발하고, 분리균의 형태 및 생화학적 특성과 항균성 및 장내부착능 등 프로바이오틱 활성을 조사하였으며, 새로운 유산균주로서 우유 발효용 스타터로서의 이용가능성을 검토하였다.
재료 및 방법
강원도 일원에서 25종의 재래김치를 수거하고, 각 시료별로 1 g씩을 취한 후 멸균수에 5배 희석하여 유산균분리를 위한 시료로 사용하였으며, 탈지분유는 서울우유(Seoul Dairy Cooperative, Korea) 제품을 사용하였다. 유산균의 분리 및 저장에는 BCP 배지(Eiken chemical Co., Ltd., Japan)와 MRS 배지(Difco, USA) 및 NA 배지(Difco, USA)를 사용하였고, 항균활성 실험에는 BHI 배지(Bacto, USA)를 사용하였다. 내산성과 내담즙성 실험에는 1 N HCl(Daejung chemicals & metals Co., Ltd., Korea)과 bile salts(Oxoid, England)를 사용하였으며, 당발효 실험에는 API 50CHL Kit(biomerieux, France)을 사용하였고, 적정산도 측정에는 0.1 N NaOH(OCI, Korea)을 사용하였으며, 단백분해능 실험을 위한 L-tyrosine과 1 N Folin 시약은 Sigma Aldrich(USA)로부터 구입하여 사용하였다.
희석한 김치 시료를 MRS 고체배지에 백금이로 획선 접종하여 37°C에서 24시간 동안 배양하고, 유백색의 콜로니를 크게 형성하는 균락을 1차적으로 50 콜로니를 선별하였다. 선별한 콜로니를 다시 BCP 고체배지에 획선 접종하여 젖산 생성으로 노란색을 형성하는 균락을 유산균으로 판단하고, 이들 중 산생성이 우수한 32 콜로니를 순수 분리하였으며, 이들을 대상으로 프로바이오틱 활성실험을 진행하여 우수균을 선발하였다.
내산성 확인을 위해 분리균주를 MRS broth에 접종하여 37°C에서 24시간 배양한 배양액을 1N-HCl로 보정하여 만든 pH 3.0 MRS broth에 각각 2%씩 접종하여 37°C에서 3시간 배양방법으로 테스트하였다. 배양된 샘플을 멸균수에 십진 희석하고, 1 mL를 채취하여 MRS agar에 접종한 다음, 37°C에서 24시간 배양하여 생성된 콜로니를 계수하고, 초기 균수와 배양 후의 균수를 비교하여 산성 pH에 대한 내성을 확인하였다. 내담즙성 확인은 분리유산균 배양액을 0.3% bile salts를 첨가한 MRS broth에 각각 2%씩 접종하여 37°C에서 6시간 배양방법으로 테스트하였다.
분리 유산균의 특성조사는 그람염색 후 광학현미경(BX60, Olympus, Japan)을 통한 형태학적 관찰, 산소 유무와 35°C 및 45°C에서의 생장, catalase 활성 여부 및 API 50 CHL kit에 의한 49종의 탄수화물 이용성을 확인하였다. API 50CHL medium에 현탁하여 strip에 분주한 후 37°C에서 48시간 동안 배양하였고, 실험에 의한 strip의 판독은 각 tube의 색변화로 negative(−), positive (+) 등으로 판정하였으며, API 50 CHL database를 이용하여 동정하였다.
분리균주의 정확한 동정을 위하여 16S rRNA gene 분석을 통한 유전학적 동정을 실시하였다. 분리균주의 콜로니 샘플은 MRS 액체배지에서 24시간 배양하여 genomic DNA를 추출 후 16S rRNA 증폭을 위해 유산균용 프라이머인 forward primer 27F(5'-aga gtt tga tcc ctc ag-3')와 reverse primer 1492R(5'-ggt tac ctt gtt acg act t-3')을 사용하였고, 처음 사이클은 95°C에서 15분, 30 사이클은 95°C에서 20초, 50°C에서 40초, 72°C에서 1분 30초, 마지막 사이클은 72°C에서 5분, 4°C에서 10분의 조건으로 polymerase chain reaction(PCR)을 수행하였다. 염기서열 분석은 ABI 3730XL capillary DNA Sequencer(Applied Biosystems)를 사용하였고, NCBI blast (www.ncbi.nih.gov/blast)의 database를 이용하여 유전학적 동정을 실시하였으며, 염기서열 분석에 기초하여 Phylogenetic tree를 나타내었다.
분리균주의 우유단백질 분해력 측정은 paper disc assay method와 tyrosine 함량 측정 방법으로 실험하였다. 2% SMP를 혼합한 NA 평판배지를 만든 후 paper disc를 올려놓은 다음, 상기 분리유산균 액체 배양액을 10 μL씩 적하하고, 37°C에서 48시간 동안 배양시켜 clear zone의 생성여부를 확인하였다. 투명환의 생성을 우유단백질 분해능이 있는 것으로 판단하였으며, 비교를 위하여 상업 균주인 L. acidophilus CSLA를 실험에 사용하였다.
Tyrosine함량 측정은 10% 환원탈지유를 배지로 사용하였으며, 유리되는 tyrosine 함량으로 나타내었다. 살균된 환원탈지유 배지에 계대배양된 분리균주 1%를 접종한 후 37°C에서 24시간 동안 배양하면서 4시간 단위로 시료를 취하여 분석하였다. 시료를 Whatman(No. 2) 여과지로 여과한 후 여과액 5 mL에 0.44 M trichloroacetic acid(TCA) 동량을 가해 침전시켜 상등액을 사용하였다. 30분간 방치 후 Whatman(No. 42) 여과지로 여과하여 여과액 1 mL와 0.44 M의 Na2CO3 2.5 mL를 혼합한 후 1 N Folin 시약 200 μL를 가하여 5분 동안 잘 흔들어 청색을 발색시켰다. 발색시킨 시료를 Spectrophotometer(X-ma 1200, Human Co., Ltd., Korea)로 660 nm에서의 흡광도를 측정하였으며, 측정값을 준비해 둔 tyrosine standard의 값으로 환산하여 유리된 tyrosine량을 μg/mL로 표시하였다(Hull, 1947).
분리균주를 MRS broth에서 37°C로 정치배양하면서 3시간 간격으로 시료를 채취하고, Spectrophotometer로 660 nm에서 흡광도를 측정하여 생육곡선을 작성하였으며, 생육에 따른 pH는 pH meter(Orion 3 star plus, USA)로, 산도는 AACC method 02-31(2000)에 따라 적정산도를 측정하였다.
분리균주의 항균활성 테스트는 Paper disc agar diffusion method(Song et al., 2009)을 응용하여 대표적인 병원성 지시균으로 Salmonella typhimurium ATCC14028, Listeria monocytogenes ATCC15313, Staphylococcus aureus ATCC25923, Bacillus cereus ATCC27348, Escherichia coli KCCM32396 등의 5종을 각각 tryptic soy broth에 접종한 뒤, 37°C에서 24시간 배양하여 피검균주로 사용하였다. 분리 유산균 배양액은 MRS broth에 분리균주를 접종하여 37°C에서 12시간 동안 전배양한 다음 샘플로 사용하였으며, 비교 유산균으로 상업균주인 L. acidophilus CSLA를 동일한 방법으로 전배양하여 사용해 비교하였다. MRS agar와 BHI(brain heart infusion) agar를 1:1로 혼합하여 평판배지를 만들고 충분히 굳힌 다음, 각 병원성 미생물 배양액을 고체배지 표면에 100 μL씩 뿌린 후 멸균 면봉으로 도말하였다. 표면을 충분히 건조시킨 후 멸균한 paper disk를 올려 각 유산균 배양액 샘플 50 μL씩을 접종하고, 37°C에서 24시간 동안 배양한 후 clear zone의 형성 여부를 확인하였다. 저해환의 크기는 12 mm를 초과는 ++로, 10–12 mm의 크기는 +로, 10 mm 미만은 w로 표시하였다.
분리균의 장내 부착능 실험에는 Caco-2 cell line을 사용하였고, L. rhamnosus GG(LGG; Valio Ltd, Finland) 균주를 대조군으로 하여 상대적 부착능을 확인하였다. 먼저 Caco-2 cell line 배양액을 37°C 5% CO2 환경에서 배양하여 준비하였으며, 부착도 측정을 위해 39번째와 41번째 분열기 사이의 Caco-2 cell line이 사용되었다. Caco-2 cell들은 5×102 mL 농도로 12개의 세포배양 plate well에 loading 후 72시간 동안 배양하여 80%가 채워진 단일세포층을 형성하였다. 부착도 측정 전에 Caco-2cell을 항생제가 없는 MEM 배지에서 2시간 동안 배양하고, 이 배양액을 0.5 mL의 시료 유산균이 담긴 동량의 PBS 용액과 혼합하여 최종 세균 농도가 2×108 CFU/mL가 되도록 하였다. 다음으로 용액을 각 조직배양 plate well에 첨가하고 37°C, 5% CO2 환경에서 2시간 동안 배양하였다. 그 이후 단일세포층을 멸균한 PBS(pH 7.2) 용액으로 2번 세척하고, 10% 포르말린 용액으로 고정시킨 다음 crystal violet으로 염색하고 현미경 하에서 관찰하였다.
분리균주의 관찰은 SEM(TM3030 Plus, HITACHI, Japan)을 사용하였다. 분리균주를 MRS agar에 streaking하여 증식시킨 후 단일 콜로니를 백금이로 취하여 slide glass에 균일하게 도포하였으며, 이를 SEM용 샘플 holder에 고정시켰다. 샘플 holder를 SEM에 위치시킨 후 진공상태를 형성하여 외부 공기를 차단시킨 다음 15,000–30,000배율로 형태를 관찰하였으며, 저진공에서 15 kV 조건으로 imaging 하였다.
결과 및 고찰
김치시료 1 g씩을 멸균수에 희석한 후 MRS 고체배지에 백금이로 획선 접종하여 37°C에서 24시간 동안 배양하고, 유백색의 콜로니를 크게 형성하는 균락을 1차적으로 50 콜로니를 선별하였다. 선별한 콜로니를 다시 BCP agar에 획선 접종하여 젖산 생성으로 노란색을 형성하는 균락을 유산균으로 판단하였으며, 이들 중 상대적으로 노란색환을 빠르고 크게 형성하여 산생성이 우수한 것으로 판단되는 32 콜로니를 순수 분리하였다.
분리한 32개 균주를 대상으로 우수균주를 선발하기 위한 프로바이오틱 활성 측정으로 내산성 및 내담즙성을 실험하였다. 분리균주를 MRS broth에 접종하여 37°C에서 24시간 배양한 배양액을 준비하고, 내산성은 1N-HCl로 보정하여 만든 pH 3.0 MRS broth를 사용하였으며, 내답즙성은 0.3% bile salts를 첨가한 MRS broth를 사용하여 각각 2%씩 접종하고, 37°C에서 3시간 및 6시간 배양방법으로 테스트하였다. 배양된 샘플을 멸균수에 십진 희석하고 1 mL 채취하여 MRS 평판배지에 접종한 다음, 37°C에서 24시간 배양하여 생성된 콜로니를 계수하고, 초기 균수와 배양 후의 균수를 비교하여 산성 및 염기성 pH에 대한 내성을 확인하였다.
유산균이 probiotics가 되기 위해서는 위장의 pH 3 이하의 산성조건과 소화효소가 많은 담즙의 환경조건에서 생존할 수 있어야 한다(Mcdonald et al., 1990; Ouwehand et al., 1999). 실험결과를 바탕으로 내성이 우수한 수준을 생존율 60% 이상으로 임의 판단하였으며, Table 1에서 보이는 것과 같이 60% 이상의 생존율을 보인 시료는 내산성 실험에서는 16개 균주, 내염기성 실험에서는 22개 균주가 확인되었는데, 내산성과 내염기성에서 모두 60% 이상의 생존율을 보인 균주는 13개 시료를 나타내었다. 특히 내담즙성 실험에서는 8개 균주에서 100% 이상의 생존율을 보였는데, 이는 0.3%의 bile salts 농도에서는 생장이 억제되지 않고 일정비율로 증식이 가능하였음을 보여주는 것으로 김치유래 유산균들이 내산성뿐만 아니라, 매우 우수한 내담즙성을 나타내는 것을 확인할 수 있었다. 이는 김치유래 유산균은 내담즙성보다는 높은 내산성을 지닌다는 기존 보고들과 차이를 보였는데, 김치종류별로 봤을 때 내담즙성을 지닌 유산균이 깍두기에서 다른 김치종류에 비해 월등히 많았다는 Ko 등(2013)의 보고와 같이 김치종류의 차이 때문으로 생각된다. 본 연구에서는 일반적으로 pH 2.5–3.5에서 90% 이상의 내산성으로 보이는 것으로 알려진 L. acidophilus에 비교되는 내산성과 내염기성 모두에서 90% 이상의 매우 우수한 내성을 보인 KC23과 KF26 2개 균주를 우수균주로 선발하고, 동정 및 추가적인 특성을 실험하였다.
분리균주 KC23과 KF26의 형태적, 생화학적 특성을 분석한 결과는 Table 2와 같았다. 2개 균주 모두 그람염색을 통해 그람양성(+)균임을 확인하였고, 현미경 관찰결과 rod 형태를 보였으며, catalase 시험 결과 음성(—)반응을 나타냈고, 산소 유무와 관계없이 잘 증식하였다. 또한 최적 생장온도를 확인 하기 위하여 BCP agar에 streaking한 후 45°C 및 35°C에서 24시간 동안 배양한 결과, 45°C에서는 거의 생장이 이루어지지 못하고, 35°C에서는 잘 생장하는 전형적인 중온균의 특성을 보였다. 또한, KC23과 KF26의 당분해 특성을 확인하기 위해 API 50 CHL kit를 이용하여 37°C에서 48시간 동안 배양한 후 각각의 당이용 패턴을 조사한 결과는 Table 3과 같다. KC23 균주는 D-galactose, Lactose 및 Raffinose을 포함하여 양성반응을 보여 우유 또는 두유중의 당이용 가능성을 확인할 수 있었으며, 이에 비하여 KC26 균주는 D-galactose에서는 양성 반응을 보였으나, lactose와 raffinose에서는 음성반응으로 차이를 보였다. 당분해 패턴을 API 50 CHL database를 이용하여 동정한 결과, KC23은 L. plantarum과 KF26은 L. paracasei와 각각 99.9% 유사한 것으로 판정되었다.
| Characteristics | KC23 | KF26 |
|---|---|---|
| Cell type | Rod | Rod |
| Gram stain | + | + |
| Catalase test | — | — |
| Aerobic growth | + | + |
| Anaerobic growth | + | + |
| Growth at 35°C | + | + |
| Growth at 45°C | — | — |
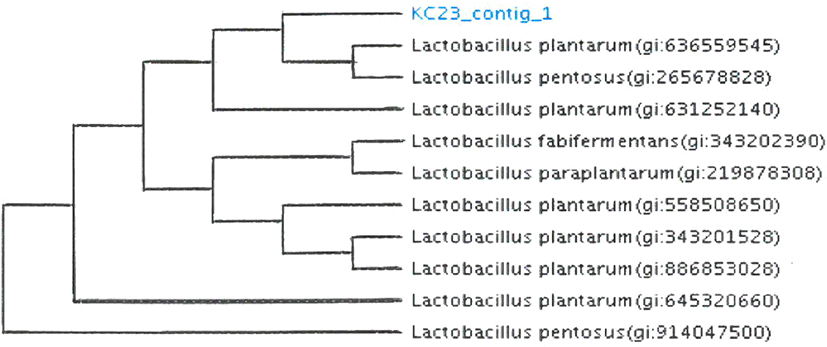
분리균주 KC23과 KF26의 종 수준까지 정확한 동정을 위하여 16S rRNA gene분석을 통한 유전학적 동정을 실시하였다. 염기서열의 상동성이 97% 이상을 보일 때 하나의 종으로 정의할 수 있는데, Table 4의 결과와 같이 KC23은 Lactobacillus plantarum, KF26은 Lactobacillus paracasei로 99% 이상의 상동성을 보이며 동정되었다. 본 연구에서는 우유 또는 두유 요구르트 제조용 스타터로서 활용하기 위하여 당분해 특성에서 lactose와 raffinose에 양성 반응을 보인 Lactobacillus plantarum KC23을 최종균주로 선발하고, 한국미생물보존센터에 기탁(KCCM12351P)하였으며, phylogenetic tree를 Fig. 1에 나타내었다.
| Strains | Identification | API 50 CHL | 16S rRNA |
|---|---|---|---|
| KC23 | Lactobacillus plantarum | 99.9% | 99% |
| KF26 | Lactobacillus paracasei | 99.9% | 99% |
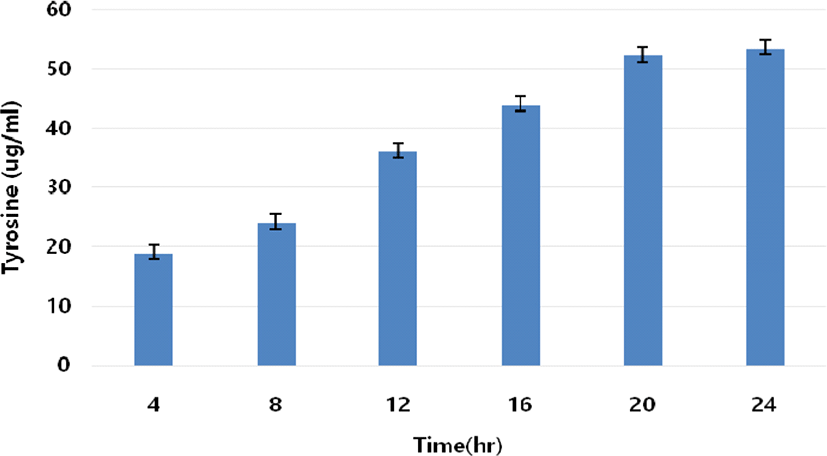
분리균주 L. plantarum KC23의 우유단백질 분해력 측정은 10% 환원탈지유를 배지로 사용하였으 며, 유리되는 tyrosine 함량 및 clear zone 크기로 나타내었다. MRS broth에서 계대배양한 분리균주를 10% 환원탈지유에 2%씩 접종한 후 37°C에서 24시간 동안 배양하면서 유리된 tyrosine 함량을 측정한 결과 Fig. 2와 같이 나타났다. 배양 후 8시간 이전까지는 미미한 수준의 단백질 분해력을 보였으며, 배양 8시간 후에는 24.1 μg/mL에서 16시간 후에는 43.9 μg/mL, 20시간 후에는 52.2 μg/mL로 급격한 증가를 보였다. 이는 Lim 등(2008)이 Kefir에서 분리한 Str. thermophilus LFG-1의 65–78 μg/mL보다는 다소 낮은 수준이지만, Mok 등(2002)이 내몽골산 치즈에서 분리한 L. amylovorus IMC-1의 배양 12시간 후 6 μg/mL 및 배양 72시간 후 69 μg/mL보다는 높은 단백질 분해활성을 보였다. 또한, 2% SMP를 혼합한 NA고체배지에서 투명환 생성 여부를 비교균주인 L. acidophilus CSLA와 함께 확인한 결과, Fig. 3과 같이 L. plantarum KC23가 비교균주의 약 9 mm보다 큰 약 12 mm의 투명환을 형성시키며 우수한 우유단백질 분해 특성을 나타내었다.

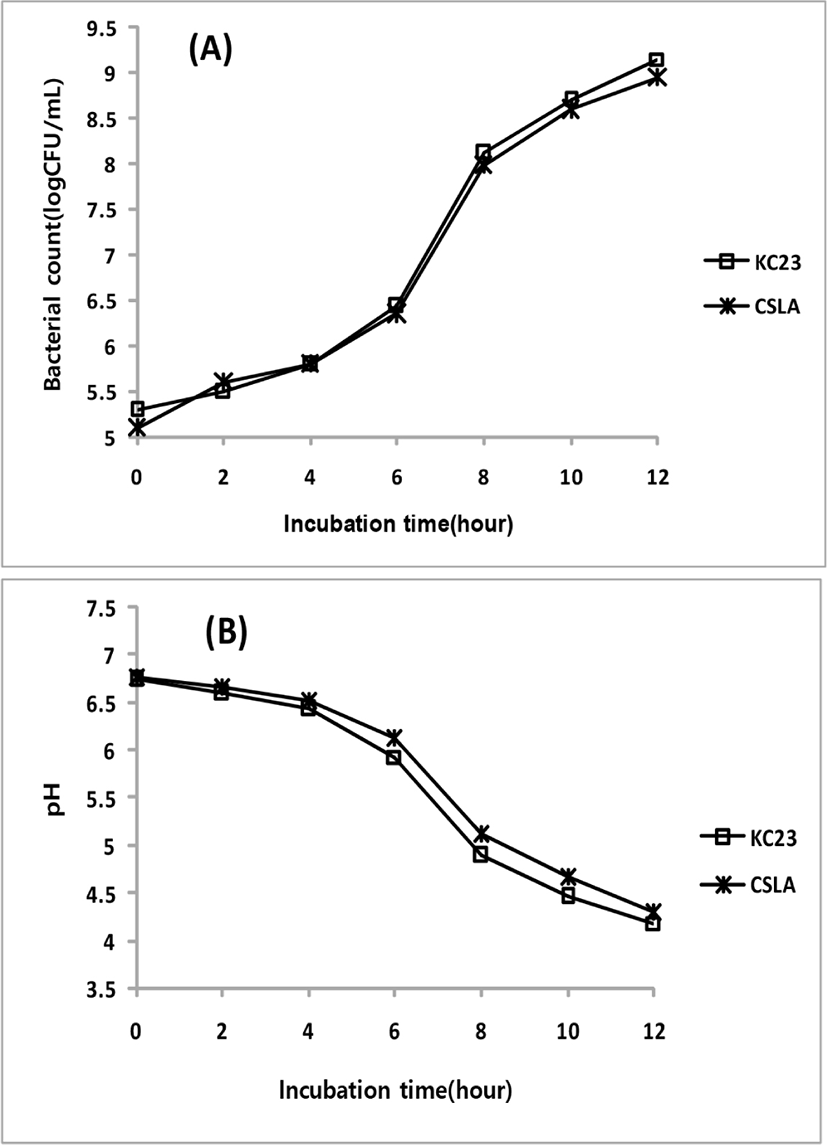
분리균주 L. plantarum KC23의 생장특성을 확인하기 위해 MRS broth에 각 균주를 접종한 후, 앞의 최적생장온도 실험에서 확인된 37°C에서 12시간 동안 배양하면서 2시간 간격으로 Spectrophotometer를 이용하여 660 nm에서의 흡광도를 측정하고 생육곡선을 작성하였다. Fig. 4(A)와 같이 균주의 생육은 배양 6시간에서 10시간 사이에 대수증식기를 보이며 잘 생육하였고, 배양 12시간 후의 생균수는 8.9×108 CFU/mL를 보였으며, 10시간 이후에는 완만한 증가세로 정체기에 접어 들고 있음을 확인할 수 있었다. 대조균으로 사용된 L. acidophilus CSLA의 생장 형태는 서로 유사한 경향을 보여 분리균주는 상업균주와 같이 우수한 생장능력이 있음을 알 수 있었다. 또한, pH의 변화는 Fig. 4(B)에서 보이는 것과 같이 분리균과 대조균이 생균수의 증식곡선에 비례하여 6시간에서 10시간 사이에 급격한 저하를 보였고, 배양 12시간 후에는 pH 4.25 수준으로 감소하였다. Lee 등(2013)은 배추김치로부터 분리한 L. curvatus Gk36의 조사에서 25°C–30°C에서 최적생장온도를 가지며, 배양 15시간 후 pH 3.84 수준까지 저하되었다고 하였으며, Kim 등(2013)은 묵은지에서 분리한 L. sakei JK-17의 기능성 조사에서 30°C 진탕배양으로 pH 4.1까지 저하됨을 보고하였고, Song 등(2009)은 김치에서 분리한 L. plantarum YK-9이 pH 3.6까지 감소됨을 보고하였다. 이들에 비하여 분리균주 L. plantarum KC23은 pH 4.25로 다소 높은 수준을 보였는데, 신맛을 선호하지 않는 시니어 프랜들리용 발효유 제조에 적용하기에 적합할 것으로 판단되었다.
분리균주의 항균활성 테스트는 tryptic soy 고체배지에 paper disk method를 이용하였으며, Salmonella typhimurium, Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus와 Escherichia coli 등 5종의 병원성 미생물에 대하여 형성된 clear zone의 size를 비교하였다. 실험 결과, Table 5와 같이 분리균주 L. plantarum KC23은 시험한 5개 모두의 병원성 균주에 대해 8–13 mm의 저해환을 형성하여 항균력을 나타내었고, 포도상구균을 제외한 다른 4종의 병원성균에 대하여 모두 상업균주인 L. acidophilus CSLA보다 우수한 항균특성을 보였다. 이는 Ahn 등(2003)의 김치로부터 분리한 유산균 중 35%–50%에서 Listeria monocytogenes, Escherichia coli, Salmonella typhimurium에 대한 항균력을 보였다는 보고와 Ko 등(2013)의 Bacillus sp. Listeria monocytogenes, S. typhimurium에 대해 항균력을 지닌 유산균이 갓김치보다 배추김치 등에서 2배 이상 존재한다는 보고 등 김치유래 유산균의 우수한 항균특성 보고들과 유사한 결과이다. 일반적으로 유산균은 젖산을 생성하여 산도를 낮춤으로써 병원성 세균의 생육을 억제하며, bacteriocin 등의 항균물질을 생성하여 항균작용을 나타내는 것으로 알려져 있다(Kaur et al., 2002; Song et al., 2009). 따라서 항균 활성이 우수한 분리균주는 생균제 또는 발효유용으로 이용시 유해균의 증식을 억제하여 장내균총을 개선시키는 효과를 기대할 수 있을 것으로 판단된다.
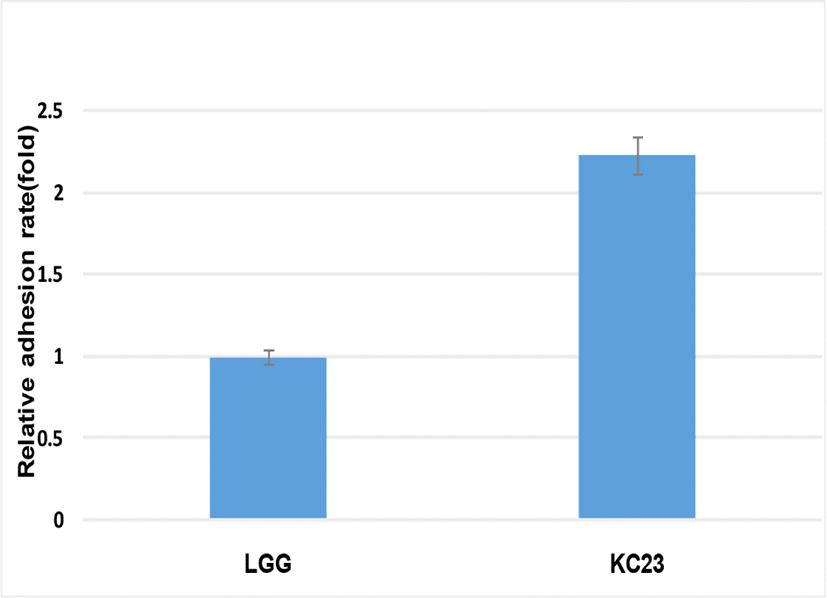
장세포 부착능은 프로바이오틱스로서 숙주의 장내 환경에 대한 적합성을 판단하는 대표적인 방법이며(O’Halloran et al., 1997), 이를 확인하기 위한 실험을 진행하였다. 인체의 소장 상피세포와 유사한 형태로 증식되는 Caco-2 cell line을 사용하였고, 일반적으로 사용되는 상업균주로서 L. rhamnosus GG를 대조군으로 하여 상대적 부착능을 확인하였다. 실험 결과는 Fig. 5와 같이 LGG의 장세포 부착능을 1.0%로 보았을 때 분리균주인 Lactobacillus plantarum KC23은 2.23%를 보였으며, 이때의 유산균수는 8.6×106 CFU/mL로서 비교적 높은 수준의 우수한 장세포 부착능을 확인할 수 있었다. 장내에 부착하여 군락을 형성해 생존하여야 사멸된 유산균에 비하여 면역활성 증진 및 항암효과가 크다고 보고되고 있다(Ouwehand et al., 1999).
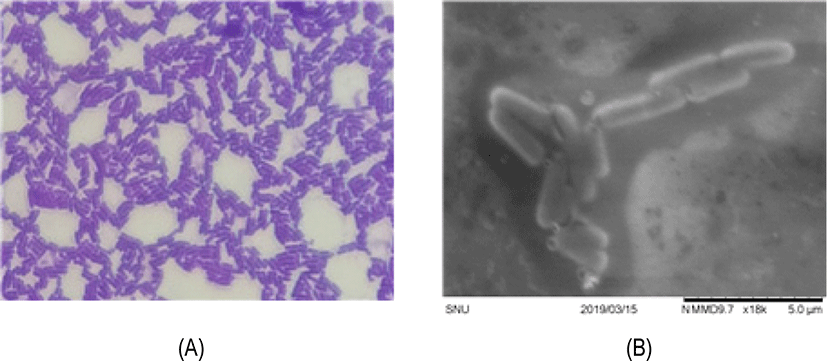
Lactobacillus plantarum KC23 유산균을 crystal violet으로 염색하여 1,000배율의 광학현미경으로 관찰한 결과, 단간균 형태임을 확인할 수 있었고, 전자현미경으로 관찰한 결과, 세포의 크기는 약 2–3 μm를 나타내었으며, 표면상태는 점질물이 없이 매끄러운 형태를 보였다(Fig. 6).
분리균주인 L. plantarum KC23와 대조구로서 상업균주인 L. acidophilus CSLA를 MRS broth에서 37°C로 12시간 동안 배양하여 스터터로 사용하였으며, 10% 환원탈지유를 85°C로 10분간 살균하고, 1%씩 접종한 후 37°C에서 12시간 동안 배양하여 pH 및 적정산도 변화를 관찰하고, 발효유 제조용 starter로서의 사용 가능성을 판단하였다. 살균탈지유에서 12시간 동안 배양한 결과, MRS broth에서와는 다르게 상업균주인 L. acidophilus CSLA의 경우 pH 3.92와 적정산도 0.94%를 보인 것에 비하여 L. plantarum KC23의 경우는 pH 4.32와 적정산도 0.74%로 다소 낮은 산생성을 보였다(Table 6). L. plantarum KC23의 이러한 특성은 약한 신맛을 선호하는 소비층을 대상으로 하는 저산성 발효유제조에 활용할 수 있을 것으로 사료된다.
| L. plantarum KC23 | L. acidophilus CSLA | |
|---|---|---|
| pH | 4.32 | 3.92 |
| Acidity (%) | 0.74 | 0.94 |
요 약
본 연구는 전통 김치로부터 유단백질 분해능과 lactose 분해능을 가지는 유산균을 선발하고, 프로바이오틱 활성을 측정하여 발효유용 스타터로서의 이용가능성을 조사하였다. BCP agar에서 젖산생성력이 우수한 32 colony를 선발한 후 내산성 및 내담즙성 모두에서 90% 이상으로 내성이 우수한 2 colony(KC23, KF26)를 2차로 선발하였다. 이들을 대상으로 API 50CHL 탄수화물 이용성 테스트 및 16S rRNA 염기서열을 분석한 결과, L. plantarum KC23과 L. paracasei KF26으로 동정되었다. 이들 중 lactose와 raffinose를 포함하여 당분해능을 가진 L. plantarum KC23을 최종 선발하고 프로바이오틱 활성을 조사하였다. 우유단백질 분해능을 10% 환원탈지유 배양 중의 유리 tyrosine 함량으로 측정한 결과, 배양 8시간 후에는 24.1 μg/mL에서 배양 16시간 후에는 43.9 μg/mL로 급격하게 증가되었으며, 또한 clear zone형성 크기를 비교한 결과 12 mm로 상업균주인 L. acidophilus CSLA의 9 mm보다 우수한 특성을 보였다. 온도별 생장특성을 확인한 결과는 45°C에서 보다 35°C에서 잘 증식하는 중온균의 특성을 나타내었고, 37°C에서 12시간 동안 배양한 결과 배양 6–10시간 사이에 대수증식기를 보였으며, 배양 12시간 후 생균수는 8.9×108 CFU/mL와 pH 4.25 수준을 나타내었다. 항균활성을 측정한 결과는 5개 병원성균에 대하여 8–13 mm의 clear zone을 형성하여 우수한 저해특성을 보였으며, 그중 Salmonella typhimurium과 Bacillus cereus에 대한 항균활성이 가장 우수하였다. 장내부착능을 측정한 결과는 비교균주인 LGG에 비하여 2.23배의 우수한 결과를 보였으며, 10% 환원탈지유를 이용한 37°C 배양에서 젖산생성능을 확인한 결과는 대조군인 L. acidophilus CSLA에 비하여 다소 낮은 경향을 보였지만, 적정산도가 0.74% 수준으로서 저산성 발효유 제조를 위한 스타터로 활용 가능할 것으로 판단되었다.