서 론
칸디다성 질염은 진균성 질염으로 75% 이상의 여성이 일생에 한 번 이상 겪는 질환이며, Candida 진균이 질 내에 과다 증식하면서 질 내의 유익한 미생물총의 균형을 깨트려 발생하게 되는 질병이다 (Ferrer 2000; De Gregorio et al., 2012). 칸디다성 질염의 가장 흔한 원인균은 Candida albicans로 전체 발병율의 85∼90%에 해당된다(Yoo et al., 2010). 치료제로는 polyene 계열의 amphotericin B와 azole계열의 fluconazole과 ketoconazole 등의 항생제를 복용 또는 질 내 주입하는 방법이 사용되고 있다(Han, 2003).
유산균주는 여성의 질 내에서 병원균의 생장을 억제하는 물질을 생성하여 기회성 감염을 막는 역할을 한다. 건강한 여성의 질 내에는 많은 종류의 유산균주가 있고, 이러한 유산균주는 건강한 질 내 환경을 유지하는데 중요한 역할을 한다. 유산균주는 젖산을 생성하여 질 내 산도를 낮추고 hydrogen peroxide, bacteriocins 등 다양한 항생물질을 생성하여 질염 원인균의 증식과 감염을 예방하며, 질 내 상피 세포에 부착부위를 선점하여 질 건강 유지에 기여한다고 알려져 있다(Balciunas et al., 2013). 유산균주와 칸디다 진균이 건강한 여성의 질 내에 같이 생존하는 경우가 있으나, 항생제 등에 의해 유산균주 균총이 감소하게 되면 병원균이 증식하게 되어 칸디다 질염이 발병하게 된다(Ferrer, 2000; De Gregorio et al., 2012). 그러므로 유산균주는 비뇨생식기 관련 병원균에 의해 일어나는 감염에 대한 1차적인 미생물학적 장벽으로 작용한다(Chapman et al., 2013; MacPhee et al., 2013).
유산균을 활용한 프로바이오틱스 제품개발이 성공적으로 진행되기 위해서는 제조과정에서의 가혹한 스트레스 조건에서 살아남아야 한다. 동결건조 방법은 유산균 배양 후 저장하는 과정에서 가장 일반적으로 사용되는 방법이다. 그러나, 동결건조 과정에서 유산균은 낮은 온도, 낮은 수분활성도와 같은 가혹환 환경조건에 노출되면서 생존율이 감소하게 된다. 스트레스 적응은 동결건조 과정에서 다양한 미생물의 생존율을 높이는 효과가 있는 것으로 알려져 있으며(Kang et al., 2015), 이러한 적응 메커니즘은 동결 및 동결건조 과정에서 중요한 변수 중에 하나이다(Kwak et al., 2014). 열 전처리에 의한 고온 내성 증진은 Lactobacillus paracasei, L. acidophilus, L. casei, Bifidobacterium bifidum과 같이 다양한 유산균에서 그 효과가 확인되었다. 이러한 전처리 효과는 스트레스 조건에서 발현된 방어기작이 다른 스트레스에 대한 내성에 영향을 미치는 cross protection 효과의 가능성을 보여주고 있다(Paz et al., 2012; Sharareh et al., 2013).
본 연구는 선행연구를 통해 칸디다성 질염의 원인인 Candida albicans에 항진균 효과가 있는 것으로 밝혀진 Lactobacillus salivarius MG242 균주를 열 전처리공정을 통해 열 스트레스에서의 생존율 증진 및 항진균 효과의 변화를 확인하였다.
재료 및 방법
본 연구에 사용한 균주는 선행연구를 통해 건강한 한국여성의 질에서 분리한 유산균주 중 항균활성 및 항진균활성이 우수한 L. salivarius MG242(MG242) 균주를 선택하여 실험을 진행하였다(Jung et al., 2017; Kang et al., 2018). 배지는 Lactobacilli MRS broth(Difco, MI, USA)를 사용하여 37℃에서 혐기 조건으로 배양하여 실험에 사용하였다. 칸디다 질염유발 원인균인 Candida albicans SC5314는 한국미생물보존센터에서 분양받았으며, YM(1% glucose, 0.3% malt extract, 0.5% peptone, and 0.3% yeast extract)배지를 사용하여 37℃에서 배양하였다.
37℃에서 18시간 동안 배양한 MG242 균주를 원심분리(7,191 g, 4℃, 10분)하여 0.1 M phosphate-buffered saline(PBS, pH 7.2)으로 2번 세척한 후, 0.1 M PBS로 OD600이 1이 되도록 재현탁하였다. 재현탁한 균주는 water bath를 사용하여 40℃, 50℃, 60℃에서 40분까지 열 스트레스 실험을 수행한 후, 가장 높은 생균수를 보이는 전처리 온도를 열 스트레스 실험에 적용하였다. 스트레스에 노출된 시간마다 MRS 배지에 배양액을 접종하고, 37℃에 24시간 배양한 후 생균수를 확인하였다.
MG242 균주의 최적의 열 전처리 조건을 확인하기 위해 MRS 배지에서 37℃, 24시간 배양한 후 0.1 M PBS로 2번 세척한 후 OD600이 1이 되도록 재현탁하였다. 현탁액은 열 전처리를 진행한 것, chloramphenicol(100 μg/mL)을 포함(Hartke et al., 1996)하여 열 전처리한 것으로 나누어 47℃, 52℃에서 각각 15분 동안 배양한 후, 60℃에서 40분간 노출시켜 MRS 배지에 배양액을 접종하고, 37℃에 24시간 배양한 후 생균수를 측정하였다.
세포 외 다당체(Exopolysaccharide, EPS) 추출방법은 Liu와 Fang(2002) 의 방법을 수정하여 진행하였다. 열 전처리한 균주와 열 전처리하지 않은 균주를 각각 멸균증류수에 희석한 후, 원심분리 (8,000 g, 4℃, 20분)하였다. 세포가 제거된 상등액은 최종농도 10%가 되도록 trichloroacetic acid를 첨가하여 4℃에서 2시간 동안 정치시킨 후, 3배수 95% 에탄올을 첨가하여 4℃에서 15시간 동안 침전시켰다. 침전시킨 상등액을 다시 원심분리(13,200 g, 4℃, 40분)하였다. Polysaccharide 농도는 phenol–sulfuric acid 방법을 통해 정량화 하였다. 모든 시료는 UV–vis spectrophotometer(Ultrospec 2000; Amersham Pharmacia Biotech Inc., NJ, USA)를 이용하여 490 nm 에서 측정하였다.
열 스트레스에 노출되었을 때 열 전처리가 세포의 형태에 어떠한 영향을 미치는지 확인하기 위하여 SEM 촬영을 수행하였다. 열 전처리한 균주와 열 전처리하지 않은 균주를 열 스트레스 조건인 60℃에 40분간 노출시킨 후 2.5% glutaraldehyde(Junsei, Japan) 용액에 4℃에서 24시간 동안 고정화시킨 후 에탄올로 탈수하여 시료를 준비하였다. Field Emission SEM(Hitach S-4300, Japan)을 이용하여 균주의 형태 변화를 관찰하였다.
열 전처리한 MG242 균주의 C. albican에 대해 정량적인 항진균 효과를 확인하기 위해, 열 전처리한 MG242 균주와 C. albicans를 혼합 배지(MRS 액체 배지와 YM 액체 배지를 1,1(v/v)로 혼합)에 균의 농도가 최종적으로 105 CFU/mL가 되도록 각각 접종하였다. 37℃에서 24시간 정치배양 후, C. albicans는 YM 배지에서 생균수를 확인하고, MG242 균주는 cycloheximide (100 μg/mL)를 도포한 MRS 배지에서 생균수를 확인하였다.
결과 및 고찰
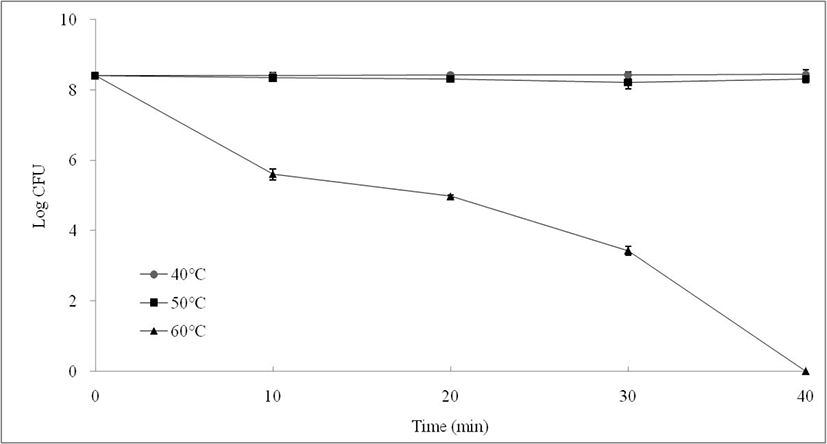
열 스트레스 조건과 열 전처리 조건을 결정하기 위하여 다양한 온도에서 열 전처리를 한 후 열 스트레스를 가하는 실험을 수행하였다. MG242 균주를 40℃, 50℃, 60℃에서 각각 40분간 열 스트레스 내성을 측정하였다(Fig. 1). 40℃와 50℃에서는 40분 동안 생균수의 변화가 없었으나, 60℃에서는 처리 후부터 생균수가 급격하게 감소하는 것을 확인할 수 있다. 프로바이오틱스 균주로 사용하기 위해서는 최종 제품에서도 생균의 형태로 존재해야 한다. 생산공정에서 다양한 스트레스에 대해 생존력을 유지하여야 하며, 이러한 스트레스 내성은 프로바이오틱스 산업에서 매우 중요한 부분으로 알려져 있다(Yanez et al., 2008).
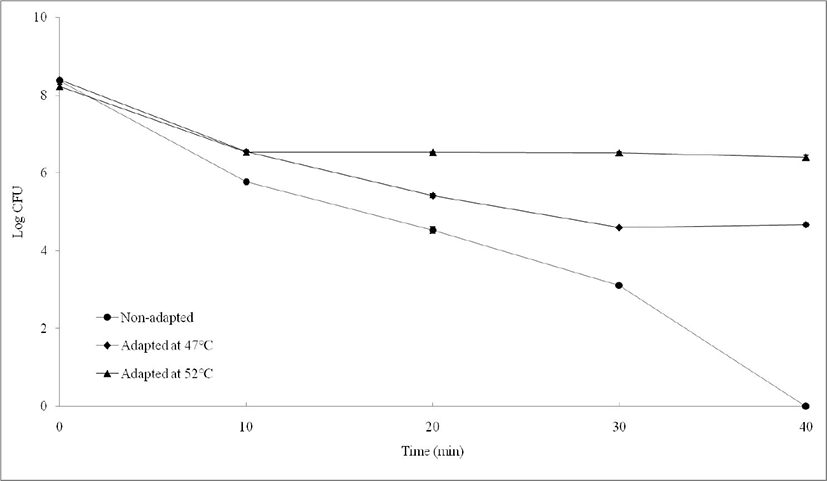
치명적이거나 그 이하 수준의 스트레스 조건에 미생물이 노출되었을 때, 미생물은 해당 스트레스에 대해 적응하게 된다(Alvarez-Ordonez et al., 2008). 따라서 MG242 균주를 47℃와 52℃에서 각각 15분간 처리하여 열 전처리를 진행하였고, 열 전처리된 MG242 균주를 60℃에서 40분간 노출시켜 열 전처리 효과를 확인하였다(Fig. 2). 실험결과, 47℃에서 열 전처리한 조건보다 52℃에서 열 전처리를 진행한 조건에서 생존율이 우수한 것을 확인할 수 있었다. 높은 온도에서 균주의 가장 큰 문제는 단백질 변성과 응집이 일어나며(Somero, 1995), 열 스트레스에 대한 반응으로 리보솜, RNA, 막 유동성의 변화와 같은 불안정성이 일어난다(Hansen et al., 2001).
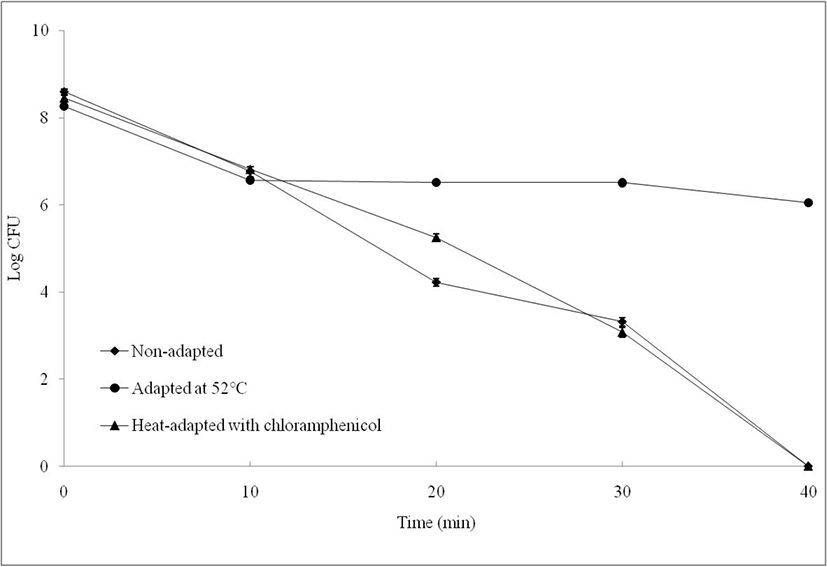
전처리 동안에 유도되는 단백질 합성이 열 스트레스에 노출되었을 때 내성을 유도하는지 확인하기 위해 단백질 합성 저해재인 chlorampenicol을 처리하여 실험을 진행하였다. Fig. 3과 같이 열 전처리 과정에서 chloramphenicol(100 μg/mL)을 처리한 경우 열 내성 증진효과를 보이지 않는 것을 확인할 수 있었다. 기존의 연구(Sörqvist, 2003)에 의하면 열 전처리가 진행되면서 chloramphenicol에 의해 열 내성 효과가 현저히 감소한다고 알려져 있다. Chloramphenicol은 정균작용을 하는 물질로 단백질 합성을 방해하는 것으로 알려져 있다.
MG242 균주의 열 전처리 시 EPS 생성을 확인하였다. EPS는 세균과 조류에서 광범위하게 생성하며, 효모와 진균에서 덜 생성되는 것으로 알려져 있다(Sutherland, 1998). EPS는 다당류와 단백질이 결합되어 있는 형태이다. EPS를 생산하는 균주의 건강 증진효과는 biopolymer의 생물학적 활성과 밀접한 관련이 있으며, EPS가 prebiotics 또는 면역조절 기능 등을 가지고 있어 인체 내 건강에 기여한다고 보고된 바 있다(Forde and Fitzgerald, 1999; Looijesteijn et al., 2001). 본 연
구에서는 열 전처리 전후 MG242 균주의 EPS 생성량은 유의적인 차이가 없는 것을 확인할 수 있었다. 이는 MG242 균주의 경우, EPS 생성이 열 전처리 후 열 스트레스에 대한 생존율에 영향을 미치는 않는 것이라 사료된다.
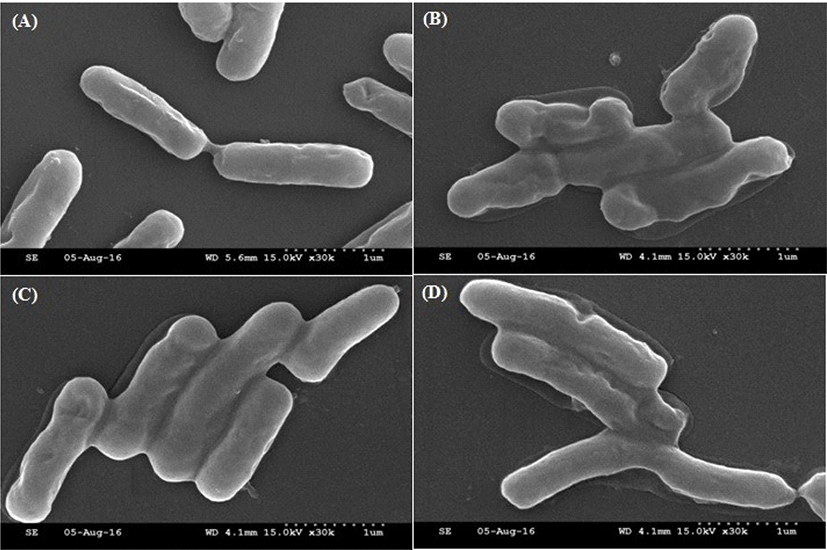
열 전처리 과정과 열 전처리 후 열 스트레스에 노출이 되었을 때, MG242 균주의 표면변화를 관찰하기 위해 주사전자현미경을 통해 확인하였다(Fig. 4). MG242 배양온도인 37℃에서의 균 형태는 세포표면의 변화가 없는 것을 확인할 수 있었으나(Fig. 4A), 열 스트레스 조건인 60℃에서는 세포표면의 심한 손상과 응집이 일어나는 것을 확인할 수 있다(Fig. 4B). 열 전처리 직후(Fig. 4C)에는 세포표면이 신장된 형태를 보이나 유지가 되었으며, 열 전처리 후 열 스트레스에 노출되었을 때(Fig. 4D), 세포표면의 응집효과는 일부 일어나지만 열 스트레스 조건에 비해 형태가 유지되는 것을 확인할 수 있었다. Scheie와 Ehrenspeck(1973)의 연구에 의하면 55℃ 열에 노출 시 세포표면의 단백질이 변형되고, peptidoglycan층이 약해진다고 알려져 있다. MG242 균주도 열 전처리의 영향으로 세포의 형태가 늘어진 모양을 띄는 것으로 사료된다.
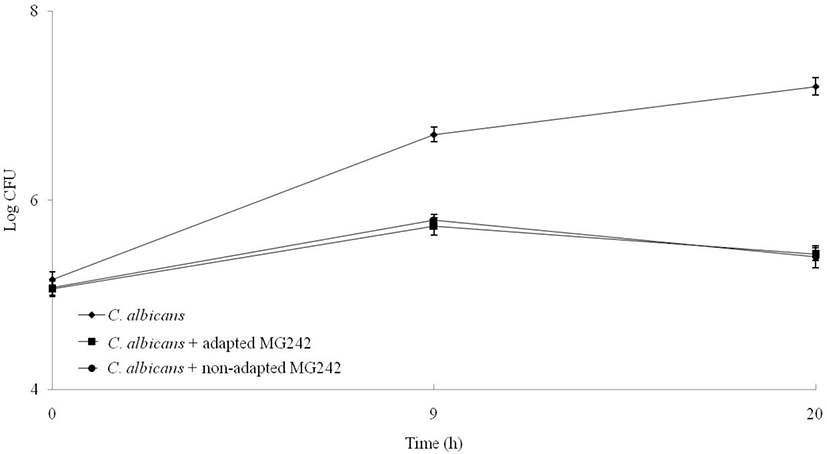
열 전처리된 MG242 균주의 항진균효과를 확인하기 위해 C. albicans와 혼합배양을 통해 항진균 효과를 확인하였다. 열 전처리된 MG242 균주와 C. albicans를 혼합배양 시 현저하게 C. albicans 의 생균수가 감소하였으며, 이를 통해 MG242 균주는 열 전처리 전과 후의 C. albican 에 대한 항진균효과는 차이가 없는 것을 확인할 수 있다(Fig. 5). 이는 유산균이 혼합배양 시 항진균 물질을 생성함에 따라 저해효과가 발생하는 것으로 알려져 있다(Reid, 2001; Mastromarino et al., 2002).
결 론
본 연구는 선행연구인 한국 여성의 질에서 분리한 Lactobacillus salivarius MG242 균주를 통해 열 전처리를 통해 열 스트레스 조건에서의 생존율 증진 및 칸디다성 질염의 원인인 Candida albicans에 항진균효과의 변화를 확인하였다. 최적의 열 전처리 조건에서 열 전처리를 진행한 결과, 고온의 열 스트레스에서 높은 생존율을 유지하는 것을 확인할 수 있었다. 열 전처리 후에도 C. albicans에 대한 항진균효과는 변화가 없는 것을 확인할 수 있었으며, 이는 향후 L. salivarius MG242 균주를 프로바이오틱스로써 대량생산의 가능성을 확인하고, 질 건강을 위한 프로바이오틱스의 주요한 소재로 활용될 수 있을 것이라 사료된다.






