서 론
프로바이오틱스는 숙주의 장내미생물 균형을 유지시킴으로써 유익한 작용을 하는 살아있는 미생물을 의미한다(FAO/WHO, 2011). 일반적으로 프로바이오틱스는 장내균총의 안정화, 유해세균의 억제, 면역활성화 작용, 항암작용, 유당불내증의 경감 등의 기능을 갖고 있다고 알려져 있다(Alander et al., 1999; Vrese et al., 2001; Seo et al., 2010). 일반적으로 유산균은 GRAS(generally regarded as safe) 미생물로 분류되고 있어, 프로바이오틱스로서의 이용가치가 매우 높은 것으로 알려져 있다. 프로바이오틱스로 가장 많이 이용되고 있는 균주는 Lactobacillus와 Bifidobacterium이며, 발효유, 건강식품, 유산균 정장제 등에 사용되고 있다(Vrese et al., 2001). 미생물이 프로바이오틱스로 사용되기 위해서는 섭취에 대한 안전성, 소화기관내에서의 안정성, 세포정착능력과 항균활성에 대한 기능성 및 배양에 대한 기술적인 부분에 대한 검증이 되어야 하며, 제조공정이나 완제품 유통과정 중에 생존성이 충분히 유지되어야 한다(Fukushima et al., 1998; Isolauri et al., 2001). 비피더스균(Bifidobaterium spp.)은 인체 장내에 상재균으로 다양한 대사와 면역조절 기능으로 인체에 유익한 균으로 잘 알려져 있다(Poupard et al., 1973). Bifidobacterium 속은 유아에서는 Bi. bifidum, Bi. longum, Bi. infantis, Bi. breve 등이 검출되고, 성인에서는 Bi. bifidum, Bi. longum, Bi. adolescentis 등이 주로 검출된다고 알려져 있다(Holt, 1997). 비피더스균은 일반 젖산균과는 달리 담즙에 비교적 높은 저항력을 가지고 있으며, 유기산과 지방산을 생성시켜 항염증 효과(Maslowski et al., 2009) 등 숙주에게 이로운 작용을 하며, 과민성 대장증후군을 완화시키고 (Guglielmetti et al., 2011), 유해균 억제 및 혈중 콜레스테롤 감소, 면역조절 작용(Savard et al., 2011)을 한다. Bifidobacteria의 probiotic 효능이 밝혀지면서 인체에서 분리한 Bi. longum, Bi. lactis, Bi. breve, Bi. adolescentis, Bi. infantis가 주로 이용되고 있다(Sanders, 1995; Kurmann, 1998).
이에 본 연구에서는 한국의 건강한 어린이 분변에서 분리한 비피더스균의 내산성, 내담즙성과 autoaggregation 능력 등을 통해 프로바이오틱스로 적합한 균주인지 확인하고자 한다.
재료 및 방법
본 연구에 사용된 비피더스균주는 강원도 지역에서 출생한 건강상태가 양호한 유아(2∼15개월)의 분변으로부터 분리하여 실험에 사용하였다(Table 1). 증식용 배양배지는 0.05% L-cystein을 첨가한 MRS broth(mMRS, Difco, MI, USA)를 사용하였다. 균주의 보관은 20% glycerol stock으로 −70℃에서 보관하였다.
분리 균주의 동정을 위하여 16S rRNA gene sequencing을 수행하였으며, 유전자의 증폭은 the universal rRNA gene primers(27F and 1492R)를 사용하였고, 각 과정은 SolGent Co.(Daejeon, Korea)을 통하여 진행하였다. 이후 분석된 16S rRNA sequencing 결과는 National Center for Biotechnology Institute(NCBI)의 Basic Local Alignment Search Tool(BLAST) analysis (http://blast.ncbi.nlm.nih.gov/Blast.cgi)를 통해 Genbank database와 비교하여 동정하였다. Sequence는 PHYDIT 3.1을 통하여 alignment를 진행하였고, 이후 MEGA 5.1 software를 이용하여 neighborjoining method로 계통수를 작성하였다(Tamura et al., 2011).
분리된 비피더스균주의 장내 환경과 같은 산성 및 담즙염에 대한 생균력을 확인하기 위해 Guo의 방법(2010)으로 실험을 진행하였다. 비피더스균주를 mMRS 배지에 24시간 배양한 후, OD600 1.0으로 조정하여 새로운 mMRS 배지에 1% 접종하여 18시간 배양하였다. 배양액은 원심분리(4,000 g, 4℃, 5분)한 후, 0.85% saline에 2번 세척하였고, OD600 1.0 (108~109 CFU/mL)으로 조정하여 각각 산성과 담즙염에 대한 내성 실험에 사용하였다. 산성에 대한 내성을 확인하기 위하여 비피더스균주 희석액 1 mL를 9 mL PBS(pH 2와 7)에 첨가 후 진탕한 뒤 37℃에서 3시간 배양한 후 생균수를 확인하였다. 담즙염 내성은 0∼1% oxgall(Difco, MI, USA)을 포함한 mMRS 배지에 비피더스균주 희석액을 1% 접종하고, 37℃에 24시간 배양한 후 생균수를 확인하였다.
장내 세포 내 부착능력을 간접적으로 확인하기 위하여 Kassa의 연구(2014)를 변형하여 autoaggregation 실험을 진행하였다. mMRS 배지에 유산균을 전 배양한 배양액을 OD600 1.0으로 조정하여 새로운 5 mL mMRS 배지에 1% 접종한 뒤, 18시간 배양하여 실험에 사용하였다. 배양한 유산균은 원심분리(4,000 g, 4℃, 5분)한 후, PBS에 2번 세척하였고, OD600 1.0으로 조정하여 균주 현탁액 5 mL를 10초간 진탕한 뒤 5시간 동안 방치하면서 autoaggregation을 확인하였다. 실험 시작 직후 (A0)와 5시간 후 (A), 각각 0.1 mL의 상등액을 취해 0.9 mL PBS와 혼합한 뒤 600 nm에서 흡광도를 측정 (A0, A)하였고, 다음 계산식에 따라 autoaggregation을 계산하였다.
항생제 감수성 시험은 Clinical and Laboratory Standards Institute(CLSI) guidelines(2006)를 따라 MHA 배지를 이용 disc method에 의해 수행하였다. 분리된 비피더스균주를 mMRS 액체배지에서 배양한 후, 104 CFU/mL 정도의 균체를 MHA 배지에 도말한 후, 항생제 디스크(BBL, Becton Dickinson, USA)를 올려놓았다. 37℃에서 24시간 배양한 후 억제환의 크기를 mm 단위로 측정하여 표준지표에 따라 판정하였다. 사용한 항생제 디스크는 모두 BD BBL(Becton Dickinson and Company, USA)사 제품으로 ampicillin(AM, 10 μg), cefotaxime(CTX, 30 μg), cefotetan (CTT, 30 μg), cephalothin(CF, 30 μg), ciprofloxacin(CIP, 5 μg), cefepime(CEP, 30 μg), erythromycin(E, 15 μg), gentamicin(GM, 10 μg), kanamycin(K, 30 μg), nalidixic acid(NA, 30 μg), rifampin(RA, 5 μg), streptomycin(S, 10 μg), tetracycline(TE, 30 μg), trimethoprim/sulfamethoxazole(SXT, 1.25 μg/23.75 μg), vancomycin(VA, 30 μg)을 사용하였다.
본 연구에 사용된 비피더스균주 중 프로바이오틱스 성능이 우수한 비피더스균주를 선별하여 효소활성을 확인하였다. mMRS 배지에 평판도말한 후 37℃에서 18시간 배양 후 균체를 취하여 API ZYM enzyme system(Bio Merieux, France)의 API Suspension medium(2 mL, Bio Meriux, France)에 5.0∼6.0 McFarland standard(Bio Meriux, France)로 탁도를 맞추었다. API ZYM strip 각각의 큐플에 Suspension medium을 65 μL씩 분주하고 37℃에서 4시간 동안 배양한 후, 결과를 확인하였다.
결과 및 고찰
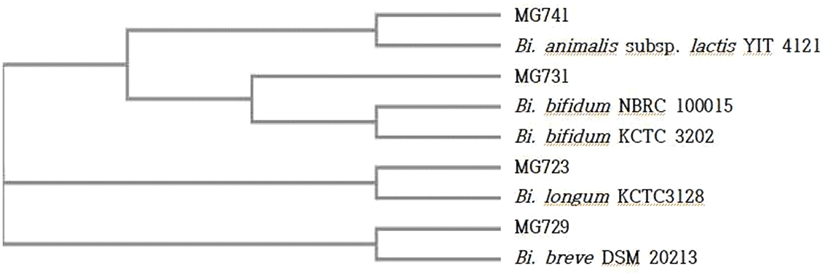
현재 국내에서는 프로바이오틱스로 사용가능한 균주의 확보가 미흡한 수준으로 프로바이오틱스 균주의 확보가 절실히 요구되고 있다(Bang et al., 2012). 이에 본 연구에서 분변으로부터 분리된 균주는 16S rRNA 동정을 통해 Bifidobacterium longum MG723, Bi. breve MG729, Bi. bifidum MG731, Bi. animalis subsp. lactis MG741로 각각 동정되었다(Fig. 1). 분리균주에 대한 세포의 형태는 주사전자현미경을 통하여 관찰하였으며, 모두 간균의 형태인 것을 확인할 수 있었다(Fig. 2).

유산균이 프로바이오틱스로 기능을 발휘하기 위해서는 소화관 내의 조건에서 생존해야 한다. 구강을 통해 섭취된 유산균은 위액과 각종 효소가 존재하는 위를 통과하고, 담즙이 존재하는 십이지장을 거 쳐 최종 목적 부위인 장에 도달해야 기능적인 효과를 나타낼 수 있다. 유산균이 위에서 위산과 같은 낮은 pH에서 생존하기 위해서 위산에 대한 내산성을 나타내야 하며(Sim et al., 1995; Saarela et al., 2000), 장내 극한 환경에서 생존하기 위해서는 쓸개에서 분비되는 담즙에 대한 내성을 지녀야 한다(Dunne et al., 2001). 산성에 대한 내성실험의 결과, pH 2에서 모든 균주가 102 CFU/mL이상의 생균수를 나타냈으며, MG741(4.01 log CFU/mL)이 가장 높은 생균수를 보이는 것을 확인할 수 있었다(Table 2). 체내 위액의 pH는 대략 3.0으로 유지되며, 일반적으로 pH 3에서 3시간 이상 생균수를 유지하면 산성에 높은 내성을 보이는 것으로 알려져 있다(Guo et al., 2010). Mishra의 연구(2005)에 따르면 프로바이오틱스로 사용되는 여러 균주들이 pH 2에서 일반적으로 104 CFU/mL 이하의 생균수를 보이는 것을 확인할 수 있으며, Lankaputhra and Shah의 연구(1995)에 따르면 9종의 비피더스균주의 pH 1.5∼3.0에서의 내산성에서 Bi. bifidum, Bi. breve, Bi. adolescentis는 내산성이 매우 약하다고 보고하고 있다. 이에 본 연구에서 사용된 비피더스균주의 경우 산성에 대해 우수한 내성능력을 가지고 있는 것을 확인할 수 있다.
분리된 비피더스균주의 담즙염에 대한 내성을 확인하기 위해서 일반적으로 0.3%의 담즙염 농도를 통해 내성을 확인하는데(Gilliland et al., 1984), Maslowski 등(2009)의 연구에 의하면 비피더스균주들은 일반 유산균과 달리 담즙염에 비교적 높은 내성을 가지고 있는 것으로 알려져 있다. 본 연구에서 사용된 비피더스균주들은 0.3% 담즙염 농도에서 평균 7.67 log CFU/mL의 매우 높은 생균수를 보여, 담즙염에 대해 매우 우수한 내성을 보이는 것을 확인할 수 있다(Table 2). MG 741균주의 경우 1% 담즘염 농도에서도 6.67 log CFU/mL로 다른 비피더스균주들과 비교하여 매우 높은 내성을 나타내는 것을 확인할 수 있다. Clark and Martind의 연구(1994)에 따르면, 1% oxgall 농도에서 생존율을 비교한 결과, Bi. bifidum, Bi. infantis, Bi. adolescentis는 12시간 후 생존하지 못하였으며, Bi. longum은 12시간 후에도 높은 생균수를 보였다고 보고하고 있다.
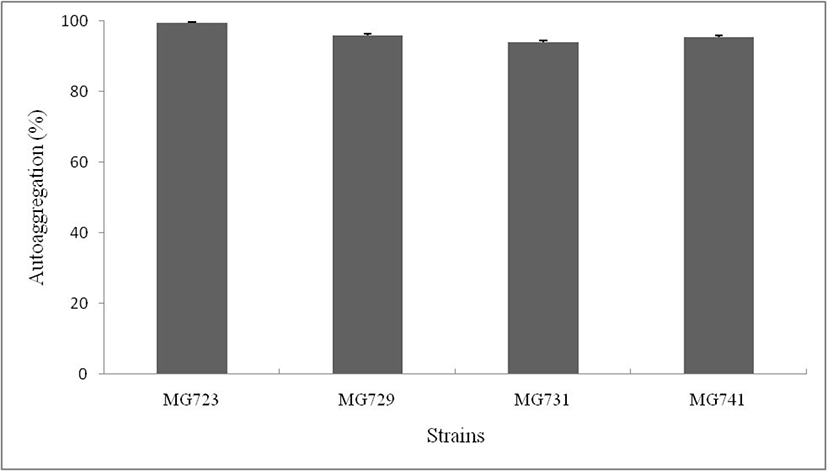
프로바이오틱스로 사용되는 유산균의 경우, 체내에서 지속적으로 작용하기 위해서 장 세포에 부착할 수 있는 세포부착능이 요구된다(Lin et al., 2006). Autoaggregation 능력은 세포 부착능을 간접적으로 확인할 수 있는 방법으로, Kos(2003)의 연구결과에 따르면, autoaggregation 능력이 높은 균주가 실제 세포 부착능력 또한 높다고 알려져 있다. 본 연구에서 사용된 비피더스균주에 대한 장내 부착성을 확인하기 위해 autoaggregation 실험을 진행하였다(Fig. 3). 비피더스균주에 대한 autoaggregation 능력은 평균 96.2%로 매우 높은 autoaggregation 능력을 보였으며, MG723 균주가 99.5±0.03%로 가장 높은 autoaggregation 능력을 나타내었다. Malik의 연구결과(2013)에 따르면, 유산균주의 in vitro에서 autoaggregation이 약 70%로 나타났으며, in vivo 상의 상피세포에서의 부착능도 50%로 in vitro 상의 결과와 in vivo 상의 결과가 연관되어 있는 것으로 알려져 있다.
유산균은 프로바이오틱스로서 유익한 측면에서의 장점과 더불어 기회감염균으로의 가능성에 대해 확인해 보아야 한다. 최근 Streptococcus, Lactobacillus 등이 심내막염 수술 후에 감염된 것으로 보고(Oakety et al., 1995)되었는데, 질병예방 및 치료의 목적으로 사용되고 있는 항생제의 빈도와 농도가 증가되면서 장내 미생물은 유산균의 항생제 내성과 함께 유전자전이에 대한 연구가 진행되고 있다. 분리된 비피더스균 4종에 대해 항생제 내성 특성은 Table 3과 같다. RA, E, VA, AM, CEP 에서는 대부분 저해되는 것을 확인할 수 있었다. GM, K, S, CIP, NA에는 내성을 나타내는 것을 확인할 수 있는데, Ann의 연구결과(2011)에 따르면, 비피더스균주들은 세포벽 합성 저해제인 페니실린계 항생제에 대해서는 감수성이 높고, cephalosporin계에도 감수성이 높은 것으로 알려져 있다. 단백질합성억제제인 aminoglycoside계에는 대부분 내성을 나타내며, DNA 합성저해제인 퀴놀린계에 대해서도 내성이 강한 것으로 보고되고 있다.
분리된 비피더스균주 중 산성과 담즙염에 내성이 우수한 MG741균주의 효소활성을 측정하였으며, Table 4와 같이 19종류의 효소 중 3종류(Leucine arylamidase, Naphtol-AS-BI-phosphohydrolase, β–glucuronidase)의 효소활성이 확인되었다. Leucine arylamidase는 펩타이드 가수분해 효소이며, 효소, 에스트로젠대사 및 세포분열에 관여하는 β-glucuronidase에도 활성이 있는 것을 확인하였다.
결 론
본 연구는 한국인 유아에서 분리한 비피더스균주를 통해 프로바이오틱스로 사용 가능성을 확인하기 위해 산, 담즙염, 자가부착성 및 항생제 내성에 대한 연구를 진행하였다. 분리된 비피더스균주는 16S rRNA sequencing 결과, Bifidobacterium longum, Bi. breve, Bi. bifidum, Bi. animalis subsp. lactis로 동정되었으며, 모두 건강기능식품의 기준 및 규격에 등재되어 안정성이 입증되어 있는 균주로 확인되었다. 분리된 비피더스균주는 산성과 담즙염에 대한 내성이 우수하였으며, autoaggregation 능력이 평균 96.2%로 장내 부착성이 우수할 것이라 사료된다. 본 연구에 사용된 비피더스균주들은 현재 시판되는 상업용 종균과 비교해서도 동등한 프로바이오틱스 기능성을 보이고 있으며, 향후 프로바이오틱스 개발 분야에 주요한 소재자원으로 활용될 수 있을 것이라 기대된다.






