서 론
장내세균과의 일종인 살모넬라균은 통성혐기성 그람 음성 간균으로 사람이나 동물 숙주에 침투하여 단순한 장염부터 생명을 위협하는 장티푸스(Typhoid)성 질환까지 다양한 살모넬라증(salmonellosis)을 일으킨다(Grassl and Finlay, 2008). 낙농 제품과 유제품 및 유가공 제품의 생산과 유통에 있어서 살모넬라균 감염에 의한 피해는 매우 빈번하며, 오염된 제품에 의한 대대적인 식중독 발병의 경우 또한 세계적으로 빈번하다(Ryan et al., 1987; Kousta et al., 2010). 특히, 유가공 제품의 생산에 쓰이는 시설과 기구들에서 발생하는 생균막(biofilm)이 큰 위험인자인데, 생균막내에도 많은 살모넬라균의 존재가 확인되고, 이들에 의해 발생하는 감염사례 또한 살모넬라균 제어의 필요성을 보여준다(Chmielewski and Frank, 2003; Oliver et al., 2005). 살모넬라균은 감염 숙주 동물이 다양한 약 2,500종류의 혈청형을 가진 Salmonella enterica 종에서 비롯되며, 인간 숙주에 한정적으로 장티푸스를 일으키는 Typhi와 Paratyphi 를 제외한 모든 혈청형이 유가공 산업에 직․간접적으로 위협이 될 수 있다(Staff, 2002).
살모넬라균의 항미생물 제제에 대한 내성은 세계적으로 증가하는 추세이며, 이에 따른 새로운 항미생물 제제의 개발은 살모넬라균 감염 조절에 필수적이다(Wales et al., 2010; Hur et al., 2012). 많은 항미생물 제제들은 세균의 막과 막 외부 주변 공간의 훼손을 목표로 하는데, 그것은 세균 막의 직접적인 훼손뿐 아니라, 세균 생존에 필수적인 세균의 외부환경 신호 전달체계를 훼손함으로써 효과적으로 세균의 증식을 제어할 수 있기 때문이다. 하지만 개발되는 항미생물 제제가 세균 막 및 막 외부 주변 공간에 효과적으로 작용하는지를 검색하는 것은 여전히 많은 노력과 비용을 수반한다(Wolf and Mascher, 2016).
본 연구에서는 인간과 동물 모두에게 중요한 인수공통 감염성 혈청형인 Enteritidis와 가금류의 주요 병원성 혈청형인 Gallinarum의 세균 막 훼손을 인지할 수 있는 바이오센서(biosensor)로서 spy유전자 전사의 활용가능성을 조사하였으며, 두 혈청형 모두에서 효용성을 확인하였다.
Spheroplast protein Y(Spy)는 138개의 아미노산을 가진 작은 주변세포질(periplasm) chaperone 단백질로서, Spy 단백질은 E. coli가 여러 자극에 의해 spheroplast가 형성될 때 세포질내에는 존재하지 않고 반드시 주변세포질 공간 내에서만 위치하는 단백질로 처음 확인되었다(Hagenmaier et al., 1997; Quan et al., 2011). Spy는 4개의 α-helix의 긴 hairpin과 같은 구조로 독특한 접힘구조를 형성함으로써, 유연성을 지니고 있기 때문에 많은 종류의 단백질의 구조 안정화에 기여할 수 있을 것으로 예상되고 있다(Quan et al., 2011). 다른 주변세포질 chaperone 단백질들과 달리, Spy발현은 E. coli와 S. Typhimurium에서 spheroplast를 형성하거나 원형질막 외부 스트레스에 의해 그 발현이 유도되는 것으로 알려졌으며, 그 유도는 세균 막 스트레스의 신호전달 역할을 하여 세균 막의 안전한 형태 유지에 필요한 많은 유전자 발현에 관여하는 이인자 신호전달체계(two component signal transduction system) 조절자들인 BaeR과 CpxR을 필요로 한다(Srivastava et al., 2014; Jeong et al., 2017). 본 연구에서는 살모넬라의 spy 유전자 프로모터 부위와 전체 유전자에 gfp(green fluorescence protein) 리포터 유전자가 각각 융합된 플라스미드를 이용하여, S. Enteritidis와 S. Gallinarum내 spy 유전자 전사의 세균 막 스트레스 인식 가능성과, BaeR과 CpxR의 조절 관계가 이 두 혈청형에서도 보존되는지 확인하고자 하였다.
재료 및 방법
본 연구에서는 인수공통 감염을 일으키는 Salmonella enterica serovar Enteritidis(S. Enteritidis)와 Salmonella enterica serovar Gallinarum(S. Gallinarum)을 사용하였고, 이 실험에 사용된 돌연변이 균주는 Table 1에 정리하였다. 균주 배양을 위한 배지로는 Luria-Bertani(LB) 영양배지를 사용하였다. 사용한 모든 균주는 모두 진탕 배양기(HST, Korea)에서 37℃, 220 rpm 조건으로 배양하여 사용하였으며, 항생제는 ampicillin(200 μg/mL, AP), chloramphenicol(20 μg/mL, CM)을 배지에 넣어 사용하였다. 본 연구에 사용한 화학제들은 따로 표기하는 경우를 제외하곤 모두 Sigma-Aldrich사(Sigma-aldrich, Korea)로부터 구입하여 사용하였다.
| Strains | Genotype | Source or references |
|---|---|---|
| FB248 | Salmonella enterica serovar Gallinarum(S. Gallinarum) WT | Cho et al., 2015 |
| FB254 | Salmonella enterica serovar Enteritidis(S. Enteritidis) WT | Sun and Hahn, 2012 |
| IB2126 | S. Gallinarum /pspy-gfp1 | This study |
| IB2129 | S. Enteritidis /pspy-gfp1 | This study |
| IB2203 | S. Gallinarum ΔcpxR :: CM /pspy-gfp1 | This study |
| IB2204 | S. Enteritidis ΔcpxR :: CM /pspy-gfp1 | This study |
| IB2205 | S. Gallinarum ΔbaeR :: CM /pspy-gfp1 | This study |
| IB2206 | S. Enteritidis ΔbaeR :: CM /pspy-gfp1 | This study |
| Plasmids | Characteristics | Source or References |
| pFPV25 | gfp fusion vector | Gift from Raphael Valdivia (Valdivia and Falkow, 1996) |
| Pspy-gfp 1 | gfp fusion containing the entire spy gene | Jeong et al., 2017 |
| Pspy-gfp 2 | gfp fusion containing the spy promoter | This study |
| DNA oligomers | Sequences (5’–3’) | |
| spy linker SacI Fw-1 | TATGAGCTCTGCTATATCATGCTGTTGTA | |
| spy linker BamHI Rev-1 | TATGGATCCAGGACGGCTATAGAATTCTCTG | |
| spy linker SacI Fw-2 | TATGAGCTCTGCTATATCATGCTGTTGTA | |
| spy linker BamHI Rev-2 | TATGGATCCTACCTTTATGCTG CATCATT | |
spy-gfp 오페론 융합 플라스미드를 만들기 위해 먼저 PCR 증폭을 통해 원하는 유전자 산물을 얻었다. PCR 증폭에 사용된 주형은 S. Typhimurium 14028s 염색체이고, 전체 살모넬라 게놈에서 spy 프로모터 부분에 해당하는 유전자를 증폭시키기 위해 제한효소 자리 염기를 붙인 spy linker SacI Forward-2 프라이머와 spy linker BamHI Reverse-2 프라이머를 사용하였다 (Table 1). i-pfu DNA 중합효소(iNtRON Biotechnology Inc, Korea)를 이용해 PCR 증폭을 시켰다. 이 PCR 산물은 spy 유전자 개시코돈의 앞쪽 326 bp와 뒤쪽 34 bp를 포함한다. 증폭된 PCR 산물은 PCR 정제키트(GeneAll Biotechnology Co. Ltd, Korea)를 사용하여 정제하였고, 프라이머 부분에 붙인 Sac I과 BamH I(NEB Inc, USA) 부위를 제한효소를 이용하여 잘라냈다. Sac I 과 BamH I 제한효소 처리를 한 pFPV25 벡터와 함께 정제키트(GeneAll) 로 정제 후 T4 DNA ligase(NEB)를 이용하여 결합시켜 E. coli DH5α에 형질전환시켰다. 형질전환된 콜로니들의 플라스미드를 분리하고, 삽입유전자의 염기서열을 확인한 후 살모넬라 균주들에 형질전환하였다.
LB 영양배지에서 하룻밤 배양한 spy-gfp 오페론 융합 플라스미드를 보유하는 S. Enteritidis와 S. Gallinarum 균주를 PBS(phosphate buffer saline, pH 7.0)에 O.D600nm=1.0 이 되도록 희석시켰다. 이들 균주 현탁액을 8 μg/mL, 6 μg/mL, 4 μg/mL, 2 μg/mL 농도의 polymyxin B가 포함되거나 포함되지 않은 LB 영양배지에 O.D600nm=0.02가 되도록 동일한 양으로 Microplate에 접종하였다. 접종된 Microplate는 Bioscreen C Microplate Reader(Oy Growth Curves Ab Ltd., Helsinki, Finland)에서 37℃의 온도에서 24시간 동안 교반하여 배양하였고, 30분 간격으로 O.D600nm 값을 측정하였다.
살모넬라균의 spheroplast 형성은 기존에 알려진 방법을 변형하여 사용하였다(Birdsell and CotaRobles, 1967). spy-gfp 융합 플라스미드를 보유하는 S. Enteritidis와 S. Gallinarum을 LB 영양배지에서 밤새 배양한 다음, 새로운 LB 영양배지에 4:1로 접종하여 37℃, 220 rpm의 진탕 배양기에서 O.D600nm=0.8이 될 때까지 배양한 후 25℃, 5,000 rpm으로 20분간 원심분리하여 상층액을 버리고 1 M Tris-HCl(pH 8.0)을 0.01M으로 희석시킨 용액으로 같은 양을 첨가하여 한번 세척시켰다. 다시 한 번 원심분리하여 상층액을 제거 후 0.5 M sucrose(Bioshop, Canada)가 포함된 Tris-buffer로 같은 양으로 첨가하여 실온에서 10분간 반응시킨 후 lysozyme(200 μg/mL)을 첨가하고 10분 반응시킨 후 Tris-HCl (10 mM, pH8.0) buffer을 1:1 비율로 첨가한 후에 20 mM의 EDTA를 처리하여 37℃에서 4시간 동안 반응시켰다. Spherolast가 형성되는 각 과정은 일부 세균을 덜어내 1% agarose 로 코팅한 후 Axioscope A1(Carl zeiss, Germany) 현미경으로 관찰하고 현미경에 연결된 CCD 카메라로 촬영하였다.
spy-gfp 융합 플라스미드를 보유하는 S. Enteritidis와 S. Gallinarum을 LB 영양배지에서 밤새 배양 한 다음, 새로운 LB 영양배지에서 1:1,000으로 희석해 접종하여 37℃, 220 rpm의 진탕 배양기에서 대수기인 O.D600nm=0.4이 될 때까지 배양한 후, 세포를 4% 에탄올(ethanol)과 각 균주에서 가장 높은 spy-gfp 유도를 보여주는 농도로 polymyxin B를 처리 후 1시간 추가로 더 배양하였다. 4% 에탄올이나 polymyxin B를 처리하기 전 배양액과 처리한 후의 배양액을 원심분리하여 PBS(phosphate buffer saline, pH 7.0)로 2번 세척 후 Black 96-well plate(SPL, Korea)에서 각 세균액(OD600nm=1.0)의 형광 강도를 DTX 880 microplate reader(485 nm excitation과 535 nm emission; Beckmna Coulter, USA)로 측정하였다.
결 과
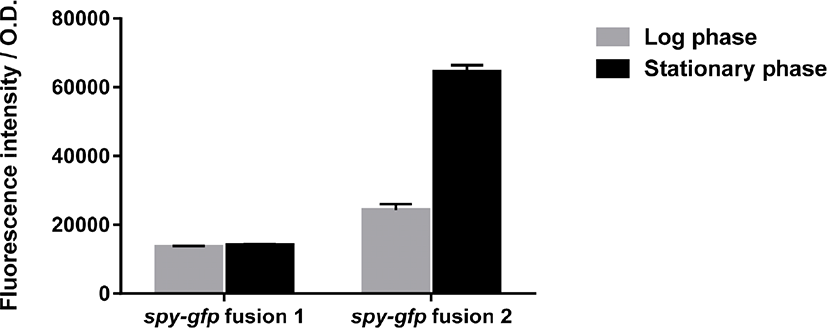
살모넬라내에서 spy 유전자 전사를 조사하기 위한 spy-gfp 오페론 융합 플라스미드를 제작하였다. 기존에 제작된 spy-gfp fusion 1은 spy 유전자의 promoter 부위와 구조유전자 전체를 포함한 반면(Jeong et al., 2017), 본 연구에서 제작된 spy-gfp fusion 2는 재료 및 방법에서 서술한 것처럼 spy 유전자의 promoter 부위만을 포함하였다. 먼저 S. Typhimurium 14028s 에 spy-gfp fusion 1, 2를 각각 형질전환시켜 이들의 대수기와 정지기에서 spy-gfp 전사의 발현량을 통한 차이를 확인 할 수 있었다. spy-gfp 1에 비해 spy-gfp 2는 균주의 대수기와 정지기 모두 발현량이 큰 것으로 확인되었다(Fig. 1). 이 결과는 S. Enteritidis와 S. Gallinarum에서도 마찬가지인 것으로 나타났으며, 이것은 이 살모넬라 형청형들 사이에 유사한 spy 유전자 전사 체계를 가지고 있음을 보여준다. spy-gfp fusion 2가 포함된 균주는 대수기와 정지기에서 모두 큰 발현량을 나타내기 때문에, 이후 세포막 스트레스에 대한 spy 유전자 전사의 유도를 관찰하기가 어려웠으며, spy-gfp fusion 1을 사용하여 이 후 연구에 사용하였다.
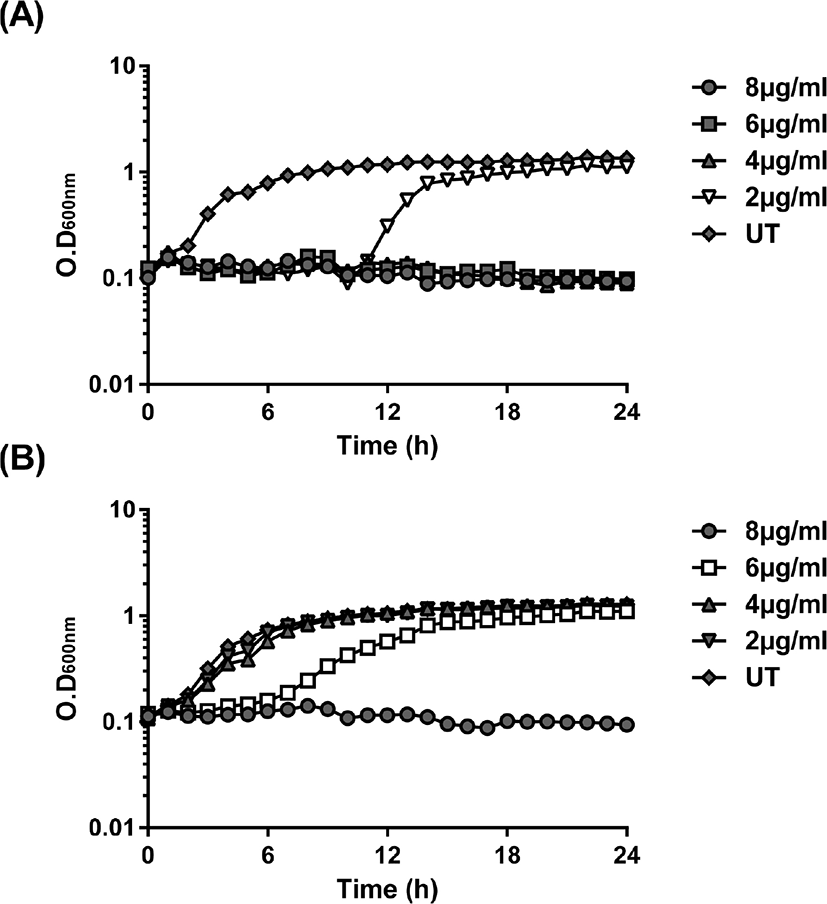
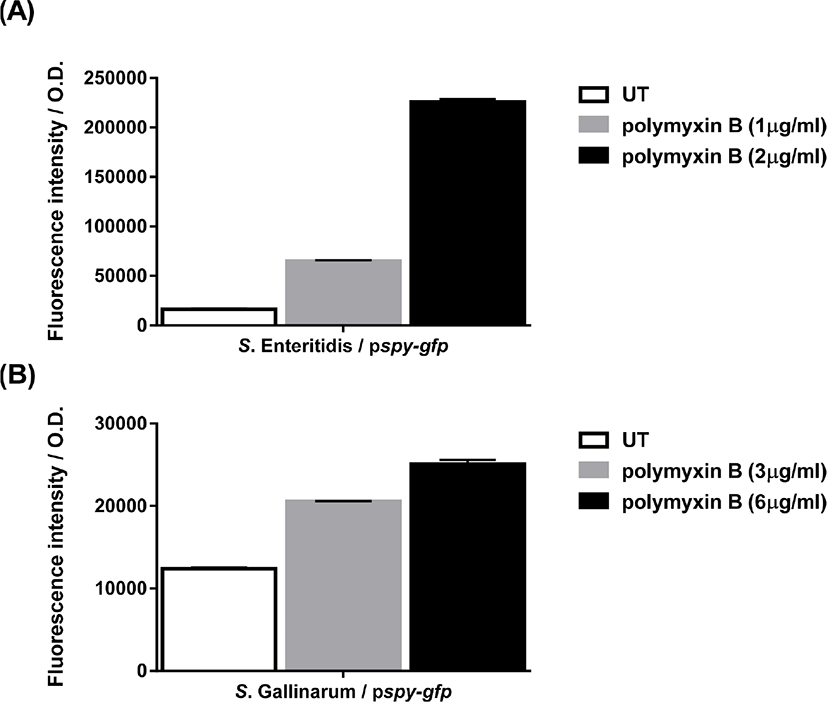
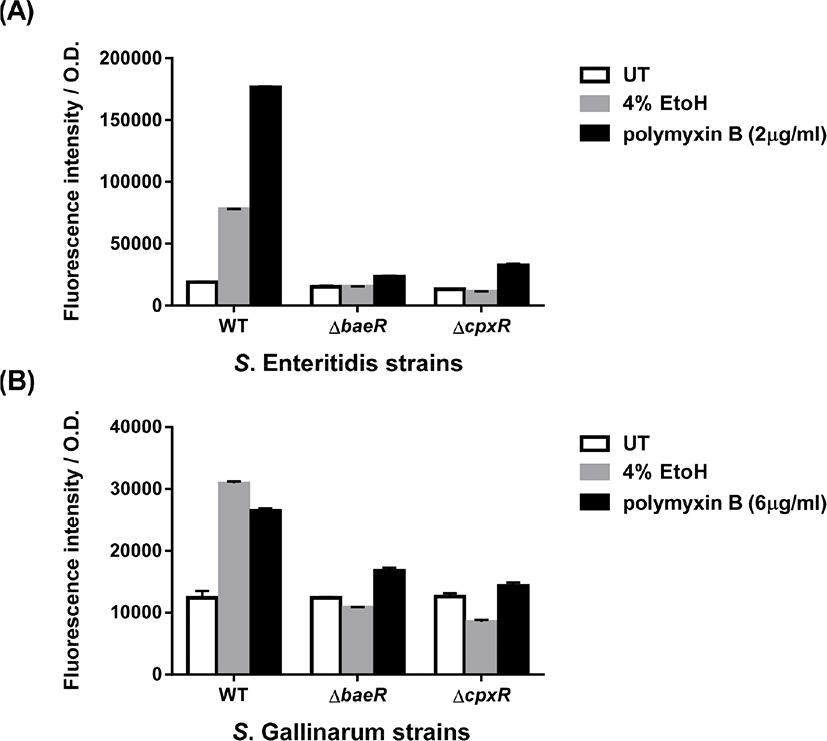
세균 막을 훼손하는 항생제인 polymyxin B에 대한 S. Enteritidis와 S. Gallinarum spy 유전자의 전사유도를 측정하기 위해 spy-gfp 오페론 융합 플라스미드를 가진 S. Enteritidis와 S. Gallinarum 균주들의 polymyxin B에 대한 감수성을 먼저 측정하였다. LB 영양배지에서 polymyxin B 를 농도 별로 처리하 여 성장 곡선을 관찰하였고, 그 결과 균주별로 성장이 지연되는 농도가 달랐다. S. Enteritidis 는 2 μg/mL에서(Fig. 2A), S. Gallinarum에서는 6 μg/mL의 농도로 처리하였을 때(Fig. 2B), 균주의 성장률이 크게 감소하는 것을 확인하였고, 더 높은 농도에서는 모든 세균의 성장이 관찰되지 않았다. 세균 성장이 지연되는 농도를 spy 유전자 전사량 측정에 사용하였다. spy-gfp 오페론 융합 플라스미드를 가진 S. Enteritidis/pspy-gfp 와 S. Gallinarum/pspy-gfp 에서 형광도를 측정한 결과, 각 LB 영양배지에서 대수기(OD600nm=0.4)까지 배양한 균주에서는 발현하지 않는 것을 확인하였고, 아무것도 처리하지 않은 균주에 비해 polymyxin B 를 처리한 균주들에서 spy-gfp의 발현이 크게 증가하는 것을 하였다(Fig. 3). S. Enteritidis의 경우 1 μg/mL 및 2 μg/mL 농도의 polymyxin B에 의해 각각 3.9배, 13.8배, S. Gallinarum의 경우 3 μg/mL 및 6 μg/mL 농도의 polymyxin B에 의해 1.6배, 2배 증가하는 것을 확인하였다.
S. Enteritidis와 S. Gallinarum균주들이 spheroplast를 형성할 때 Spy의 발현이 유도되는지 확인하기 위해 spy-gfp 오페론 융합 플라스미드를 보유하는 S. Enteritidis와 S. Gallinarum을 이용하여 spheroplast 형성시 GFP의 발현을 확인하였다. Spheroplast 형성 과정중, sucrose와 lysozyme 처리까지 하였을 때는 spheroplast가 뚜렷하게 형성되지 않았고, sucrose, lysozyme, EDTA를 모두 처리한 경우 spheroplast가 형성되었으며, 이때에 GFP 발현이 크게 증가하는 것을 확인할 수 있었다(Fig. 4A와 Fig. 5A). 하지만, sucrose와 lysozyme 및 EDTA를 각각 처리했을 때는 GFP의 발현을 볼 수 없었다(data not shown). 이 결과는 sucrose에 의한 삼투압에 대한 노출, lysozyme에 의한 펩티도글리칸의 용해, 그리고 EDTA에 의한 세포막의 약화를 통한 순차적 spheroplast형성이 완성될 때만 S. Enteritidis와 S. Gallinarum에서 spy 전사가 유도될 수 있음을 보여준다.
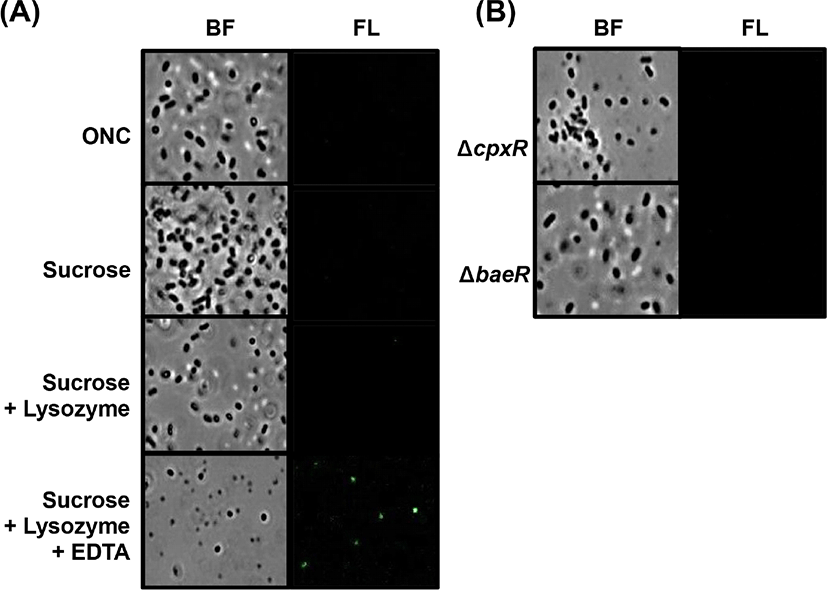
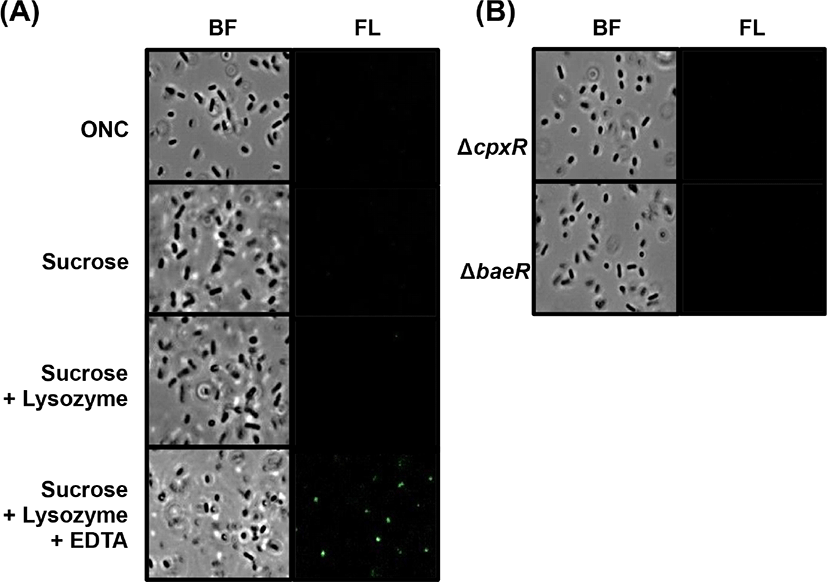
E. coli 와 S. Typhimurium의 spy 유전자 전사 유도는 이인자 신호전달 체계인 CpxRA와 BaeSR에 의해서 조절이 되는 것으로 알려졌다(Bury-Mone et al., 2009; Jeong et al., 2017), S. Enteritidis와 S. Gallinarum에서도 이들 체계가 관련되는지 확인하였다. 두 혈청형 모두 cpxR 과 baeR 이 결손된 돌연변이 균주에 polymyxin B를 처리했을 때 대조군(WT)에 비해서 spy-gfp 발현이 거의 되지 않는 것을 확인하였다(Fig. 6). 이 실험에서는 세균 막에 스트레스를 주는 두 번째 요인으로 4% 에탄올을 처리하여 S. Enteritidis와 S. Gallinarum에서 spy 전사가 증가하는 것을 확인하였고, 이 전사 유도는 cpxR 과 baeR 이 결손된 돌연변이 균주들에서 일어나지 않았다. 또한, cpxR 과 baeR 이 결손된 돌연변이 균주들의 spheroplast 형성과정에서도 spy 유전자 전사 유도는 관찰되지 않았다(Fig. 4B 와 Fig. 5B). 이 결과들은 polymyxin B와 에탄올 등의 세균 막 훼손 요인과 spheroplast 형성과정 동안 생기는 막 스트레스들에 인해 S. Enteritidis와 S. Gallinarum 의 spy 유전자 발현이 크게 증가하고, 이 유도과정에 CpxR과 BaeR의 역할이 필수적임을 보여준다.
고 찰
본 연구에서는 낙농업 및 유가공 제품생산과 유통에서 주요한 살모넬라 감염원으로 작용하는 혈청형들 중 S. Enteritidis 과 S. Gallinarum의 Spy 발현과정중 spy 유전자 전사의 유도에 있어, 막 스트레스의 필요성 및 유전자 전사 유도에 참여하는 조절 단백질의 필요성을 처음으로 확인하였다. spy 유전자 전사의 유도를 확인하기 위해 제조한 spy-gfp 융합체들 중 promoter 부위만을 포함한 것은 promoter뿐 아니라, spy 구조유전자 전체를 포함한 것에 비해서 대수기와 정지기에서 모두 발현량이 크게 나타나는 것으로 나타났다(Fig 1). 이 결과는 spy 유전자 전사 유도과정에 있어서 E. coli 에서 알려진 Cpx와 Bae시스템 이외에 다른 조절 인자의 존재가능성을 시사하지만, 후속연구를 통해 밝혀야 할 것으로 생각된다. 본 연구에서는 GFP 발현량을 모니터함으로써 보다 손 쉽게 S. Enteritidis 과 S. Gallinarum의 막 스트레스-특이적 신호를 인식할 수 있는 바이오센서의 목적으로써 spy-gfp 융합 플라스미드를 활용하고자 하였다. 때문에 spy 유전자 전체를 포함하는 gfp 융합체의 막 스트레스 반응 능력의 발견은 의미가 크다고 볼 수 있다.
E. coli 에서 처음 발견된 주변세포질내로의 Spy 단백질의 발현현상은 이 단백질의 chaperone 기능의 발견으로 더욱 주목 받고 있다(Hagenmaier et al., 1997; Quan et al., 2011). 대부분 세균들은 단백질의 활성을 복구할 수 있는 chaperone 단백질들을 생산하는데, 보통 이 단백질들은 세균이 스트레스에 노출되었을 때 세포질내에서 발현이 크게 증가하여 세포질내 변성된 단백질의 복구에 기여하고, 세균 병원성 발현에도 중요한 역할을 한다(Henderson et al., 2006). 주변세포질 공간내에서 발현하는 chaperone 단백질들 또한 숙주 세포 내의 다양한 환경에서 세균의 세포 외부 및 숙주 세포내로 병원성 효과 단백질(effector protein)을 분비하는 과정을 돕고 병원성 발현을 증진시킨다(Burkinshaw and Strynadka, 2014). 하지만, 이 경우는 주변세포질내 특정 분비 체계의 확립을 위한 단백질들에 한정되어서 기능을 한다. 이들 외에 LolA, SurA, Skp, DegP 등의 chaperone 단백질이 주변세포질내 단백질들의 구조 안정화에 기여하는 것으로 알려졌는데, 수선이나 복구할 수 있는 대상 단백질들의 종류가 비교적 제한적이어서, 이들은 세균 병원성 발현에서 그 역할이 미미한 것으로 알려졌다(Rowley et al., 2006). 하지만 단백질 구조 연구를 통해 확인한 Spy는 광범위한 기질 단백질들의 구조 안정화에 기여할 가능성이 클 것으로 예상된다. 실제로, E. coli 의 필수 외막 단백질인 LptD는 Skp와 FkpA chaperone 단백질들에 의해서 특이적으로 그 구조가 안정되는 것으로 알려졌는데, skp와 fkpA가 결손된 균주에서도 Spy가 LptD의 기능적인 구조를 복원하는 데 충분하게 작용하는 것으로 보고되었다(Goemans et al., 2014). 현재까지 병원성세균의 병독성 발현에 Spy의 역할이 보고되지 않고 있으나, 보통 E. coli가 생산하는 단백질중 약 20% 정도가 주변세포질에 위치하고, 넓은 범위의 기질 단백질들을 수선할 것으로 예상되는 Spy의 발현이 세균 막 스트레스에 특이적으로 유도된다는 점을 상기하면, 세균 병독성에서 Spy의 역할이 작지 않을 것으로 예상할 수 있다.
이러한 이유로 본 연구에서 살모넬라의 막 스트레스 인식을 위해 선택하고 확인한 살모넬라균의 spy 전사 유도현상의 발견은 그 중요성이 작지 않다고 할 수 있다. 실제로 spy-gfp 발현은 살모넬라균에 처리된 polymyxin B의 양에 비례하여 증가하였으며(Fig. 3), spheroplast 형성시에도 모든 스트레스가 귀결되는 마지막 과정에서 발현이 크게 유도되는 것을 볼 수 있다(Fig. 4와 Fig. 5). 따라서 이 결과들은 S. Enteritidis와 S. Gallinarum의 막 스트레스 정도를 분석하는데 있어서, 본 연구에서 사용한 spy-gfp 오페론 융합 플라스미드가 유용하게 사용될 수 있음을 시사한다.
E. coli 와 S. Typhimurium에서 Spy의 발현은 Cpx과 Bae 두 가지 스트레스 반응 시스템에 의해 전사적으로 유도되는 것으로 알려졌는데(Srivastava et al., 2014; Jeong et al., 2017), S. Enteritidis와 S. Gallinarum에서도 이 두 시스템이 spy 전사 유도에 필요한 것으로 확인되었다(Fig. 4~Fig. 6). 다만 S. Gallinarum의 경우 cpxR 과 baeR 의 결손 돌연변이 균주에서도 polymyxin B에 대한 spy 의 유전자 전사가 일정 부분 남아 있었다(Fig. 6). 이는 아마도 S. Gallinarum의 polymyxin B 반응성의 차이로 판단되며, 더 정교한 조절 시스템의 존재가능성 또한 배제할 수 없다.
병원성 세균의 막 스트레스에 대한 적응이나 내성에 참여하는 유전자들은 많이 존재하고, 이들의 발현은 전사단계에서 유도된다. 이들의 전사 유도는 Cpx와 Bae 및 세포막외부 기능(extracytoplasmic function)의 시그마 인자인 RpoE의 세가지 전사 조절 체계들이 주도하는 것으로 알려졌다(Rowley et al., 2006). E. coli 의 Cpx와 Bae 시스템은 막 스트레스를 감지하는 히스티딘 인산화 효소로 작용하는 내막 단백질인 BaeS와 CpxA가 막 스트레스에 의해 활성화 되어 인산화되고, 그들의 인산기를 반응 조절 인자 BaeR 및 CpxR로 각각 전달하여 고유의 표적 유전자들의 전사를 활성화시킨다. CpxAR은 세균의 막 스트레스를 받을 때, BaeSR은 구리(Cu), 아연(Zn) 등과 같은 금속 이온스트레스에 의한 막 스트레스로 활성화 된다. RpoE 는 세포질막에 위치하는 RseA 단백질에 붙잡혀 있는 상태로 존재하다가, 세포질막 외부의 변성된 단백질들의 증가에 의해 DegS와 RseP 두 세포질막 단백분해효소에 의해 RseA 가 분해됨으로써 세포질내로 이동하여 표적 유전자들의 전사를 활성화시킨다. 본 연구에서는 cpxR 과 baeR 결손 돌연변이는 성공적으로 제조하였으나, rpoE 돌연변이를 제조하지 못하였다. 하지만, S. Typhimurium을 이용한 이전 연구에서 rpoE 돌연변이가 spy 전사를 오히려 증가시켰는데, 이는 rpoE 돌연변이에 의해 더욱 증가된 막 스트레스에 의한 것으로 판단되었고, Cpx와 Bae 체계와는 달리 spy 전사 유도과정에 직접적인 영향을 주지 않는 것으로 확인되었다(Jeong et al., 2017).
병원성 세균의 막 스트레스 적응반응을 크게 조절하는 Cpx와 Bae 체계 모두 S. Enteritidis와 S. Gallinarum의 spy 전사 유도에 필요하다는 발견은 두 혈청형의 막 스트레스 적응반응 또한 두 체계에 크게 의존함을 보여준다. 또한, 이 결과는 Spy의 발현과 역할이 두 체계가 모두 활성화될 정도의 세균 막 훼손이 필요함을 시사하며, 이때 spy-gfp 오페론 융합 플라스미드는 그 정도를 파악하는데 크게 유용할 것으로 사료된다.






