서론
여성호르몬인 에스트로겐과 유사한 구조를 갖는 물질로는 식물성 성분과 화학적 합성품이 있다. 의학적으로 많이 사용하는 화학합성품인 여성호르몬을 이용한 치료는 유방암 등의 위험률을 증가시킬 수 있으며, 장기간 사용 시 자궁암, 혈전혈관질환, 고혈압, 담낭질환 등을 증가시킬 수 있다(Lee, 1995; Rosen and Bilezikian, 1997). 그렇기 때문에 에스트로겐 요법의 대체를 위하여 에스트로겐과 유사한 구조를 가진 식물성 에스트로겐에 대한 관심이 고조되고 있다.
식물성 에스트로겐은 화학적 구조와 생체 합성 측면에서 리그난(lignan), 플라보노이드(flavonoid), 칼콘(chalcone), 스틸베노이드(stilbenoids) 등의 그룹으로 분류된다(Murkies et al., 1998; Krebs et al., 2004; Sirotkin and Harrath, 2014). 이 중 리그난(lignans)은 식물에 들어 있는 페놀성 화합물로 비영양성이며 칼로리가 없고, 식물성 에스트로겐(phytoestrogens)으로 인체에서 구조적, 기능적으로 에스트로겐과 유사한 활성을 갖는다. 주요 함유식품으로는 콩, 아마씨 등의 다양한 종자류와 과일, 채소, 차, 초콜릿 등에서 고농도로 발견된다(Adlercreutz et al., 1992; Cederroth et al., 2010; Peterson et al., 2010). 리그난은 다른 식물성 에스트로겐보다 상대적으로 약한 에스트로겐성을 지니고 있지만, 여성호르몬인 에스트로겐과 비슷한 구조를 가진 유효성분으로 체내에서 에스트로겐 수용체와 결합해 에스트로겐의 효능을 내는 것으로 알려져 있으며, 여성 갱년기 증상 완화와 더불어 심혈관계질환 예방 및 암 등 만성퇴행성질환을 예방한다는 다양한 연구결과들이 발표되었다(Cornwell et al., 2004; Penttinen et al., 2007; Lee et al., 2016). 또한 리그난은 화학적 호르몬 치료 시 나타날 수 있는 부작용이 적은 것으로 기대되며, 여성호르몬 대체제로 이용가능성 연구가 진행되고 있다(Cornwell et al., 2004; Penttinen et al., 2007). 그밖에 생체 내에서의 생리활성과 질병 예방에 대한 많은 연구가 진행되어 고지혈증 완화, 체내에서 간의 해독 작용 촉진, 과산화지질의 생성억제, LDL-콜레스테롤의 산화억제, 장내 콜레스테롤의 흡수억제, 골 손실의 억제 및 골절 예방의 효과 등이 증명되었다(Hirata et al., 1996; Adlercreutz and Mazur, 1997; Setchell KD, 1998; Kang et al., 1998; Kang et al., 1999; Ewies, 2002; Levis et al., 2010).
이에 본 연구에서는 현재까지 알려진 식물성 에스트로겐 중 대표물질인 리그난의 화학적 특성 및 대사를 파악하고, 인체 내 건강과의 관계를 고찰함으로써 향후 연구에 대한 기초자료를 제공하기 위해 수행하였다.
연구 방법
본 연구는 Shin과 Kwun(2016)이 제시한 순서에 따라 리그난의 특성 등과 관련 연구에 대해 총설(systematic review)을 작성하였다. 작성단계는 다음과 같이 나누었다. 1단계는 리그난의 화학적 특성과 함께 함유되어 있는 식품과 다양한 질병과의 관련성에 대한 내용을 계획하였다. 2단계는 다양한 방법으로 문헌조사를 실시하였다. 3단계는 선정된 문헌을 연구적 배경을 바탕으로 제시하였다. 4단계는 본 논문에서 설명하고자 했던 내용에 대해 분석된 데이터를 통해 객관적으로 해석하고 결론을 유추하였다.
본 문헌의 검색과 결과의 정리 기간은 2017년 5월 1일부터 2018년 2월 28일까지 이루어졌으며, 문헌 검색은 database로서 Pubmed와 국내 각각의 학회 사이트를 활용하였다(Shin and Kwun, 2016). 문헌 검색의 검색어로는 ‘Lignans’ 및 그와 관련된 용어들을 사용하였으며, 총 120편 이상을 선정하여 그 중 최근 발표된 80여 편의 논문과 데이터베이스를 가지고 총설을 작성하였다.
본론
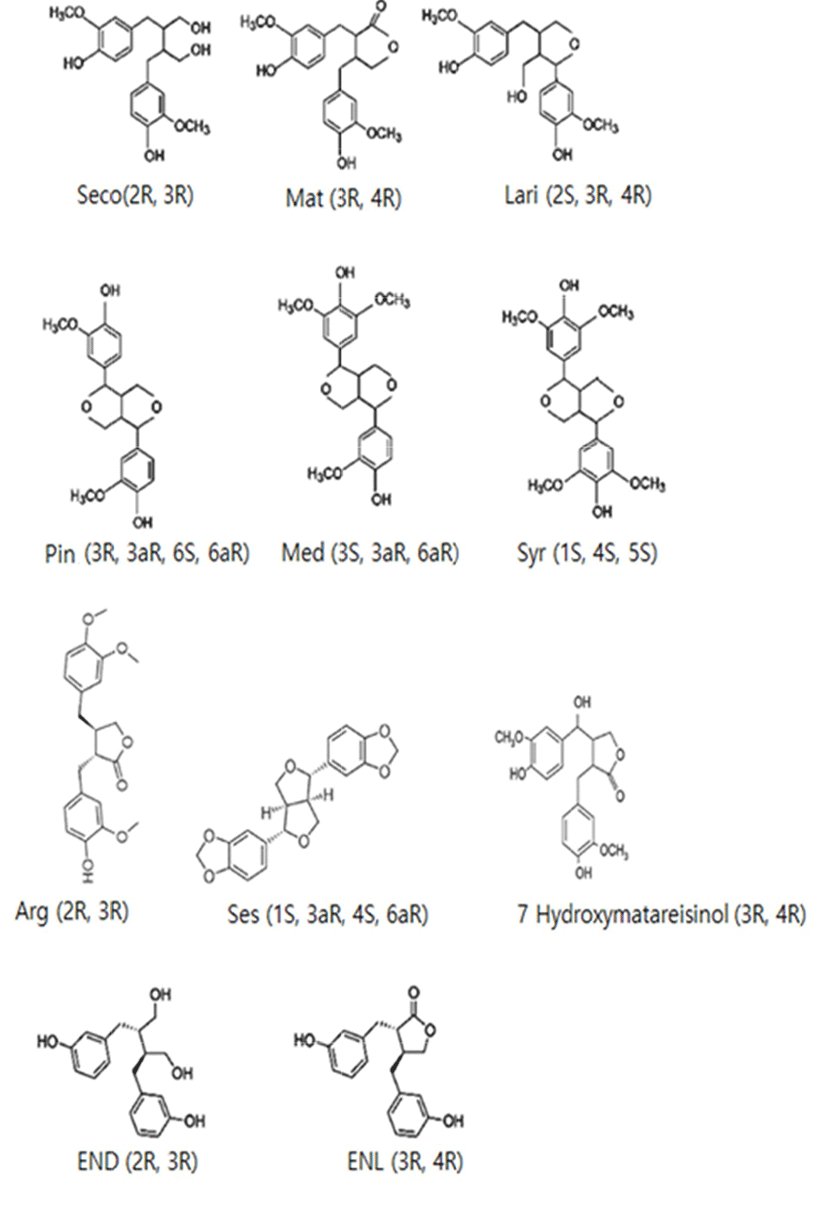
리그난은 diphenolic 구조를 가진 식물성 화합물로 자연계에 secoisolariciresinol(Seco), matairesinol(Mat), pinoresinol(Pin), medioresinol(Med), lariciresinol(Lari), syringaresinol (Syr), sesamin(Ses), 7′-hydroxymatairesinol, Isolariciresinol 등의 형태로 널리 퍼져 있다. 다양한 리그난의 구조는 Fig. 1에 제시하였다. 이렇게 다양한 구조를 하고 있는 식물성 리그난의 흡수와 생체 전환은 사람마다 크게 다르다. 식물에 함유되어 있는 리그난은 아글리콘(aglycones)과 글리코시드(glycosides) 형태로 존재하고 있다. 아글리콘과 글리코시드는 장내 박테리아로 인해 deglycosylation, demethylation, dehydroxylation 및 dehydrogenation와 같은 가수분해 반응에 의해 당과 리그난으로 분해되어 enterolignans를 형성한다(Smeds et al., 2007). 또한, 리그난은 대부분 식품에서 secoisolariciresinol(Seco)과 matairesinol(Mat) 형태로 존재하며, 섭취 후 장내 미생물균총에 의해 각각 동물성 리그난인 enterodiol(END)과 enterolactone(ENL)으로 전환되어진 후 쉽게 흡수될 수 있고, 에스트로겐 활성이 나타난다(Park, 2007). 이 동물성 리그난인 END와 ENL은 에스트로겐 수용체에 결합할 수 있으며, 에스트로겐 효과의 약 1/10,000∼1/100,000에 해당하는 호르몬성 물질이다(Adlercreutz and Mazur, 1997). 또한 enterolignans는 정상조직과 종양에서 호르몬 상태에 영향을 미칠 수 있다(Landete, 2012).
장내에서 식물성 리그난이 동물성 리그난으로 생물전환(biotransformation)되는 과정을 알아보기 위하여 회장조형술(Ileostomy)을 받은 환자들을 대상으로 연구한 선행연구(Pettersson et al., 1996; Hallmans et al., 1997)에서는 호밀의 식물성 리그난인 SECO와 MAT를 섭취시킨 결과, 동물성 리그난인 END와 ENL의 농도가 오히려 낮아졌는데, 그 이유는 식물성 리그난이 동물성 리그난으로 완전한 생물전환을 하기 위해서는 장관 내에 적절한 박테리아가 존재하고, 모든 효소활동을 포함한 발효과정이 필수적으로 필요하기 때문이라고 보고하였다.
사람이 식품을 통해 섭취한 리그난이 소화기관을 통해 흡수되어 표적기관에 직접적인 영향을 미치는 섭취량에 대해서는 아직 정확하게 밝혀지지 않았으나, Atkinson 등(1993)은 아마인 13.5 g을 6주 동안 섭취한 결과, 혈장에서 END와 ENL이 μmol 농도 수준으로 추출되었다는 연구결과를 발표하였고, 이 농도는 혈장 내 에스트로겐 수준의 1,000∼10,000배로 높은 수준이라고 제시하였다. 또한, 식이를 통한 리그난의 섭취는 다양한 조건에서 유방암, 대장암, 전립선암 및 탈모 등의 예방효과를 가져올 수 있다고 보고하였다(Clavel et al., 2005).
위장관에서의 다양한 신진대사 차이로 인하여 리그난의 섭취량에 따라 체내에 미치는 영향과 직접적인 노출량은 불완전하지만, 다양한 분석을 통하여 식품 내에 포함되어 있는 리그난의 양을 파악할 수 있다. 리그난은 전곡물과 종자류에 주로 많이 함유되어 있는데, 특히 참깨에 373 mg/100 g과 아마 종자에 335 mg/100 g으로 높은 수준 함유되어 있다(Penalvo et al., 2005; Landete, 2012). 대표적인 리그난 함유식품은 Table 1에 제시하였다. 전곡물이나 종자류보다 리그난이 적은 양 함유되어 있는 식물성 식품으로 아스파라거스, 포도, 키위, 레몬, 오렌지, 파인애플 및 포도주, 커피, 차 및 귀리우유 등이 있으며, 그 함유량은 일반적으로 100 g당 2 mg을 초과하지 않는다(Milder et al., 2005; Penalvo et al., 2008; Kuhnle et al., 2009). 반면, 동물성 식품에는 리그난이 거의 함유되어 있지 않다(Penalvo et al., 2008). Horn-Ross PL 등(2006)의 연구 결과, 서양식 식단일 경우 리그난 섭취량은 하루 평균 1 mg을 초과하지 않는 것으로 나타났고, 하루 평균 섭취 추정량은 약 150 μg으로 굉장히 적다고 보고하였다.
| Food | Total μg per 100 g | Seco | Mat | Lar | Pino | Med | Syr | Reference |
|---|---|---|---|---|---|---|---|---|
| Sesame seed | 39,348 | 66 | 481 | 9470 | 29331 | * | Milder et al., 2005 | |
| Flax seed | 301,129 | 294210 | 553 | 3041 | 3324 | Milder et al., 2005 | ||
| Wheat | 539 | 35 | 3 | 62 | 37 | 30 | 372 | Adlercreutz and Mazur, 1997 |
| Rye | 1,891 | 38 | 27 | 324 | 381 | 127 | 973 | Kuhnle et al., 2009, Penalvo et al., 2008 |
| Asparagus | 1,034 | 743 | 14 | 92 | 122 | 3 | 58 | Penalvo et al., 2008 |
| Grapes | 126 | 32 | 37 | 28 | 8 | 21 | Kuhnle et al., 2009, Penalvo et al., 2008 | |
| Kiwi | 147 | 116 | 10 | 8 | 5 | 8 | Kuhnle et al., 2009, Penalvo et al., 2008 | |
| Lemon | 335 | 4 | 25 | 185 | 64 | 57 | Kuhnle et al., 2009, Penalvo et al., 2008 | |
| Oranges | 122 | 11 | 19 | 9 | 6 | 77 | Kuhnle et al., 2009, Penalvo et al., 2008 | |
| Pineapple | 172 | 7 | 10 | 67 | 4 | 3 | 81 | Kuhnle et al., 2009, Penalvo et al., 2008 |
| Wine(Italy, red) | 1,378 | 1,280 | 98 | Kuhnle et al., 2009, Penalvo et al., 2008 | ||||
| Coffee | 18.7∼31.3 | 9.4∼16.1 | 0.0∼0.7 | 9.0∼13.1 | 0.4∼1.5 | Milder et al., 2005 | ||
| Tea, black | 63.6∼77.1 | Milder et al., 2005 |
2003년도에 핀란드인들을 대상으로 리그난 섭취량을 연구한 결과, 하루에 평균 434 μg을 섭취하고 있고(Valsta et al., 2003), 2005년도에 네덜란드인들의 리그난 평균 섭취량은 979 μg/day(Milder et al., 2005), 스웨덴에서는 여성을 대상으로 리그난 섭취량을 파악하였는데, 그 결과 하루 평균 1,632 μg을 섭취하고 있다고 보고하였다(Hedelin et al., 2008). 그러나 아직까지 우리나라에서는 리그난 섭취량에 대한 연구가 매우 부족한 실정이며, 다양한 방면의 역학조사를 바탕으로 정확한 연구가 필요하다고 사료된다.
Brooks 등(2004)의 연구에 의하면 아마씨를 섭취시키고 생리주기 및 성호르몬 수준을 관찰하였는데, 리그난의 섭취가 많을수록 소변의 에스트로겐 대사산물이 많이 배설되어, 리그난과 호르몬 활성은 연관이 있었다. 또한 ENL은 에스트로겐 합성효소 저해제를 약화시키고, 테스토스테론(testosterone)과 테스토스테론 전구체인 안드로스테네디온(androstenedione)을 억제시켰다(Adlercreutz et al., 1993). 이와 같은 결과에 의해 리그난은 에스트로겐과 유사한 구조를 가지고 있어 에스트로겐의 역할뿐만 아니라, 남성호르몬의 감소와 에스트로겐의 합성 증가를 가져와 폐경기 여성들의 갱년기 증상 완화에도 도움을 줄 수 있을 것으로 사료된다.
리그난의 항산화 작용은 장내 미생물 균총에 따라 전환된 END와 ENL과 관련성이 가장 큰 것으로 나타났다(Landete, 2012). Prasad(2000)의 항산화 연구에서는 영양소 중 대표 항산화 영양소인 vitamin E와 리그난 SDG, Seco, END, ENL와 항산화 작용을 분석한 결과, Seco와 END에서 가장 높았고, 비타민 E가 가장 낮았다고 보고하였다.
아마씨로부터 추출한 리그난의 항산화 작용은 자유 라디칼을 형성하여 산화스트레스를 증가시키는 2,2'-Azobis(2-amidinopropane) dihydrochloride(AAPH)의 작용을 저하시키면서 산화작용으로부터 보호하는 것으로 알려져 있다(Hosseinian et al., 2006). 참깨에 리그난 배당체인 세사미놀 배당체는 생체막 등의 산화적 장해를 방어하며, α-토코페롤의 상승작용을 하여 노화억제 효과를 나타낸다(Ryu SN et al., 2003). 또한, 식물성 리그난 Seco, SDG과 동물성 리그난 END, ENL 모두 강한 항산화 작용을 하여 고콜레스테롤혈증과 더불어 죽상동맥경화증 및 고혈당을 줄일 수 있다고 보고되었다(Landete, 2012).
리그난은 선행연구(Park, 2007)에서 고콜레스테롤 식이에 의한 내피 의존성 혈관 이완을 개선하는 것으로 밝혀졌으며, 리그난 섭취를 통한 심혈관계 보호작용은 강력한 항죽상동맥경화기능(antiatherogenic potential)에 의한 것이다. 이 기전에 의해 심장 및 뇌졸중 등 혈관질환을 예방하는 효과를 나타낼 수 있다(Dupasquier et al., 2006).
특정 식품의 과도한 섭취 및 운동 부족, 알코올 섭취와 더불어 49∼51세 전후 여성은 폐경과 함께 갱년기가 시작되어 신체조직의 노화(Kim and Kim, 2005)와 함께 난소 기능 저하로 에스트로겐의 분비가 감소함으로써 발생하는 신체변화로 인해 혈중 LDL-콜레스테롤이 증가하여 심혈관계질환의 발생빈도가 증가한다(Kim et al., 2010). 또한, 폐경이나 난소 절제 시 나타나는 에스트로겐 감소에 의해 HDL-콜레스테롤(high density lipoprotein cholesterol)과 apolipoprotein A-Ⅰ는 감소하고, LDL-콜레스테롤(low density lipoprotein cholesterol)은 증가를 초래한다(Li et al., 2000). 이처럼 노화에 따른 호르몬 변화로 나타나는 갱년기 증상인 홍조, 발한 등과 심혈관계질환 및 골다공증의 예방에 효과가 있다고 보고된 합성 에스트로겐을 함유하는 호르몬 보충요법(hormone replacement therapy, HRT)은 많은 부작용을 나타내는데, 특히 유방암의 발병 위험이 증가할 수 있다는 연구(Belchetz, 1994; Rossouw, 2002)가 보고되었으며, 또한 치료 전과 후 혈중의 중성지방이 상승하고, 이로 인해 심혈관계질환의 발병을 증가시킨다는 연구(Levine et al., 1995) 등이 보고된 바 있다. 이와 같은 부작용들로 인하여 합성 호르몬을 이용한 치료법에 대해 부정적인 인식이 높아지고 있다. 그에 따라 새로운 치료법에 대한 연구의 필요성이 증가하고 있으며, 대표적인 항산화 물질인 γ-tocopherol의 항산화 활성을 상승시켜 주며(Kang et al., 1998), 에스트로겐과 유사한 작용을 하는 리그난에 대한 연구가 다양한 방면으로 진행되고 있다.
Cornish 등(2009)은 randomized double blind placebo-controlled 실험으로 92명의 건강한 노년층 환자에게 6개월간 규칙적인 운동과 함께 리그난 보충제(543 mg secoisolariciresinol diglucoside (187 mg secoisolariciresinol))를 투여한 결과, 보충제를 섭취한 그룹에서 이완기 혈압이 유의하게 감소한 것을 확인할 수 있었다. 그리고 일본에서 4주 동안 고혈압이 있는 중년 남녀를 대상으로 진행한 double blind crossover placebo controlled 연구 결과, 하루에 세사민 60 mg(180 mg 밀배아유)을 투여하였을 때, 이완기 혈압 1.9 mmHg와 수축기 혈압 3.9 mmHg이 감소하였다고 보고하였다(Miyawaki et al., 2009). 또한 6주 동안 22명의 덴마크 폐경기 여성에게 매일 500 mg secoisolariciresinol diglucoside(secoisolariciresinol 172 mg)을 투여한 결과, 총콜레스테롤, LDL-콜레스테롤 및 중성지방 모두 투여한 그룹에서 감소하였다고 보고하였다. 중국에서 실시한 8주 동안 1일 600 mg(약 206 mg secoisolariciresinol)의 secoisolariciresinol diglucoside를 투여한 결과, LDL-콜레스테롤이 감소하였다고 보고하였다(Hallund et al., 2006; Zhang et al., 2008).
네덜란드 여성을 대상으로 6.25년 동안 추적 관찰한 연구결과, 하루 약 1,100 μg의 리그난 (matairesinol 및 secoisolariciresinol) 섭취는 심혈관계질환의 위험과 관련이 없는 것으로 나타났으며, 리그난 섭취량이 증가하면 심혈관계 위험도는 낮아진 반면에, 흡연자들의 경우 심혈관계 위험도는 증가하였다고 보고하였다(van der Schouw et al., 2005). 이와 같이 다양한 신진대사와 생활습관 임에도 리그난의 섭취는 혈중 콜레스테롤 수치를 낮추는데 긍정적인 결과가 있다는 것을 확인할 수 있었다. 이러한 결과는 향후 심혈관계질환 임상 식이에 있어서 리그난의 첨가가 좋은 재료가 될 것으로 사료된다.
암의 발병은 다양한 요인에 영향을 받으며, 그 중 40∼60%는 식이와 관련이 깊은 것으로 많은 선행연구 결과에서 밝혀졌다(Doll and Peto, 1981). 이에 기초하여 최근 식생활과 연관된 암의 원인물질을 밝히는 연구가 활발히 진행되고 있을 뿐만 아니라, 일상에서 섭취하는 식품 중에서 항암을 소유한 물질들의 개발에 대한 연구도 다양하게 이루어지고 있다(Miyazak and Nishijima, 1981). 그 중 콩이나 종자류 식품에 함유된 리그난, 제니스테인 등 아이소플라본 화합물이 에스트로겐에 대한 길항작용을 통한 유방암 예방효과가 있다는 것으로 나타났고(Constantinou et al., 1998; Dixon- Shanies and Shaikh, 1999), 특히 제니스테인은 tyrosin kinase 등의 효소 활성을 억제해 암세포의 성장 촉진과 밀접한 관련을 가진다는 것이 밝혀졌다(Huang et al., 1992).
아마씨에서 추출한 리그난을 발암물질 처리해 암을 유발시킨 쥐에게 투여한 결과, 유방종양 크기를 50% 이하로 감소시켰으며, 종양 수를 37% 감소시키는 것으로 나타났다(Thompson et al., 1996). Wada-Hiraike 등(2006)의 연구에서는 동물성 리그난인 ENL은 결장벽에서 흡수되어 전신을 순환하면서 결장암을 예방하는 것으로 밝혀졌다. 덴마크 중년 남성과 여성을 대상으로 식이요법과 생활습관을 연구한 결과, 혈장 내 enterolignan의 농도가 높을수록 결장암, 직장암, 대장암 발병 위험이 감소하는 것으로 나타났다(Kuijsten et al., 2006). 동물성 리그난인 ENL은 신호전달 조절제 기능을 하는 것으로 밝혀졌고, 이러한 기능으로 인해 항에스트로겐 작용을 하여 유방암의 성장을 억제하거나 지연시키는 것으로 나타났다(Saarinen et al., 2007). Touilland 등(2007)이 폐경기 프랑스 여성을 대상으로 한 연구에서는 리그난 섭취에 따른 유방암 유병률을 분석한 결과, 리그난 섭취가 많을수록 유방암 발병 위험도는 감소하는 것으로 나타났으며, 이는 리그난 섭취에 따른 유방암 예방에 관한 메타분석 결과와 동일한 결과임을 확인할 수 있었다(Touilland et al., 2007; Buck et al., 2010). 전 세계적으로 역학 연구에 의하면, 유방암의 발병률은 채식을 많이 하는 국가에서 낮았고, 체내 리그난의 농도는 일반여성에 비해 유방암 환자에게서 유의하게 낮은 연구결과도 보고되었다(Block et al., 1992).
이와 같이 리그난의 항암능이 제시되고 있으나, 항암효능 기전에 관한 연구가 미흡하여 추가적으로 지속적인 연구가 이루어져야 할 것으로 사료된다.
골 질환 중 골다공증은 나이가 들면서 진행하는 양상을 보이며, 척추와 대퇴골의 골다공증은 2차 질환인 골절을 유발할 수 있다. 뼈 조직은 칼슘과 같은 무기질을 지속적으로 흡수하고 새롭게 생성하며, 재조합하는 조직으로 골 흡수를 야기하는 파골세포와 골 생성 기능을 가진 조골세포 간의 균형이 중요하다(Rodan and Martin, 2000). 이 파골세포와 조골세포의 균형이 깨져 파골세포의 기능이 비정상적으로 항진된 경우, 골 파괴 속도가 빨라져 골다공증이 야기되며, 이러한 현상은 류마티스 관절염 같은 염증성 질환의 골 소실과 밀접한 연관성이 있다(Delmas, 2005). 조골세포 또는 활성화된 면역세포로부터 생성되는 RANKL(receptor activator of nuclear fractor-κB ligand)은 파골세포 및 전구세포에 위치한 수용체(RANK)와 결합하여 파골세포의 형성과 활성을 촉진시킨다. 체내 호르몬 변화로 인한 골 흡수의 자극 원인(에스트로겐 결핍, 부갑상선 호르몬 항진증 등)이 발생하게 되면, 이 RANKL과 생체 내 길항제인 Osteoprotegerin(OPG)의 균형이 깨져 파골세포의 활성이 증가되는 것이다(McClung, 2007). 활성화된 파골세포는 골 단백 용해제 중 하나인 카텝신 K(cathepsin K)가 특이적으로 생성되고, 칼시토닌 수용체(calcitonin receptor, Cal-R)와 TRAP(tartrate resistant acid phosphate)가 존재하며, 실제적으로 골 흡수 작용에 관여한다(Boyle et al., 2003). 골질환을 예방하려면 이들 골 단백 용해제를 억제하여 골 흡수를 감소시키는 상황을 만들어야 하는데, 이 골 흡수 억제제로는 칼슘, 비타민 D, 칼시토닌, 여성호르몬, 티볼론, 선택적 에스트로겐 수용체 조절제 및 비스포스포네이트 등이 있다(Park, 2012). 이 중 여성호르몬인 에스트로겐과 유사한 기능을 하는 식물성 에스트로겐을 통하여 골 손실을 막음으로써 골질환을 예방할 수 있다.
Kim 등(2000)은 볶은 홍화씨에서 발견한 리그난(lignan), 플라보노이드(flavonoid), 세로토닌(serotonin) 성분들을 분리하여 각각의 구조식을 밝혀냈고, 세포실험을 통하여 이 성분들이 조골세포를 촉진시키는 효과를 가지고 있다는 결과를 얻었다. Draper 등(1997)은 난소를 제거한 쥐에서 피토에스트로겐을 투여한 결과, 소변으로 칼슘 성분이 배설되는 것이 감소되었으며, 동시에 칼슘의 골 흡수를 촉진시키는 효과를 보였다고 보고하였다. 이와 같이 식물성 에스트로겐은 인체 내에서 뼈 보호작용과 골질환을 감소시키는 결과를 가져온다고 알려졌다.
염증반응은 세균이나 외부 이물질이 침입하였을 때 생체가 이에 대해 방어하기 위한 국소 반응으로 류마티스 관절염, 침투성 홍반성 낭창 등 다양한 질병을 야기시킨다(Mariette, 2006). 리그난이 염증매개물질의 최종 산물인 NO를 억제하는 효과에 대한 Lee 등(2006)의 연구에 의하면 RAW 264.7 cells에서 리그난의 일종인 sesamin이 NO 생성억제효과와 iNOS 발현을 억제하였다.
Neolignan인 magnolol과 hinokiol은 gram 양성균인 Salmonella aureus 등 4종류의 균에 대하여 살균력이 강한 항균활성을 나타냈다(Namba et al., 1982). 또한 Kim 등(1999)에 의한 연구에서도 리그난은 Bacillus subtilis, Escherichia coli, Salmonella typhinarin, Vibrio parahaemolyticus 등 7종류의 균에 대하여 항균활성을 나타냈다.
이와 같이 리그난은 갱년기 증상 완화, 항산화, 항암, 항염증 효과, 항균활성, 심혈관질환 예방, 골질환 예방 등이 알려졌고, 혈청 콜레스테롤과 그 외 지질을 낮추는 등 생체조직을 보호하는 다양한 기능이 알려지면서 그 중요성에 대해 주목을 받고 있다.
리그난은 섭취 후, 결장의 상부에 있는 장내 미생물에 의해 enterodiol과 enterolactone으로 대사된 포유동물의 분변 및 산물에 포함된 물질이다(Del et al., 2013; Miguel et al., 2014). 이렇게 생성된 물질은 생체에 영향을 미치는 주요 생물학적 활성형태는 enterolignans이며, 이 활성형 리그난은 secoisolariciresinol diglycoside 성분으로 SDG는 에스트로겐 유사 활성을 갖는 식물 유래의 비스테로이드성 화합물이기 때문에 식물성 에스트로겐으로 분류된다(Petit, 2010).
건강에 이로운 영향을 미치는 것으로 밝혀진 식물성 에스트로겐이 포유동물에 장내 미생물에 의하여 생성되는 것이 밝혀진 이후 포유동물의 산물인 유제품을 통한 다양한 연구들이 이루어지고 있다.
선행연구들을 통하여 상당한 농도의 enterolactone이 소의 우유에 존재하는 것으로 보고되어 (Antignac et al., 2004; Miguel et al., 2014), 포유동물에게 식물성 리그난 섭취를 통하여 장내 미생물에 의해 생성된 enterolactone의 양을 증가시켜 유제품의 영양성분 및 활성형 리그난의 비율을 연구하였다(Saarinen et al., 2002).
귀리우유나 Enterolactone이 농축된 우유 및 유제품의 섭취는 포유류의 리그난 섭취를 증가시키는 훌륭한 전략이 될 수 있다(Gagnon, et al., 2009). 그러나 아마씨의 섭취를 통하여 우유 조성을 바꾸기 위한 연구 결과, 초기부터 섭취시킨 젖소의 우유에서 아마씨 섭취비율에 따른 영양성분의 차이는 미미하였다(Axelson, et al., 1982). 반면 우유의 생산량을 증가시켰고, 미량이기는 하지만 우유의 지방산 농도에 차이를 확인할 수 있었다(Gonthier, et al., 2004). 다른 연구에서는 정제한 아마씨에서 추출한 secoisolariciresinol diglucoside(SDG)를 우유 및 발효유에 첨가하여 저장상태에 따른 변화를 분석한 결과, SDG의 첨가 비율이 높을수록 유제품의 안정성이 증가하는 것을 알 수 있었다(Hyvärinen, et al., 2006).
결론적으로 아마씨를 직접 포유동물에 섭취시키는 것은 대다수 연구에서 우유 성분에 큰 영향을 미치지 않지만, 장기간에 걸친 젖소의 건강과 생산성에 미치는 영향은 이로운 것으로 밝혀진 바 이 부분에 대한 연구는 지속적으로 필요하다. 그리고 아마씨를 통한 정제된 SDG는 유제품 저장 및 안정성에 이로운 영향을 미치는 연구결과를 토대로 세계 시장에서 기능성 식품으로 많이 이용되는 것을 유제품과 접목시켜 다양한 기능성 유제품 개발을 통하여 건강에 유익한 영향을 미치는 리그난의 섭취율을 증가시키는 노력이 필요할 것으로 사료된다.
결론
리그난은 식물성 에스트로겐으로 채소 및 과일과 다양한 식품에 포함되어 있으며, 체내에서 여성 호르몬과 유사한 기능을 하고, 항산화 작용 등 건강에 이로운 영향을 미치는 것으로 밝혀졌다. 그리고 최근에는 에스트로겐 투여에 의한 위험성을 보완하기 위해 식품에 함유되어 있는 천연물 활성 물질을 이용한 대체 요법에 대한 연구가 활발히 진행되고 있다. 이에 본 연구에서는 리그난의 화학적 특성, 체내 대사 과정 및 식품에 함유되어 있는 리그난을 알아보고, 건강에 미치는 영향에 대하여 집중적으로 살펴보았다. 리그난은 식물에 함유되어 있는 diphenolic 구조를 가진 식물성 화합물이고, 자연계에 secoisolariciresinol, mataireinol, pinoresinol, medioresinol, lariciresinol, syringaresinol, sesamin 등의 형태로 존재하며, 체내에서 장내 미생물균에 의해 동물성 리그난인 enterodiol과 enterolactone으로 전환되어진 후 흡수되어 체내에 이로운 영향을 미친다. 또한, 리그난은 관상동맥심장질환 및 심혈관계질환 사망률을 감소시키며, 유방암과 전립선암 등을 예방하는 효과가 선행연구를 통해 보고되었다. 폐경 이후 여성에게 가장 큰 건강 문제인 호르몬 변화로 인해 발생되는 골다공증 등의 골 질환도 리그난의 섭취로 개선되는 것을 알 수 있었다.
그러나 아직까지 리그난과 질병과의 연관성을 확인하는 연구는 미흡한 편으로 지속적인 더 많은 연구가 이루어져야 한다. 또한 리그난을 고용량 사용하는 중재 연구에서 일부 심혈관계 위험 요인과 연관성이 있다는 것을 발견하였으나, 이와 관련된 구체적인 리그난의 대사 과정에 대한 연구는 미흡하다. 포유동물의 장내 미생물 대사 산물로 생성되는 활성형 리그난이 건강에 이로운 영향을 미치는 것으로 밝혀진 후 리그난의 섭취를 증가시켜 유제품 자체에 활성형 리그난의 함량을 증가시키기 위한 연구들이 계속되고 있다. 따라서 리그난에 대한 지속적이고, 구체적인 연구가 필요하다고 사료된다.






