서론
2016년 국내 원유 생산량은 약 207만 톤으로 집계되었는데, 이는 전년보다 4.5% 감소한 수치이며, 반면에 유제품 수입량과 유제품 총 소비량은 전년보다 각각 27.8%, 2.3% 증가한 228만 톤, 402만 톤으로 증가한 것으로 나타났다(Table 1). 이러한 국내산 원유 공급과 소비의 불균형은 어제 오늘의 일이 아니고, FTA 체결 시점부터 예상되었던 것이다. 실제로 Table 1에 나타난 바와 같이, 국내 원유 생산량은 2011년 구제역 파동 후 젖소의 대량매몰 사건으로 다소 감소한 이후 다소 증가하였으나, 2014년부터는 꾸준하게 감소하였다. 그러나 수입 유제품은 2014년도만 전년 대비 감소하였다가 국내 원유 생산 감소와는 정반대로 지속적으로 증가하는 것으로 나타났다.
Table 2는 유가공품 소비량을 나타낸 것으로 2016년 1인당 유제품 소비량은 76.4 kg으로 매년 증가하는 것으로 집계되었다. 여기서 주요 유제품인 시유, 발효유, 치즈 소비량을 합하면 45.5 kg 밖에 되지 않지만, 나머지 30.9 kg은 분유, 버터 등 직간접적으로 소비하는 유가공품 즉, 식품 재료로 소모되는 양에 해당되기 때문이다.
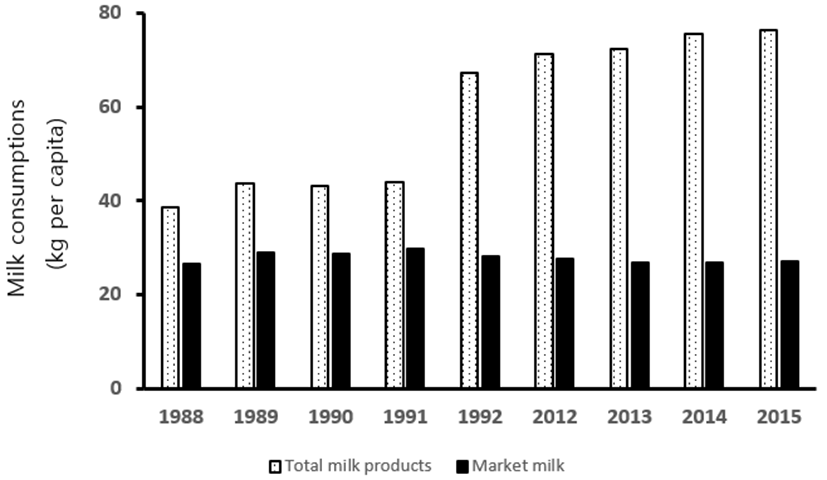
Fig. 1은 현재의 유제품 소비 수준을 우유 살균법 논란이 있었던 1988부터 1992년까지 비교한 그래프로 흰 우유의 소비는 과거부터 거의 늘지 않은 반면에, 유제품 소비는 두 배 정도까지 증가하였다. 이 자료를 바탕으로 1인 당 유제품 소비 중에서 흰 우유가 차지하는 비율을 보면, 우유 살균법 논란이 있었을 당시인 1989년과 1990년에 흰 우유가 차지하는 비율이 73.5%, 68.5%, 66.7%이었으나, 2015년과 2016년도에는 각각 26.9%, 27%로 대폭 감소하였다. 과거에 우유의 살균방법에 따른 논란은 전체 유제품 소비에서 시유 형태로의 소비가 절대적으로 높았을 때 벌어진 해프닝이었던 것이다. 흰우유 소비가 전체 유제품 소비에서 지속적으로 그 비율이 감소하였기 때문에, 흰 우유에 대한 관심이 적어졌기 때문에 우유 살균에 대한 논란이 시들해진 것은 사실이다. 그러나 시유가 차지하는 시장의 감소 이외에도 소비자들의 우유에 대한 정보 수준이 높아졌고, 유제품 회사의 품질관리 노력의 결과로 우유 살균 방법에 대한 논쟁이 줄어들었다고 볼 수 있다. 현재 판매되는 우유는 낙농 선진국이라 할 수 있는 국가들이 생산한 우유와 비교해도 결코 뒤지지 않으며, 일부 우유에 대한 위생기준은 낙농 선진국보다 까다롭다. 이렇게 우유의 품질과 위생수준이 높아진 것은 인터넷과 SNS의 발달로 우유에 대한 영양학적 많은 고급 지식을 쉽게 접할 수 있게 되어 우유의 품질에 대한 기대치가 높아졌고, 소비자의 기대치가 높아진 만큼 유제품 제조회사들이 더 노력을 했기 때문인 결과라고 생각된다.
한 가지 우려되는 것은 흰 우유 소비가 정체되어 있는 현 시점에서 업체들간의 과도한 경쟁에서 자칫 잘못하면 과거와 같은 우유 논쟁이 다시 일어날 지도 모르는 상황이다. 과거의 우유 살균방법과 고름우유 논쟁은 자기만 살고, 남은 죽어도 좋다는 극단적인 사고에서 기인된 것으로, 이러한 논쟁이 있을 때 마다 전체 유제품 시장이 감소했던 것을 기억해야 할 것이다.
실제로 S 우유에서의 체세포수 1등급에 대한 광고는 역설적으로 “체세포수가 1등급이 아니면 우유의 품질이 나쁘다”라는 소비자의 인식을 가져올 것이고, 체세포수 1등급만을 받기 위한 여러 편법이 난무해질 수도 있어, 궁극적으로 소비자의 신뢰를 잃어버릴 수 있다는 점을 명심해야 할 것이다.
이번 논문에서 소개할 내용은 “우유의 열처리가 우유품질과 영양가에 미치는 영향”의 5번째 장에 기재된 것이다. 사실 원전에서 4번째 장은 열처리가 우유 효소에 미치는 영향인데, 저자의 사정으로 5번째 장을 먼저 게재하게 되었다.
5번째 장은 고려대학교 농과대학에 재직한 김영교 교수가 작성한 것으로 “우유의 열처리가 우유품질과 영양가에 미치는 영향”의 발간 총 책임저자이었다. 본문의 구성은 1. 가열에 의한 우유단백질의 이화학적 성질의 변화, 2. 가열에 의한 칼슘의 변화, 3. 가열 취, 4. 우유의가열에 의한 구성아미노산의 화학적 변화, 5. 가열우유의 단백질의 영양가, 6. 끝맺음으로 되어 있다. 첫장부터 마지막까지 문장 하나하나가 잘 짜여진 글이어서 본 저자가 새로이 가감하지 않고 그대로 게재를 하였다. 후학들이 우유 단백질에 대한 지식을 넓히는 데 좋은자료가 될 것 같아 본 학술지에 우선적으로 게재를 하였다.
본론
우유의 가열은 살균, 멸균, 농축, 건조 등 시유처리와 각종 유제품 가공공정에 있어서 불가피하다. 이러한 우유의 가열처리는 우유의 안정성, 특히 colloid(Casein-calcium-phosphate phase)상을 불안정화시켜 우유 및 유제품의 품질에 영향을 미친다. 또한 가열에 의해서 우유의 영양적 손실을 초래할 수 있다. 예를 들면 시유나 유음료의 경우에 콜로이드상의 안정성이 유지되는 것이 필수적이지만, 시판우유의 경우에도 때로는 시판과정에서 콜로이드의 안정성이 파괴되는 예를 볼 수 있다. 또 각종 치즈의 제조공정에서는 산이나 응유효소에 의해서 콜로이드상의 안정성을 파괴하여 커드(curd)를 형성하여 치즈를 제조하지만, 치즈의 조직이나 품질은 가열온도와 가열시간에 따라서 달라진다. 농축유의 경우는 저장 중에 점도가 변화하여 농후화 현상을 일으키는 일이 있다. 무당연유의 경우는 이 문제를 극복하기 위하여 제조공정에서 예비가열이나 화학약품을 첨가하지만 아직까지 이에 대한 화학적 또는 생화학적 지식은 매우 제한되고 있다. 초고온 멸균법에 의해서 제조되는 농축유도 저장중에 적당한 유동성을 유지시키는데 어려운 문제점이 있는 것으로 알려지고 있다. 분유제조에 있어서도 콜로이드상의 안정성은 분유품질의 중요한 요인이 되며, 특히 그 용해도와 관계가 깊다 (Rose, 1963; Webb 등, 1974; Jenness와 Patton, 1959).
이와 같이 우유의 콜로이드상의 열안정성은 우유 및 유제품가공에 있어서 매우 중요한 것으로 알려지고 있으나, 콜로이드상의 열안정성에 관하여 요인들이 매우 복잡해서 많은 연구가 이루어지고 있음에도 불구하고, 그 원인이나 해결방법이 완전히 구명되고 있지 않다 (Rose, 1963., 1965; Fox와 Morrissey, 1977; Fox, 1982).
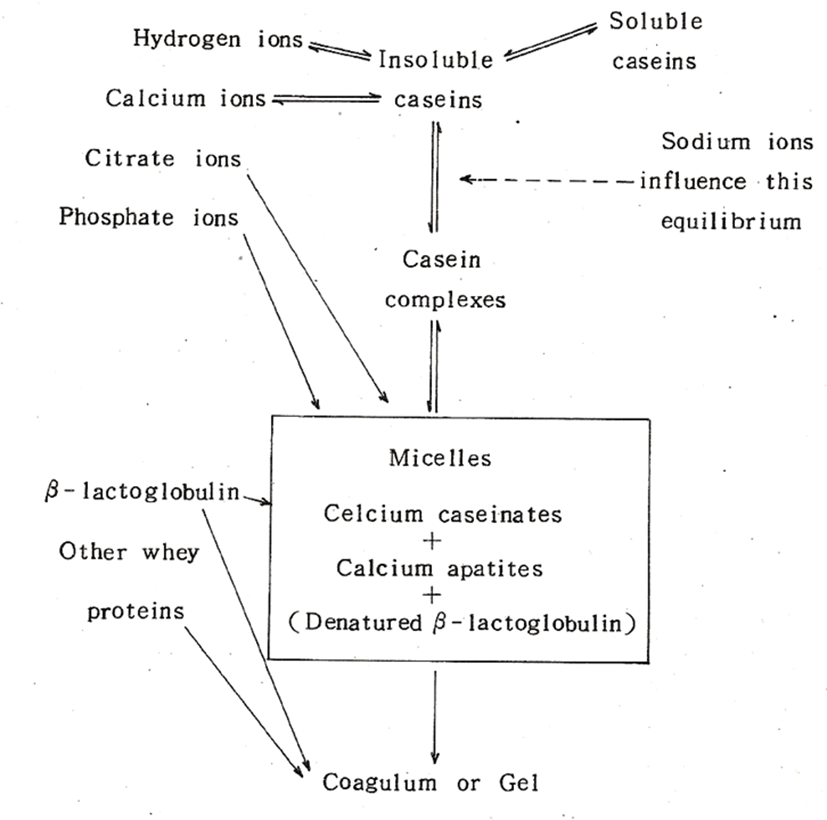
Rose(1965)는 콜로이드상의 안정성에 미치는 근본적인 요인은 콜로이드의 수화도와 콜로이드표면의 하전(net charge)에 의한 것으로서 여기에 영향을 미치는 요인들에 대해서 다음과 같이 요약하고 있다(Fig. 1). 콜로이드상의 안정성은 이 요인들이 상호간에 평형을 유지할 때 안정성은 유지되지만, 가열, 농축, 건조 등에 의해서 그 평형이 파괴될 때 콜로이드상은 불안정해져서 콜로이드상의 주성분인 casein은 침전 또는 응고하게 된다. 콜로이드(Casein-calcium- phosphate)를 통상 casein micelle이라 하며, 가열 시에는 변성된 β-lactoglobulin이 micelle과 결합한다.
우유의 살균이나 UHT 처리에 의해서 유청단백질은 변성되어 응고 침전하거나 casein과 결합한다(Jennes와 Patton, 1959.; Webb 등, 1974). 따라서 가열처리에 의해서 외견상 우유의 질소 분포에 변화를 나타낸다. 변화율은 가열온도와 가열시간에 따라서 다를 수 있다.
Table 3은 생유와 63℃, 30분 및 135℃, 1~3초 가열한 우유의 질소분포의 변화를 나타낸 것이다(Shillam 등, 1960).
저온 장시간 살균유에서 비 casein 단백질(유청단백질)은 역 90%가 미변성 상태인데 대해서 UHT 처리유에서는 약 28%만이 미변성 상태로 잔존하고 있다.
Casein은 63℃, 30분 가열에서 2.93%, 135℃, 1~3초 가열에서 18.4% 증가하고 있다. 가열에 의해서 casein량이 상대적으로 증가하는 것은 열변성한 유청 단백질이 casein과 결합하거나 또는 casein과 함께 침전되어 외견상 casein량이 증가하는 것이라고 해석할 수 있다. 金과 金(1986)의 실험결과에서도 탈지유를 가열한 후 100,000 g의 초원심 분리에 의해서 casein micelle을 침전시키고, 유청 중의 유청 단백질량을 측정한 결과 65℃, 30분 가열에서 4.5%, 75℃, 30분 가열에서 43.04%, 95℃, 30분 가열에서 82.36%의 유청단백질이 감소되었고, 상대적으로 casein micelle량은 증가하였다. 이와 같은 결과는 가열에 의해서 변성된 유청단백질이 응집 또는 casein micelle과 결합해서 침전된 것이라 할 수 있다. 따라서 살균유나 UHT 처리유에서의 질소분포변화는 주로 유청단백질의 열변성에 의한 결과로 볼 수 있다.
이상과 같은 질소분포의 변화는 casein과 유청단백질의 아미노산 조성에도 변화가 있을 것으로 생각할 수 있다. Douglas 등(1981)이 생유, HTST 가열유(71.7℃, 15초) 및 UHT 처리유(148℃, 3초)로부터 casein과 유청단백질을 조제하여 그 아미노산조성을 분석한 결과는 Table 4와 같다.
생유 및 HTST 살균유와 비교해서 UHT 처리유의 casein의 아미노산 조성에서는 Asp, Ala, Cys, Lys 등의 함량이 높은 반면 Pro, His량은 낮아지고 있다. 한편, UHT 처리유의 유청단백질에는 Glu, Pro, Phe, Lys, His량이 높고, Als, Cys, Met량이 낮아지고 있다. 이와같은 결과는 casein과 유청단백질의 복합체 형성에 의해서 잘 설명할 수 있다(Long등, 1963; Davies 등, 1978; Sawyer, 1969; Smits와 Van Brouwershaven, 1980). 또 polyacrylamide 전기영동에서 casein fraction에 유청단백질이, 유청단백질 fraction에 casein이 나타나므로 복합체의 형성을 증명해 주고 있다(Douglass, 1981). 이와 같은 사실들로 볼 때 UHT 처리에서도 우유단백질 전체로서는 아미노산 조성에 큰 손실은 없는 것으로 볼 수 있다.
Adpated from Shillam et al., 1960.
bUncorrected for losses(adapted from Douglas et al., 1981).
Casein은 20℃에서 탈지유의 pH를 4.6으로 했을 때 침전되는 불균일한 인단백질을 말하며, 그 종류에는 αs1-casein, αs2-casein, β- casein 및 κ-casein이 있다(Whitney 등, 1976; Eigel 등, 1984).
Casein은 그 구조상 온화한 가열에 의해서는 열변성을 하지 않는 것으로 알려지고 있다. 그리고 정상적인 액상유는 열안정성이 매우 높으며, 끓여서 응고현상이 일어날 때까지는 14시간이 소요되었고, 130℃에서의 가열에서는 응고하기까지 한 시간이 걸린다고 한다(Webb 등, 1974).
그러나 우유의 살균이나 UHT 처리과정에서 약간의 비단백질질소(NPN)의 변화가 일어났다는 보고도 있다.
Fox 등(1976.b)에 의하면 신선탈지유를 55℃에서부터 90℃ 사이에서 각각 30분 가열한 결과, 실온에서 24시간 내에 gel을 형성하였으며, 5% 트리크로로초산(TCA) 가용성 질소가 유리되었다고 한다. 이 가용성 질소는 미생물의 작용에 의한 것은 아니며, 살림모신(Chymosin; rennin) 작용에 의해서 우유단백질로부터 유리되는 펩타이드(peptied)와 유사하며, κ-casein의 마크로펩타이드일 것으로 추정하였다.
또 Hindle과 Wheelock(1970)은 가열에 의한 펩타이드의 유리는 50℃부터 일어나기 시작하였으며, 이 glycopeptide에는 N-acetyl neuraminic acid, D-galactose 및 2-acetamido-2-deoxy-D- galactose, D-manose 등이 함유되어 있으며 카이모신작용에 의해서 κ-casein으로부터 유리되는 glycopeptide와 매우 유사하였다고 보고하였다. 그러나 κ-casein으로부터 유리되는 것인지는 확인되고 있지 않다.
그리고, Douglas 등(1981)과 FArrel과 Douglas(1983)는 생유, HTST 살균유(71.7℃, 15초), UHT 멸균유(148℃, 2.5~3초)로부터 각각 casein을 조제하여 용해도, 점도 및 유화능력 등을 비교한 결과 UHT 멸균유로부터 조제한 casein의 용해도는 다소 감소하였으나 (Table 5 참조), 점도와 유화 능력에는 별 차이가 없었으며, 영양면에서도 차이가 없었다고 한다.
한편, 100℃ 이상에서 가열처리하는 병장멸균법이나 보다 고온에서는 가열시간에 따라서 peptide의 유리, casein 결합인(燐)의 탈린 등 심한 화학적 변화가 일어난다. 우유를 120℃에서 3분 가열하면 Proteose-Peptone(PPN)량은 총질소량의 4.7~6.0% 증가하였고, 비단백질질소(NPN)는 5.5~7.5% 증가하였으며, 120℃, 5시간 또는 135℃, 60분 가열에서는 총질소량의 10~20%가 NPN으로 전환되었다고 하였다. 생유의 PPN은 우유중 plasmin의 가수분해작용에 의한 β-casein의 일부 fragment인 것으로 밝혀지고 있다. 멸균에 의해서 생성되는 PPN도 단백질의 펩타이드 결합이 절단되어 생성되는 것으로 판단되고 있지만 어느 부분이 절단되는 지는 아직 증명되고 있지 않다. NPN은 12% TCA 가용성 질소이며, 아미노산(glutamine과 aspargin)의 탈아미노화에 의한 암모니아의 유리에 기인하는 것으로 추정되고 있으나, 아직 확인되고 있지 않다.
그러나 살균유 또는 UHT 처리유에서는 PPN이나 NPN을 정량할 수 있을 정도의 증가는 없었다고 하였다(Alais 등, 1967; Fox, 1982; Walstra와 Jenness, 1984; Weeb 등, 1974). 그리고 고온가열에 의해서 casein으로부터 유리되는 펩타이드는 카이모신 작용에 의해서 유리되는 펩타이드와는 다르지만 분리한 κ-casein을 120℃, 30분 가열했을 때 유리된 마크로펩타이드는 카이모신 작용에 의해서 유리된 것과 아미노산 조성은 유사하였다고 보고하고 있다. 이와 같은 결과는 고온가열에 의해서 κ-casein뿐만 아니라, 다른 casein으로 부터도 펩타이드가 유리되는 것으로 해석할 수 있다. 또 κ-casein을 100℃, 5분 또는 그 이상의 온도에서 가열하면 Ca2+에 대한 α2-casein의 보호작용이 감소되거나 파괴되며, 그 원인은 분자내의 응집 또는 α2-casein과 κ-casein의 복합체 형성에 기인하는 것으로 추정하고 있다(Alasis 등, 1967; Fox, 1982; Saito 및 Nakanishi, 1975; Yoshino 등, 1964).
한편, 고온가열에 의한 casein의 변화는 casein의 종류에 따라서 다른 것으로 보고되고 있다. α2-casein, β-casein 및 κ-casein을 분리한 후 각각 1% 용액(pH 6.8)을 조제하여 140℃에서 60분 가열한 결과, α2-casein, κ-casein으로부터는 총질소량의 11%에 해당하는 12% TCA 가용성 질소가 유리되었으나, β-casein으로 부터는 약 3% 유리되어 casein의 종류에 따라 열저항성에 차이가 있음을 나타내고 있다(Yoshino 등, 1964).
| pH | % of soluble nitrogena | ||
|---|---|---|---|
| Raw | HTST | UHT | |
| 6.0 | 78.78±0.11 | 74.76±0.29 | 50.98±0.16 |
| 6.8 | 88.15±0.41 | 84.11±0.46 | 71.72±0.32 |
| 8.0 | 94.38±0.16 | 86.85±0.21 | 78.05±0.14 |
Adapetd from Douglas et al., 1981.
우유에 0.6~0.7% 함유되어 있는 유청단백질은 총우유단백질의 약 20%를 차지하고 있다. 그 종류로는 β-lactoglobulin(β-1g), α- lactalbumin(α-1a), 유청알부민, 면역글로불린 등이 있다(Eigel 등, 1984).
유청단백질은 casein과는 달리 규칙성이 높은 특유한 공간구조를 가진 球狀단백질로서 저온장시간살균(LTLT), 고온단시간살균(HTST), 초고온처리(UHT) 등의 가열에 의해서 그 구조의 규칙성이 다양하게 변화된다. 다시 말해서 유청단백질은 열변성을 받기 쉬운 특징을 가지고 있다(Jenness와 Patton, 1959; Webb 등, 1974;Dewit와 Klarenbeek, 1984; 祐川, 1984). 유청단백질은 casein에 비해서 燐을 함유하고 있지 않으며, proline 함량은 낮고 cystine, cysteine 및 methionine 함량은 높다. 유청단백질의 열변성은 유청단백질의 용해도의 변화, H2S의 발생, 가열취의 생성, 抗酸化성의 향상, 농축유의 가공시 열안정성의 증가, 농축유의 농후화의 예방, 동결유의 콜로이드 안정성의 감소, 카이모신(chymosin)작용에 의한 우유의 응고시간 지연, 연질커드의 형성, κ-casein과의 상호작용등에 직접 또는 간접적인 영향을 미친다. 열변성된 유청단백질의 용해도의 변화는 등전점 부근인 pH 4.6과 포화염화나트륨용액에서 용대호를 상실하여 침전되기 쉽고 따라서 casein이 공존할 때는 casein과 함께 침전한다. 또, 열변성된 유청단백질은 칼슘이온에 대해서도 감수성이 높아져서 저농도의 Ca2+에의 존재하에 침전한다(Jenness와 Patton, 1959; Mckenzie, 1971a; Sawyer, 1969).
가열에 의해서 생기는 유청단백질의 중요한 성질 중의 하나는 sulfhydryl group(-SH 基)의 활성화이다. -SH기는 미변성인 자연상태의 유청단백질에서는 비교적 비활성적으로 존재하지만, 열변성되면 구조적으로 코일이 풀려 활서화 된다. 그래서 우유를 167℉(75℃)에서 가열하면 含黃아미노산이 –SH기를 유리하여 휘발성 황화물질을 발생하여 가열취를 발생한다(Aboshama와 Hansen, 1977; Jaddou 등, 1978; Patrick과 Swaisgood, 1976).
농축유의 열안정성은 농축 전에 예비 가열하여 유청단백질을 적당량 변성시키면 안정성이 증가한다. 따라서 무당연유의 제조공정에서는 멸균할 때의 열안정성을 위하여 필수적으로 예비 가열을 하고 있다. 유청단백질의 열변성에 의해서 일어나는 또 하나의 현상은 연질커드의 형성이다. 연질커드의 형성은 유아의 영양에 중요하지만 Cottage 치스의 제조 시에는 우유단백질의 응고력 부족현상을 일으킨다. 그 원인은 열변성된 유청단백질의 응집에 기인하는 것으로 생각되고 있지만, 그 기작이 화학적 반응에 의한 것인지 또는 순수한 물리적 변화에 기인하는 것인지에 대해서는 아직 완전히 해명되고 있지 않다. 화학적 반응에 의한 설은 유청단백질이 화학적으로 casein과 결함해서 casein과 함께 응고하므로 casein이 단단한 커드를 형성하는 성질을 일부 상실하게 되기 때문이다(Jenness와 Patton, 1959; Webb, 1974: β-Lg과 κ-casein의 상호작용 참조).
탈지유를 70℃에서 30분 가열했을 때 각종 유청단백질의 열변성율은 α-la 6%, β-1g 32%, 유청알부민 52%, 면역단백질 89%로 총유청단백질의 29%가 변성되었다(Larson과 Rolleri, 1955). 또, 金과 金(1983)이 70℃, 10분, 30분 및 60분 가열에서 총유청단백질의 열변성율을 측정한 결과는 각각 18.33%, 26.67% 및 30.0%이었다.
祐川(1984)이 저온장시간살균법, HTST법, UHT법 등에 의해서 가열처리한 살균유 또는 멸균유의 유청단백질의 열변성율은 Table 6에 표시된 바와 같다.
우유 살균 또는 멸균할 때 유청단백질의 다소의 변성은 피할 수가 없다. 유청단백질 중 β-1g, 유청알부민, 면역글로불린 등은 60℃ 이상에서 열변성이 일어나기 시작하며 저온장시간살균(62~65℃, 30분)에서도 유청단백질은 12~20%가 변성되고 있다. 그러나 현재 우유의 살균효율을 고려해서 75℃, 15분의 변칙살균이 채용되고 있는 경우도 있으며, 이 경우 유청단백질은 약 35% 변성되었다고 한다. 72~75℃, 15~16초 가열의 HTST법에서는 60℃이상의 가열을 받는 시간이 30~40초, 70℃ 이상이 25~30초이므로 유청단백질의 변성은 0.4~4%이다. 그러나 실제로는 85℃, 15초 살균의 HTST법이 많이 채용되고 있는데 이 같은 살균방법의 경우 유청단백질은 약 50% 변성되고 있다. UHT 처리에 있어서 85℃, 5분간의 예비가열 후 120℃, 2초 가열에서는 61.3%, 130℃, 2초에서는 62.1%, 140℃, 2초의 간접 가열에서는 64.1%, 150℃, 2.4초의 직접 가열에서는 56.8%로 간접 가열에 비해서 약간 낮은 변성율을 나타내고 있다(祐川, 1984). Renner(1983)도 HTST(72℃, 15초) 살균유의 경우 유청단백질의 변성율은 가장 낮으며, 63℃, 30분의 저온 장시간 살균에서는 유청단백질의 변성율은 20%이며, 간접식 UHT 처리유에서는 70~80%, 직접식 UHT 처리유에서는 40~60% 변성되었다고 보고하고 있다.
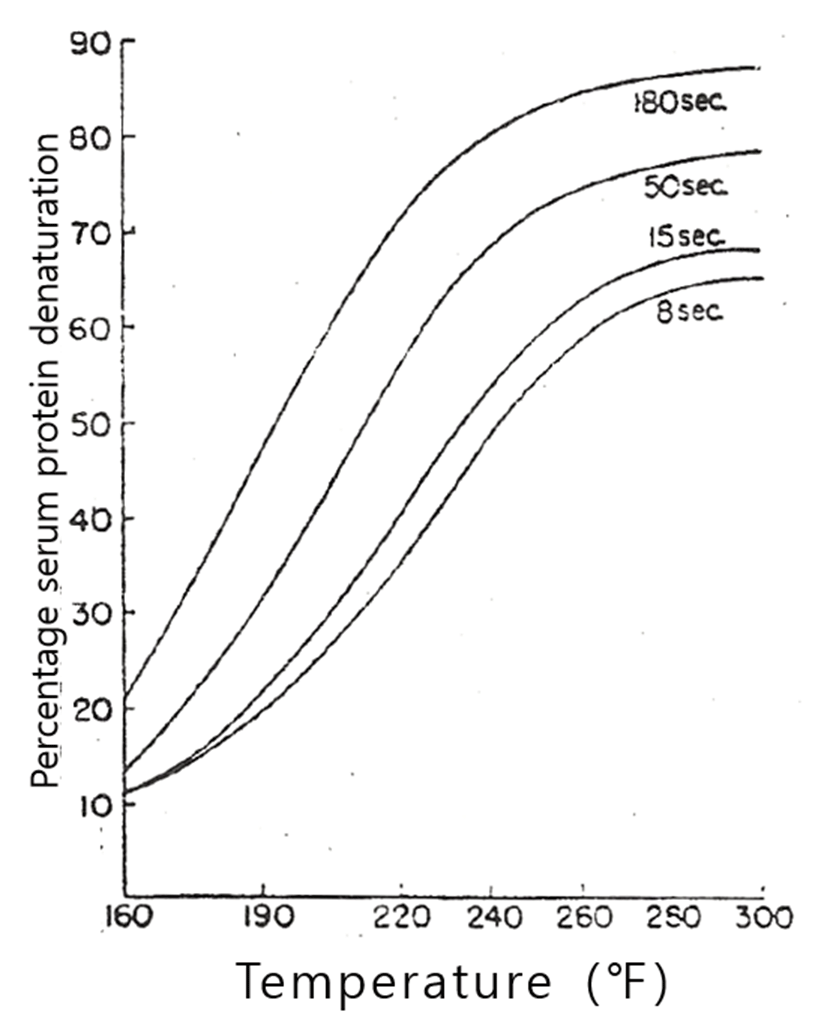
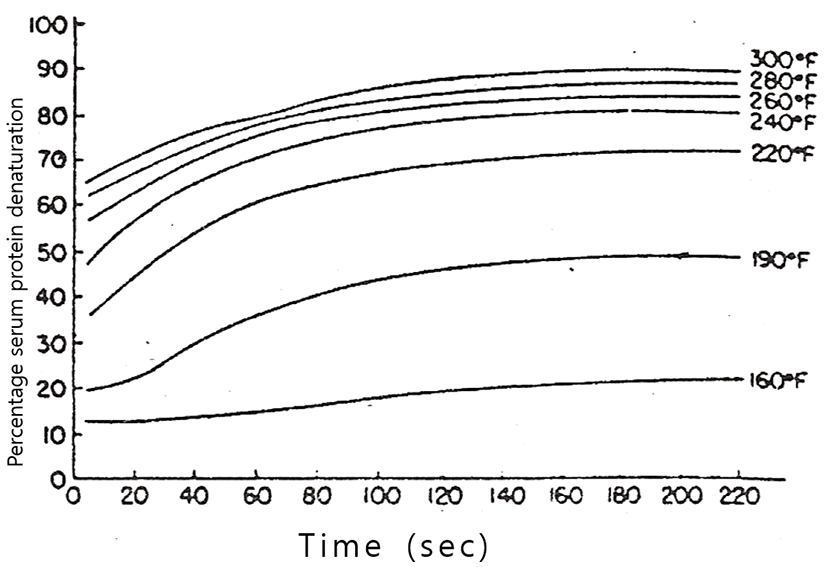
Harland 등(1952)과 Dill 등(1964)은 탈지유의 가열온도와 가열시간이 유청단백질의 변성에 미치는 영향에 대해서 Fig. 2~Fig. 5와 같이 보고하고 있다. 이와 같이 우유의 유청단백질의 가열에 의한 열변성은 가열온도와 가열시간에 따라 다르지만, 유청단백질의 열변성에 결정적인 영향을 미치는 것은 가열온도이며, 그것도 우유에 가해진 최고온도의 영향이 가장 큰 것으로 볼 수 있다(Lyster, 1970; Hillier와 Lyster, 1979; Gough와 Jemmess, 1962; Parnell-Clunies 등, 1988).
한편, β-lactoglobulin은 유청단백질 중 50~55%를 차지하며 양적으로 많을 뿐만 아니라 열변성에 있어서도 여러 가지 중요한 역할을 한다. β-Lg은 그 조성 중 2개의 sulfydryl group(-SH基)과 3개의 disulfide linkage(-S-S 결합)를 갖고 있는 것이 특징이다. 이 단백질은 생유에서는 dimer(분자량 36,000)로 존재하는데, 20℃에서부터 dimer는 monomer로 해리되기 시작해서 45℃까지 증가하며, 일정한 비율로 존재한다(Whitney 등, 1976; Mckenzie, 1972). β- Lg은 60℃ 이상에서 열변성을 일으키기 시작하며 열변성은 두가지 단계로 진행된다. 첫 단계에서는 열변성에 의한 2차 및 3차 구조에 변화가 일어나고, 다음 단계에서 응집된다(Jenness와 Patton, 1959; Webb 등, 1974; Sawyer, 1969). 예를 들면 97℃에서 15분 가열했을 때 첫 단계의 1차 반응에서 disulfide결합이 형성되고, 전기영동에서의 이동도는 미가열 β-lg보다 느리며, 분석용 원심분리에서는 한 개의 넓은 peak로 침강하였다. 침강계수는 2.6S(미가열 β-lg)에서 3.7S로 증가하였다. 두 번째 단계의 2차 반응은 29S의 큰 중량체를 형성하였으며, 이 물질은 분자 내의 disulfide 결합에 의한 것이 아니고 1차 반응에서 생성된 것이 물리적으로 응집된 것이라고 하였다. 그리고 sulfhydryl-blocking劑인 N-ethylmaleimide를 첨가해서 1차 반응에 의한 응집물의 형성을 저해하면 2차 반응에서 중량체는 형성되지 않았다고 한다(Sawyer, 1969; Morr와 Josephson, 1986).
Lyster(1970)는 우유를 60~90℃ 범위에서 30분 가열하였을 때 미변성의 β-lg과 α-lg의 잔존율을 Table 7에 표시하고 있다.
그리고 95℃ 이하에서는 β-lg B변이체는 β-lg A변이체보다 열변성이 빠르지만, 100℃ 이상에서는 β-lg변이체가 A변이체보다 더 안정한 것으로 보고하고 있다(Gough과 Jenness, 1962; Hillier와 Lyster, 1989; Mclean 등, 1987).
Adapted from 祐川, 1984.
| % Residual native protein | ||||
|---|---|---|---|---|
| β-Lactoglobulin | α-Lactalbumin | |||
| Temperature, ℃ | Found | Calculated | Found | Calculated |
| 62 | 92 | 98 | - | - |
| 66 | 89 | 93 | - | - |
| 70 | 70 | 81 | - | - |
| 74 | 47 | 59 | 75 | 80 |
| 77 | 32 | 38 | 51 | 64 |
| 82 | 7 | 14 | 32 | 32 |
| 96 | 0 | 1 | 0 | 1 |
Adpated from Lyster, 1970
탈지유를 가열하거나 또는 분리한 β-lg과 κ-casein 용액을 함께 가열하면 두 성분 사이에 상호작용을 일으켜서 복합체를 형성한다는 사실은 잘 알려지고 있다. 또, 이복합체는 κ-casein을 미리 가열한 β-lg 용액에 첨가했을 때도 형성된다. 이 복합체는 β-lg과 κ-casein의 sulfydryl-disulfide기의 치환 반응에 의해서 형성되는 것으로 받아들여지고 있으며 근본적인 화학적 연결은 disulfide bond라고 한다. 이 복합체의 형성율은 가열 온도와 가열 시간에 따라서 다르며, 110~140℃의 높은 온도에서는 분리된 단백질의 용액에서도 일어나며, 우유의 경우는 UHT 처리에 의해서 형성된다고 한다(Fox, 1982; Singh과 Fox, 1987; Purkayastha 등, 1967; Sawyer, 1969).
한편, β-lg과 κ-casein의 상호작용은 sulfhydryl-sidylfied 치환 반응 외에 소수성결합, 수소 및 이온결합, 또는 특수 會合이 아닌 polypeptide chain의 물리적인 엉킴에 의해서도 형성된다고 한다(Morr와 Josephson, 1968; Lyster, 1970). Morr와 Josephson (1968)은 탈지유를 가열했을 때 형성된 두 종의 유청단백질과 casein 응집체를 확인하였는데, 그 중 하나는 sulfhydryl-disulfied 결합을 통해서 형성된 단백질입자의 응집체이고 다른 한 종의 복합체는 첫 번째 복합체가 많이 엉켜서 형성된 응집체로서 큰 응집체는 탈지유의 casein micell의 작은 응집체들이 비특이성인 칼슘결합에 의해서 엉킨 것이라고 언급하고 있다.
그리고 Elfagm과 Weelock(1977, 1988)은 κ-casein과 α-lactalbumin(α-la)은 가열에 의해서 직접 상호작용은 하지 않지만 우유를 가열했을 때 우유 중의 β-lg과 α-la이 먼저 상호작용에 의해서 복합체를 형성하고 다음에 이 복합체는 casein micell의 κ-casin과 반응해서 β-lg, α-la 및 κ-casein의 큰 복합체를 형성한다고 보고하고 있다.
한편, β-lg과 κ-casein의 혼합액을 70℃에서 250초간 가열했을 때, β-lg의 소수성은 38% 감소하였고, κ-casein의 소수성은 80% 감소하였는데, 이와 같은 결과는 β-lg과 κ-casein의 상호작용은 sulfhydryl-disulfide 치환반응뿐만 아니라, 소수성의 상호작용도 내포하는 것이라고 하였다(Haque와 Kindella, 1988; Doi 등, 1983).
이상의 결과들을 종합해 볼 때 가열에 의한 β-lg과 κ-casein의 상호작용은 근본적으로는 β-lg과 κ-casein의 상호작용은 근본적으로 β-lg과 κ-casein에 함유되어 있는 sulfhydryl기와 disulfide기의 치환반응에 의한 것이지만 이외에 소수성 결합, 이온 결합 등도 관여하고 있는 것으로 볼 수 있다. 그리고 β-lg과 κ-casein의 상호작용에 있어서 β-lg의 유전적 변이체에 따라 반응송도가 다르며, 열변성이 A변이체보다 빠른 B 변이체가 더 빨리 κ-casein과 상호작용을 한다고 한다(Mckenize 1971b).
Table 8은 β-lg과 κ-casein을 1:1로 혼합해서 각 온도에서 20분 가열했을 때 상호작용을 일으킨 β-lg량을 퍼센테이지로 표시한 것으로서, 65℃, 20분 가열에서 3.4%, 85℃, 20분에서 82.9%, 99℃, 20분에서 76.7%로서 85℃에서 최고의 상호작용이 이루어지고 있음을 나타내고 있다(Long 등, 1963; Hartman과 Swanson, 1965).
Table 9는 우유를 가열했을 때 casein에 결합하는 유청단백질의 비율을 나타낸 것으로 이 결과에 의하면 가열량이 많을수록 결합단백질율이 높다는 것을 알 수 있다. 그리고 병장멸균유와 같이 가열량이 많아지면 casein과 유청단백질의 결합은 불가역적이 되어 보존 중에도 양자는 해리되지 않지만 UHT 가열에서는 casein과 결합한 유청단백질은 보존 중에 점차 casein으로부터 해리된다는 사실이 증명되고 있다(祐川, 1984).
| Heat treatment | β-Lg interacted |
|---|---|
| (C, 20min) | (%) |
| 25 | None |
| 65 | 3.4 |
| 70 | 15.4 |
| 75 | 48.8 |
| 80 | 67.8 |
| 85 | 82.9 |
| 99 | 76.7 |
Adapted from Long et al., 1963.
|
Heating Conditions |
% |
| 150℃, 0.8 sec | 42 |
| 150℃, 2.4 sec | 46 |
| 142℃, 10 sec | 49 |
| 129℃, 10 0sec | 64 |
| 116℃, 1 7min | 68 |
Adapted from 祐川, 1984.
Casein은 우유에서 인산칼슘과 결합해서 casein-calcium phosphate의 복합체를 형성해서 콜로이드상태로 존재한다. 이 복합체를 casein micelle이라 한다.
Casein micelle은 전자현미경의 관찰에 의하면 球形을 하고 있으며, 단백질 1 g당 3.7 g의 물을 함유하고 있는 수화도가 높은 스폰지와 같은 콜로이드 입자이다. 그 수는 우유 1 mL당 1014~1016정도이다. 크기는 다양해서 그 직경은 20~440 nm이다. 그러나 casein micelle의 약 80%는 100~200 nm의 범위에 속한다고 한다.
Casein micelle은 직경 10 nm 내외의 작은 submicelle로 구성되어 있으며, 직경이 25 nm인 casein micelle에는 약 450개의 submicelle이 함유되어 있고, 직경 150 nm의 micelle에는 10,000개 이상의 submicelle이 함유되어 있다고 한다(Slattery, 1976: Mc Mahon과 Brown, 1984).
Casein micelle의 조성은 Table 10에 표시된 바와 같다.
Casein micelle의 조성 중 93% 이상이 casein이지만, casein micelle의 크기에 따라서 αS1-casein, αS2-casein, β-casein 및 κ- casein의 상대적 비율은 다르고, micelle이 작을수록 κ-casein 함유율이 높고, β-casein 함유율도 증가하는 경향을 나타낸다(Rose 등, 1969; Davies와 Law, 1983). 또, β-casein은 열역학적으로 흥미있는 단백질로서 4℃에서는 자체회합(self-association)이 해리되어 monomer로 존재하고, 8.5℃ 및 13.5℃에서는 polymer를 형성하나, 18℃에서는 용해상태로 되며, 35℃에서는 칼슘존재하에 침전하는 성질이 있다(Mckenzie, 1971a; Davies와 Law, 1983). 저자의 실험 결과에서도 여러 온도의 탈지유를 같은 조건에서 원심분리 한 결과, 온도에 따라서 침전되는 casein micelle량과 침전되지 않는 상징액 중의 비침전 casein량에 현저한 차이를 나타냈다(신 등, 1984). 이 결과는 β-casein이 우유의 온도에 따라서 micelle로부터 해리와 결합이 반복되는 것으로 생각되나, 그 기작에 대해서는 잘 밝혀지고 있지 않다. 이와 같이 casein micelle은 그 구조가 복잡하고, casein과 인산칼슘의 상호작용에 의해서 입자를 형성해서 우유 중에 분산하고 있으므로 가열조건에 따라서는 전술한 바와 같이 유청단백질과의 상호작용, 칼슘이온농도의 변화, pH의 변화 등에 의해서 casein micelle에 어떤 변화가 있을 것으로 생각할 수 있다(Webb 등, 1984; Hansen과 Melo, 1976; Darling, 1980). 실험적으로 우유를 약 90℃에 가열하면 열변성된 유청단백질의 응고현상과 casein micelle의 크기에 약간의 변화가 일어났고, 병장멸균과 같은 심한 열처리를 하면 casein micelle의 응집체가 형성되고, 가용성 casein량이 증가하였다고 한다(Fox 등, 1967a; Morr, 1969; Aoki와 Kako, 1983). 또, Smietana 등(1977)은 전자현미경에 의한 관찰 결과, 생유의 경우는 직경 50~150 nm의 micelle의 수는 전체의 53% 이상이었으나, 92℃, 15초 살균한 결과는 50~150 nm 크기의 micelle은 35% 정도로 감소하고, 150~300 nm 크기의 micelle이 50% 이상으로 증가하였다고 보고하고 있다. 그리고 HTST 살균이나 UHT 처리를 했을 때도 생유 중의 micelle 크기에 비해서 큰 micelle의 수가 증가하였고, 또한 작은 micelle의 수도 증가하였다는 보고들이 있다(Morr, 1969; Hostettler 등, 1965; Rϋegg와 Blanc, 1978; Freeman과 Mangino, 1981; Aoki와 Kako, 1983; 金과 金, 1986; Kim과 Kim, 1988).
가열에 의한 casein micelle의 크기의 변화는 HTST 살균 < 직접식 UHT 가열법 < 간접식 UHT 가열법의 순으로 크며, 간접식 UHT가열법의 경우 그 변화가 가장 컸으며, 직경 280 nm 이상의 casein micelle이 약간 증가하였고, 직경 20 nm 이하의 유리 submicelle도 증가하였다. 그리고 HTST 살균에서 72℃, 15초와 92℃, 20초 가열에서는 양자 간에 별 차이가 없었다고 한다(Rϋegg와 Blanc, 1978; Hostetter 등 1965; Creamer와 Matheson, 1980).
가열에 의해서 큰 casein micelle이 증가하는 것은 열변성된 유청단백질, 특히 β-lg이 casein micelle 표면에 존재하는 κ-casein과 상호작용을 해서 β-lg이 casein micelle 또는 원심분리에 의한 비침전성 casein량이 증가하는 것은 가열의 영향에 의해서 칼슘이 casein micelle로부터 유리됨에 따라 micelle의 크기가 작아지고, 또 일부 submicelle이 유리되기 때문인 것으로 해석하고 있다(Fox, 1982; Smits와 Van Brouwersshaven, 1980).
Adapted from McMahon and Brown, 1984.
치즈 제조공정에서 카이모신(chymosin) 작용에 의한 우유의 커드형성은 치즈의 생산율, 치즈조직의 경연 등 경제성과 품질에 밀접한 관계가 있다. 그런데 가열처리한 우유는 카이모신작용에 의한 응고시간을 지연시키고, 커드를 연화시킨다는 사실이 경험적으로 예부터 알려지고 있다.
치즈커드의 주 성분이며, 응고기작에 가장 기본적인 역할을 하는 casein은 우유 중에 casein micelle 상태로 존재하며, 생리학적 범위 내에서는 가열, 균질, 칼슘이온에 casein micelle αs-casein과 β-casein은 4 mM Ca2+ 농도 이상에서는 불요성이 되지만 κ- casein은 광범위한 Ca2+ 농도에서 가용성이며 Ca2+에 의해서 침전되는 αS1-casein과 β-casein의 침전에 대해서 보호작용을 해서 casein micelle의 안정성을 유지한다. 그러나 카이모신작용에 의해서 κ-casein의 펩타이드가 절단되어 보호작용을 상실하게 되면 casein micelle은 응고하게 되고, Ca2+은 그 작용을 촉진한다(Fox와 Morrisey, 1977; Green, 1982; Webb 등, 1974).
우유의 가열이 카이모신작용에 의한 우유의 응고에 미치는 영향을 알아보기 전에 먼저 우유의 응고기작을 요약하고자 한다. 카이모신작용에 의한 우유의 응고과정은 제 1 차상(primary phase), 제 2 차상(secondary phase) 및 제 3 차상(tertiary phase)으로 구분된다. 제 1 차상에서는 카이모신작용에 의해서 κ-casein의 105번째의 phenylalanine 잔기와 106번째의 methionine 잔기 사이에서 절단되어 κ-casein은 para-κ-caseub(아미노산 잔기 1~105번 까지)과 glycomacropeptide(또는 macropeptide: 아미노산 잔기 106~ 109번까지)로 분리된다. 전자는 강한 소수성 물질로서 casein micelle에 결합된 상태로 남는다. 후자는 친수성 펩타이드로서 micelle로부터 유리되어 유청 속에 가용상태로 존재한다. 제 2 차상에서는 카이모신 작용에 의해서 κ-casein의 보호작용이 상실하게 되므로 casein micelle은 안정성을 상실하게 되어 응집하게 된다. 이 응집체와 함께 물리적으로 지방, 유청단백질, 유당 등이 함께 엉킨 것이 커드(curd)이며, 커드 형성에는 일정한 농도 이상의 Ca2+이 반드시 필요하다. 제 3차상은 정의할 수 없으나 형성된 커드로부터 수분이 배출되는 응축현상이며, 비효소적 과정을 말한다(Waygh와 Vin Hippel, 1956: Mackenzie, 1971a: Webb 등, 1974).
카이모신작용에 의한 우유의 응고속도 지연과 커드의 연질화 현상은 60℃ 이상의 가열에서부터 나타나기 시작하며, 가열 온도가 높고 가열시간이 길수록 그 영향은 크다. 그리고 90℃ 이상에서 10분 이상 가열하면 우유는 잘 응고되지 않는다고 한다. 이러한 변화는 80℃ 이하에서 가열할 경우는 가역적 변화로서 가열 후 5℃에서 냉장하면 시간의 경과에 따라서 회복될 수 있고 또 미량의 가용성 칼슘을 첨가하면 응고시간은 미가열유와 같아질 수 있다. 그러나 90℃ 이상에서 가열한 경우는 가용성 칼슘의 첨가에 의해서 응고시간은 회복되지만, 커드의 굳기는 회복되지 않고 부드러워진다(Webb 등, 1974; Singh 등, 1988). UHT 멸균유의 경우, 카이모신에 의한 응고시간은 약간 지연되지만, 병장 멸균유는 응고시간이 더 지연된다. 그리고 UHT 멸균유는 저장중 점진적으로 응고시간이 단축되어 6개월 후에는 생유와 응고 시간이 같았으나, 병장멸균유는 회복되지 않았다고 한다(Fox, 1982).
우유의 가열에 의해서 카이모신 작용에 의한 응고지연과 커드의 연화원인에 대해서는 많은 연구가 이루어지고 있으나 그 원인으로서는 Ca2+의 변화와 κ-casein과 β-lg의 복합체 형성에 기인하는 것으로 생각되고 있다(Kannan과 Jenness, 1961: Sawyer, 1969: Hindle과 Wheelack, 1970a,b: Wilson과 Wheeloack, 1972: Sinh등, 1988). 예를 들면, Singh 등(1988)은 우유를 70~140℃에서 1~10분 가열한 후 pH 5.5로 산성화 해서 Ca2+ 농도를 증가시킨 다음 pH 6.6으로 중화해서 카이모신을 작용시키면 응고가 잘 되었다고 보고하고 있다. 이 결과는 가열에 의해서 불용성 칼슘으로 전환된 칼슘을 산성화에 의해서 다시 가용성 칼슘으로 환원시켜주면 우유의 응고시간은 회복될 수 있다는 것이다. 다음에 β-lg과 κ-casein의 상호작용에 의한 복합체 형성에 기인하는 설은 열변성된 β-lg이 casein micelle 표면에 있는 κ-casein과 결합하여 카이모신작용을 저해한다는 것이다. Wilson과 Wheelock(1972)에 의하면 복합체에 의한 효소반응의 저해도를 κ-casein으로부터 유리되는 macropeptide량에 의해서 측정한 결과, 가열한 우유에서는 효소반응이 현저히 저해되었으며, 그 결과 우유의 응고는 지연되었다고 보고하고 있다. 또, 가열한 우유로부터 분리한 caein micelle 표면에는 생유에는 없는 filament 상의 부속물이 전자현미경으로 관찰되는데, 이것은 caein micelle에 결합한 열변성 β-lg인 것으로 확인되고 있다(Davies 등, 1978). 한편, Kannan과 Jenness(1961)에 의하면 탈지유, 유청단백질만을 제가한 인공유, 그리고 이 인공유에 β-lg을 첨가한 시료들을 조제하여 85℃ 또는 90℃에서 30분 가열한 후 카이모신을 작용시킨 결과, 탈지유는 가열온도가 높고 가열시간이 길수록 우유의 응고시간은 지연되었으나, 인공유의 경우 β-lg을 첨가했을 때만 응고기간이 지연되었다고 한다. 이상의 결과들을 종합해 볼 때 우유의 가열 결과, 카이모신에 의한 응고지연은 주로 κ-casein과 β- lg 또는 α- la에 의해서 형성된 복합체에 기인하는 것이며, 제 2단계에서 염류평형, 특히 가용성 칼슘량이 영향을 미치는 것으로 보고 있다(Kannan과 Jenness, 1961; Hindle과 Wheelock, 1970a,b; Wilson과 Wheelock, 1972; Haque와 Kinsella, 1988).
우유에 함유되어 있는 각종 염류와 이온은 가열에 의해서 영향을 받으며, 이에 따른 염류 평형의 변화는 콜로이드상을 불안정화 시키는 원인이 된다(Rose, 1963; Webb 등, 1974; Hansen과 Melo, 1977).
특히 콜로이드상의 안정성과 밀접한 관계가 있는 염류는 칼슘과 인이다. 우유의 총 칼슘량은 ℓ당 약 30 mM(100~140 μg/100 mL의 우유)이며, 이중 약 2/3는 불용성으로 일부는 apatite구조를 한 calcium phosphate상태로 존재하고 일부는 casein micelle에 함유되어 있어서 그 구조를 유지하고 있다. 나머지 1/3인 10 mM은 가용성 칼슘이며, 이중 2~3 mM은 이온성 칼슘이다(Webb 등, 1974).
가열에 의해서 우유 중의 총 칼슘 함량과 인 함량에는 변화가 없지만, 65℃ 이상에서부터 가용성 칼슘과 인은 감소하기 시작하며, 용해상으로 부터 콜로이드상으로 전환된다는 것이 알려지고 있다. 이러한 현상은 76℃ 이상에서 더욱 현저히 나타난다. 예를 들면 78℃, 30분 가열하면 가용성 칼슘의 약 25%가 불용성으로 전환했다고 한다. 그러나 이 우유를 5℃에서 냉장하면 24~48시간 내에 가용화 되어 원래의 수준으로 복원되는 것으로 알려지고 있다. 가용성 인도 가용성 칼슘과 유사한 변화를 나타낸다고 한다(Webb, 1974). Hansen과 Melo(1977)는 1.8 mM Ca2+를 함유한 생유를 UHT 처리한 결과, Ca2+은 1.6 mM로 약 11% 감소하였다고 보고하고 있다. 또 다른 예로는 총 칼슘량이 118 mg%, 투과성 칼슘량이 35 mg%인 생유를 120℃, 2초 및 140℃, 2초의 가열처리를 한 결과, 투과성 칼슘량은 각각 31.5 mg%로 감소했으나, 냉장 중 투과성 칼슘량은 거의 생유와 같은 수준으로 복원되었다. 즉, 가열에 의한 염류평형의 변화는 일부 가역적인 것으로 해석되고 있다. 그러나 병장 멸균유에서는 4~5주간 보존 후부터 투과성 칼슘은 서서히 감소해서 육안으로는 관찰되지 않았지만, 미세한 커드형성에 칼슘이 포함되는 것으로 추정되고 있다(祐川, 1981).
이상과 같이 일부 가용성 무기질은 가열에 의해서 감소되지만, 우유의 영양가에는 거의 영향이 없다고 한다. Rat 실험에서 UHT 처리유와 멸균유의 칼슘이용률은 생유와 같은 결과를 나타냈으며, 또 유아의 영양실험에서는 UHT 처리유는 Ca과 K의 保留가 살균유보다 오히려 높았으며, 인의 경우는 양쪽이 같았다고 한다(Renner, 1983; 山內, 1983).
한편, 가열에 의한 가용성 칼슘의 변화도 전술한 바와 같이 우유의 pH 및 산도의 변화, 카이모신작용에 의한 응유시간의 지연, casein micelle의 크기의 변화 등 우유의 물리적 성질에 미치는 영향은 다소 차이가 있는 것으로 보고되고 있으나, 山內(1983)는 랫드와 사람에 대한 여러 실험 결과를 볼 때 현재 실용화되고 있는 우유가열처리(UHT 포함)가 우유 중의 Ca 흡수율을 저하시키는 일은 거의 없는 것으로 결론짓고 있다.
우유의 가열처리에 의해서 생성되는 풍미를 일반적으로 가열취 또는 가열풍미라고 한다. 가열취의 원인이 되는 –SH기의 형성은 72℃부터 시작되며, 95℃에서 최고에 이르고 그 이상의 온도에서는 감소한다고 한다 (Kirchmeier, 1984).
생유의 풍미 중에는 황화합물로서 감지할 수 있을 정도의 dimethylsulfide((CH3)2S)와 극히 미량의 Carvon disulfide(CS2) 및 Carbonylsulfide(COS)밖에 존재하지 않았으나, 간접식 UHT 처리유(140℃, 3~90초)에는 상당량의 H2S, COS, CH3SH(methanethiol), CS2와 소량의 (CH3)2S가 함유되어 있다(Jaddou, 1978). 가열취는 보통 2~3일간의 냉장에 의해서 소실된다. 이들 휘발성 황화합물은 유청단백질인 β-lg이 열변성에 의해서 함황아미노산의 –S-S 결합이 개열되거나, 또는 분자내의 –SH 화합물이 전구물질이 되어 분해생성된 것으로 생각되고 있다. β-Lg이 이러한 풍미의 생성에 주역을 하는 것은 β=lg의 분자가 펩타이드쇄의 고차구조를 하고 있어서 풀리기 쉽게 되어 있으며, 그 때문에 분자내의 –SH 기가 쉽게 반응하는 것으로 생각되고 있다(Partick와 Swaisgood, 1976; Aboshama와 Hansen, 1977; Jaddou 등, 1978).
Aboshama와 Hansen(1977)이 생유, 살균유 및 UHT 처리유 중의 함황아미노산을 분석한 결과는 Table 11에 표시된 바와 같다.
생유에 비해서 UHT 처리유에서는 cystine과 cysteine은 각각 34.4% 및 33.8% 감소했는데, HTST 살균유에서는 각각 10.04% 및 4.76% 감소하였다. UHT 처리유에서 총 sulfhydryl기와 disylfide기는 약 16% 손실되었다고 한다. 그리고 생탈지유, 살균탈지유 및 신선유에는 유리 –SH기는 존재하지 않았으나, UHT 처리유에서는 0.07 mM/ L(또는 23 μM/g 단백질)이 검출되었다고 보고하고 있다(Aboshama와 Hansen, 1977). 한편, Patrick과 Swaisgood(1976)에 의하면 직접식 UHT에 의해서 121.1℃, 15초와 151.6℃, 1.5초로 처리한 우유에서 half-cystine 함량은 각각 2.2% 및 6.2% 감소되었으며, 100℃, 30분 가열에서는 17.4%가 감소했다. 그러나 UHT 처리(150℃, 5, 10 및 20초)에 의해서 우유 중의 함황아미노산량에 변화가 없거나 또는 거의 없었다는 보고도 있다(Hurrell 등, 1980).
| Skim milk | |||
|---|---|---|---|
| Raw | Pasteurized | UHT processed | |
| (73℃, 17초) | (143℃, 8초) | ||
| Cysteine and cystine | 1.623±0.083 | 1.460±0.010 | 1.065±0.001 |
| Methionine | 3.995±0.092 | 3.815±0.020 | 2.646±0.000 |
Adpated from Aboshama and Hansen, 1977.
우유를 고온가열하면 알데하이드, 케톤 및 환원당은 아미노산, 아민, 펩타이드, 또는 단백질과 aminocarbonyl 반응을 일으켜서 갈색변화를 일으키며, 가열취를 형성한다. 이 반응을 Maillard 반응이라 한다. 이 반응에서 초기에 검출되는 생성물질 중의 하나가 5-(hydroxymethyl)-2-furfural(HMF)이며, HMF의 양은 가열의 강도가 심할수록 증가한다. 따라서 HMF의 양은 갈색물질 형성의 지표로 이용할 수 있다(Renner, 1983; Renner와 Badke, 1984; 祐川, 198; Fink와 Kessler, 1986). HMF 이외에 우유의 고온가열이나 장기저장중에 생성되는 물질로서 lactuloselysine(ε-N-deoxylactulosyl- L-lysine), lysinoalanine(N-ε(2-amino-2-carboxyethyl)-L-lysine), fructose-lysine(ε-N-deoxyfructosyl-L-lysine), furosine(ε-N-(2- furoylmethyl)-L-lysine), pyridosine(ε-(3-hydroxy-4-oxo-6-methyl-1-pyridinyl)-L-norleycine) 등이 알려져 있다(Möller 등, 1977Lorient, 1979; Manson과 Carolan, 1980).
Lactuloselysine, lysinoalanine 및 fructoselysine은 우유의 가열에 의해서 lysine의 ε-NH2의 일부가 주로 유당의 카보닐기와 아미노카보닐 반응을 일으켜서 생성된다. 이들 생성물질은 소화효소의 작용을 저해해서 lysine의 유리가 방해되므로 lysine의 생리적 유효성을 상실하게 한다. Frosine과 pyridosine은 상기 물질의 산가수분해에 의해서 생성된다(Erbersdobler 등, 1987; 足立, 1983).
그러나 Millard 반응은 수분에 의해서 그 반응이 저해되므로 병장멸균유나 무당연유에서는 다소 일어나지만, 시유나 기타 유제품에서는 거의 일어나지 않는다고 했다(Renner, 1983).
전기한 바와 같이 알데히드가와 lysine의 ε-NH2기의 결합에 의해서 새로운 화합물이 생성되면 lysine의 생리적 유효성은 그만큼 감소되지만, 정상적인 우유의 가열공정에서는 lysine의 손실은 극히 미량에 지나지 않는다. 가열에 의한 유효성 lysine의 손실은 살균유에서 1~2%, UHT 처리유에서 1~4%(직접식과 간접식 UHT 사이에 차가 거의 없음), 잠깐 끓인 우유에서 5%, 멸균유에서 6~10%, 그리고 무당연유에서는 약 20%이며, UHT 처리에 의해서도 생리적 유효성 lysine에 변화를 줄 수 있는 양은 생성되지 않았다(Horak와 Kessler, 1981; Renner, 1989; Renner와 Badke, 1984; 1 to, 1986; 祐川, 1981). 또, Möller 등(1977)은 UHT 멸균처리 조건에서는 lysine의 불활성은 인정되지 않았으나 실온에서 6개월 이상 보존하면 어느 정도 불활성화되어 lysine의 유효성이 저하되었다고 보고하고 있다. 다만 장시간 가열에서는 상당량의 유효성 lysine이 손실할 수 있고, 분무건조에서는 그 유효성이 저하되지 않았으나, 드럼건조에서는 48~75%까지 저하되었다고 한다(祐川, 1984).
Table 12는 생유, HTST유 및 UHT 처리유로부터 각각 casein과 유청 단백질을 조제하여 유효성 lysine량을 분석한 결과이다. 이 결과에 의하면 가열처리한 casein 간에 영양가의 손실은 거의 없는 것으로 나타나고 있다. 그러나 UHT처리한 유청단백질 중의 유효성 lysine은 생유에 비해서 다소 감소(<10%)하고 있다. 그러므로 유효성 lysine의 손실은 주로 유청단백질에서 일어나며, casein은 거의 영향을 받지 않은 것으로 볼 수 있다(Douglas 등, 1981; Renner, 1983).
우유의 가열에 의해서 유당과 결합한 lysine은 생체 내에서 이용될 수 없는 아미노산이 되므로 그 만큼 영양가가 저하될 것으로 생각할 수 있다(Masters와 Frideman, 1979). 이 경우, 우유단백질의 제한아미노산이 lysine이면 lysine의 불활성은 영양가의 저하요인이 되지만, 우유단백질의 제한아미노산은 methionine이므로 lysine이 다소 불활성화 되어도 우유단백질의 생물가는 저하되지 않는다. 더욱이 우유단백질 중의 lysine량은 다른 아미노산에 비해서 비교적 많이 함유되어 있으므로 가열에 의한 유효성 lysine의 미량의 감소는 영양상 무시해도 좋을 것으로 결론짓고 있다(Douglas 등, 1981; Renner, 1983; 足立, 1989; 祐川, 1984).
a Moisture-free basis; b Mean SD for duplicate sample of available lysine.Aadpated from Douglas et al., 1981.
가열에 의해서 우유단백질의 영양가가 어떻게 변화하는지에 대해서는 많은 보고들이 있다(Burvall 등, 1977; Fricker, 1964; Hurrell 등, 1980; Renner, 1983; 祐川, 1984; 足立, 1983). Renner(1983)는 가열에 의해서 열변성된 단백질은 자연 상태의 단백질에 비해서 단백질의 고차구조가 느슨해지므로 효소작용을 받기 쉬우며, 살균유와 UHT 처리유의 단백질은 생유보다 오히려 이용률이 좋은 것으로 기술하고 있다. Fricker(1964)는 UHT(Uperization)로 150℃, 0.75초 처리한 우유로 랫트를 5세대에 걸쳐 실험한 결과 가열이 우유의 영양가에는 어떤 영향이 미치지 않았으며, 쥐의 수면, 생식능력, 혈액상태 및 내장기관의 발달에도 영향이 없었다고 했다. Kathleen (1959)과 Burton(1965) 등에 의하면 생유, UHT 처리유, UHT 처리후 병장멸균유(110~120℃, 12~20분 재멸균)로 랫드실험을 한 결과는 Table 13에 표시된 바와 같으며, 생물가와 단백질소화율에 거의 차가 없으나, 병잘멸균유는 생물가와 소화율이 다소 저하되고 있다.
다른 보고에 의하면 간접식 UHT 처리유의 단백질생물가와 소화율은 각각 92와 91로 생유의 그것들과 유이차가 없었고 또 유청단백질의 생물가와 소화율에 있어서도 UHT 처리 전과 후에 차이가 나타나지 않았으며 유청단백질의 가열변성은 이들의 영향학적 수치에는 어떤 영향을 미치지 않는다고 한다(Burton, 1969; Burvall 등, 1977; Hurrell 등, 1980; 足立, 1983). 그러나 분부건조는 생리적 유효성 lysine량을 감소시켜 단백질의 질을 다소 저하시켰다고 한다(Burvall 등, 1977).
한편, UHT 처리유의 정단백질 이용률은 생유의 그 값의 96~97%이며, Streptococcus liquefaciens와 같이 사람과 같은 필수아미노산을 요구하는 미생물을 이용해서 생물가를 실험한 결과, 여러 가지 방법에 의해서 처리한 UHT유로부터 얻은 생물가는 생유 생물가의 95~100%이었다고 한다. 그리고 살균유와 UHT 처리유의 단백질 이용률에도 유의차는 나타나지 않았다고 한다. 유아와 어린이의 경우에도 UHT 처리유와 저온장시간 살균유와의 사이에는 영양가와 질소평형에 유의차는 인정되지 않았다고 한다(Burton, 1969; Renner, 1983; 足立, 1983; 祐川, 1984).
그러나 송아지의 실험에서는 생유와 저온살균유의 경우 유의차가 없었으나, 생유와 UHT 처리유 사이에는 유의차가 인정되고 있다(Shillam 등, 1960). 그러나 유청단백질의 45% 이상이 미변성일 때는 그 차는 소실되었다고 한다(Shillam과 Roy, 1962). 이 원인에 대해서는 아직 밝혀지고 있지 않으나 송아지와 같이 모체에 의해서 면역을 얻는 사람과 우유의 면역 글로불린에 대한 반응은 당연히 다르다고 추정하고 있다(足立, 1983; 祐川, 1984).
또 돼지의 경우도 88℃, 30분과 66℃에서 가열한 후 분무건조한 분유로 실험한 결과, 양자 간에 성장률에 차가 나타났으며, 유청단백질의 가열변성도가 높은 전자의 경우 성장률이 지연되었다고 한다. 돼지는 모자면역이므로 그 원인은 송아지와 같지 않지만, 보다 강한 가열을 받은 전자의 경우 단백질의 질의 저하와 위내에서의 우유의 응고력 감소에 따른 단백질 소화율 저하 등이 영향을 미치는 것으로 추정하고 있다(Braude, 1970; Burvall, 1977; 足立, 1983).
| Sample | Biological value | Truedigestibility | |
|---|---|---|---|
| A | B | ||
| Raw whole milk | 90 | 92 | 91 |
| HTST-pasteurized | 91 | - | - |
| UHT-sterilized | 91 | 93 | 92 |
| Sterilized in bottle | 84 | 88 | 89 |
Adpated from Kathleen et al., 1959; Burton, 1965.
결론
우유의 정상적인 살균이나 UHT 처리에 의해서 casein은 화학적 변화를 받지 않으나, 유청단백질은 일부 변성된다. 가열에 의한 유청단백질의 변성은 HTST, 저온장시간살균, 직접식 UHT, 간접식 UHT순으로 높게 일어난다. 그 결과, 우유 중의 외견상의 질소분포의 변화, β-lactoglobulin과 κ-casein의 상호작용, casein micelle의 크기의 변화, chymosin 작용에 의한 우유응고의 지연 등의 현상이 나타난다. 그러나 병장멸균이나 그 이상의 강한 가열처리에서는 casein도 화학적 변화를 일으켜서 casein으로 부터의 탈린현상이 일어나고 일부 펩타이드로 유리된다. 또 κ-casein은 칼슘에 대한 αS- casein과 β-casein의 보호작용을 상실하게 된다.
한편, 영양학적으로는 우유의 가열에 의해서 우유단백질중의 필수아미노산인 lysine이 일부 불활성화하여 생리적 유효성을 상실하게 된다. 그러나 현재 시행되고 있는 정상적인 우유의 살균방법과 UHT 처리의 경우 lysine의 생리적 유효성 감소는 영양학적으로 무시해도 무방한 것으로 생각되고 있다.
실제로 생유, 살균유, UHT 처리유 및 병장멸균유로 랫드에 의한 가열우유의 단백질의 영양실험 결과에 의하면 영양학적으로 가열처리에 의한 유의차는 인정되지 않고 있다(병장멸균유는 제외).
또, 유아와 어린애의 경우에도 저온장시간 살균유와 UHT 처리유 사이에는 영양가와 질소평형에 유의차는 인정되지 않았다.
그러나 UHT 멸균유, 병장멸균 및 분유의 경우 고온에서의 장기저장에서는 단백질의 화학적 변화와 영양학적 변화는 무시할 수 없을 것으로 본다.