서 론
체지방의 과도한 축적으로 정의되는 비만은 관상동맥질환, 고혈압, 제 2형 당뇨병 및 암 등과 같은 심각한 질환과 연관이 있다(Mokdad et al., 2003). 비만치료의 가장 중요한 방법으로는 영양소 소화 및 흡수억제제 개발이다. 중성지방(Triglycerides, TG)은 칼로리가 높은 중요 에너지원 중 하나로서 TG 흡수억제는 비만과 관련한 질환과 직접적으로 연관된다(Carek and Dickerson, 1999). 췌장 지방분해효소(Pancreatic lipase)는 소장에서 TG를 흡수하는 효소로서 췌장에서 분비되고 TG를 가수분해한다(Lowe, 1994). 따라서 지방분해효소 억제를 통한 TG 흡수억제는 비만을 방지하는 중요 접근법이다. 또, 다른 치료 방법으로 탄수화물 가수분해효소인 알파 아밀라제 등의 억제를 통해 소화관에서의 포도당 흡수를 완화하는 것이다. 실제로 이 효소는 탄수화물 소화를 지연하고 탄수화물 소화시간을 연장케 한다(Chiasson, 2006; Chen et al., 2006) 특히, 우리나라 식습관은 탄수화물 위주의 식사를 하므로 비만을 개선하기 위해 기존의 지방흡수 억제뿐만 아니라 탄수화물 흡수억제를 동시에 하는 방법이 효과가 있을 것으로 보인다(Kim et al., 2003).
Probiotics는 숙주동물의 건강에 매우 유익한 효과를 주는 살아있는 유익한 미생물로, 고혈압 조절, 혈중 콜레스테롤 저하, 과민성 대장증후군 같은 위장관 질환의 개선 효과, 암 예방, 면역체계 조절, 지질대사 개선 등의 연구 결과가 보고되고 있다(Bhathena et al., 2009; Lye et al., 2009; Rafter, 2004; Baken et al., 2006; Kim et al., 2014; Kang et al., 2013). 게다가, 최근 국내 연구들에서 probiotics의 사용으로 인한 비만의 예방 효과가 보고되고 있다. Song 등(2013)은 삼정환이 지방 분화 억제 효과가 있었는데 이를 L. plantarum으로 발효시키면 그 효과가 더욱 증가하는 것으로 나타났다. Kim 등(2010)은 청국장에서 분리한 Baciilus subtilis KC-3를 이용한 발효두유를 3T3-L1 지방세포에 사용한 결과, 지방 생성을 억제하고 지방 축적을 효과적으로 감소하였다고 보고하였다. 또한 Moon 등(2012)의 보고에 의하면 김치에서 분리한 젖산균주인 Weissella koreensis OK1-6를 3T3- L1 세포의 지방전구세포 분화처리에 사용한 결과, 세포 내 지질 축적량이 상당히 작아졌다고 보고되었으며, Kwon 등(2004)은 고지방식이와 함께 김치 유산균 추출물 분말을 첨가한 결과, 체중 저하뿐만 아니라 복부지방의 축적을 억제하고 혈장 지질을 저하시키는 결과를 보고하였다. 미생물이 probiotic으로써 유익한 효과를 발휘하기 위해서는 여러 주요적인 특성을 지녀야 한다. Probiotic은 장내의 낮은 pH와 담즙산에 대한 내성을 지녀야 하고 안정성이 확보된 generally recognized as safe(GRAS) 미생물이어야 한다. 또한 숙주동물의 장 표피에 부착이 가능해야 하며, 병원균에 대한 항균성이 있고, 가공 및 저장 중 강한 생존 능력을 유지할 수 있어야 한다(Lin et al., 2006; Lonkar et al., 2005; Rial, 2000).
본 연구는 김치로부터 분리․선발된 Lactobacillus plantarum K6이 기능성 식품으로 적용할 수 있는지 알아보기 위해 L. plantarum K6의 비만 억제 효과와 생리적인 특성을 조사하였다.
재료 및 방법
각각 지역과 종류가 다른 김치 40종을 수거하여, 브롬크레졸 퍼플(Bromcresol purple)과 소듐아자이드(sodium azide)를 첨가한 변형 MRS 배지(Lim et al., 2011)에 0.1 mL씩 평면도말법으로 접종한 후 37℃에서 48시간 배양하고 균락을 변형 MRS 배지에서 순수 분리한 다음 노란색으로 변한 균락을 잠정적 젖산균으로 선발하였다. 선발된 균주는 전기 변형 MRS 배지에 도말한 후, 호기 배양하여 순수분리하였다. 순수 분리 후 Lactobacilli MRS broth (Difco, USA)에서 37℃, 18시간 배양한 다음 tryptic soy agar (Difco, USA) slant에 37℃에서 18시간 배양하여 보관하였다.
Lipase 억제활성은 Lee 등(2007)의 방법에 따라 Porcine pancreatic lipase (sigma, USA)를 이용하여 측정하였다. Porcine pancreatic lipase (sigma, USA)를 이용하여 lipase 활성저해 정도를 측정하였다. 균주 배양액에 0.08% p-nitrophenyl laurate (PNP; Sigma, USA) 용액, 0.1M Tris-HCl buffer (pH 8.5), 10 mg/mL lipase 용액과 함께 plate에 넣어 37℃에서 2시간 동안 반응시켰다. 반응 후 405 nm에서 absorbance를 측정하였으며, blank는 enzyme을 증류수로, control은 시료를 용매로 대체하였다. Lipase 억제활성은 다음의 식으로 구하였다.
Lipase inhibition activity (%) = {1-(A/B)}×100
A ; 시료의 absorbance, B ; control의 absorbance
α-Amylase 활성 저해능 측정은 Xiao 등(2006)의 방법을 변형시켜 본 실험에 이용하였다. α-Amylase를 0.1 g/10 mL 농도로 증류수를 이용해 희석시키고, 기질인 가용성 전분은 증류수로 0.5%로 제조한 후 시료와 혼합하여 25℃에서 10분간 반응시켰다. 0.1N HCl용액으로 반응을 정지시킨 후 iodine 용액을 이용하여 30분간 발색하여 660 nm로 흡광도를 측정하였다. 결과는 α-amylase만을 처리하였을 때와 시료를 혼합하여 처리하였을 때의 흡광도를 비교하여 나타내었다.
α-Amylase inhibitory activity(%) = {1-(A/B)}×100
A ; 시료의 absorbance, B ; control의 absorbance
α-Glucosidase 활성억제 효과 측정은 p-NPG (p-nitrophenyl α- Glucopyranoside)을 기질로 사용하는 Si 등(2010)의 방법을 이용하였다. 시료 50 uL를 0.75 unit/mL α-glucosidase 효소액 50 uL, 200 mM potassium phosphate buffer (pH 6.5) 50 uL와 혼합하여 37℃에서 10분간 preincubation한 후 0.1 M phosphate buffer (pH 7.0)에 녹인 3 mM p-NPG 100 uL를 가하여 37℃에서 10분간 반응시켰다. 0.1 M Na2CO3 750 uL로 반응을 정지시키고 405 nm에서 흡광도를 측정하였다.
α-Glucosidase inhibitory activity(%) = {1-(A/B)}×100
A ; 시료의 absorbance, B ; control의 absorbance
시료에 대한 세포 생존율은 Mosmann (1983)의 방법에 따라 MTT {3-(4,5-methylthiazol-2-yl)-2,5-diphenylte trazolium bromide} assay 방법으로 실험하였다. 세포는 16×104 cells/well의 농도로 96-well plate에 분주하고 24시간 배양 후 배지를 제거하였다. 여기에 새로운 Dulbecco’s modified Eagle’s medium (DMEM; Gibco, USA) 100 μL에 농도 별로 희석한 시료(10, 100, 1,000 μg/mL)를 각각 첨가하여 24시간 배양한 다음 5 mg/mL로 제조한 MTT (Sigma, USA) 용액 20 μL를 각 well에 첨가하고, 4시간 동안 배양하였다. 배양종료 후 상등액을 제거하고, 각 well에 100 μL의 dimethyl sulfoxide (DMSO)를 첨가하여 생성된 formazan 결정을 용해시켜 ELISA reader(BioTek, USA)로 550 nm에서 흡광도를 측정하였다. 시료에 대한 세포의 생존율은 다음의 식으로 구하였다.
Cell viability (%)= 100-(A-B)/A×100
A : Control의 absorbance, B : 시료 처리군의 absorbance
3T3-L1 세포배양 방법은 Hemati 등(1997)의 방법을 변형하여 사용하였다. 3T3-L1 지방전구세포는 미국 세포 은행 (American Type Culture Collection (ATCC), Manassas, VA)을 통하여 구입하였다. 실험에 사용한 3T3-L1 지방전구세포는 10% fetal bovine serum (FBS; Gibco, USA)과 1% penicillin-streptomycin (P/S; Gibco, USA)이 첨가된 DMEM 배지를 이용하여 37℃, 5% CO2/95% air가 공급되는 조건의 항온기(incubator)에서 배양하였다. 3T3-L1 지방전구세포를 분화 유도하기 위하여 세포를 6 well plate의 각 well에 1.25×105 cells/well로 분주하고 2일 후 배지를 교환하여 3~4일째에 세포가 완전히 융합상태가 되게 하였다. 융합상태에서 첫날에는 10% FBS와 MDI solution (0.5 mM 3-iso butyl-1-methylxanthine, 1 uM dexamethsone, 5 μg/mL insulin) (Sigma, USA)을 처리하여 분화를 유도하였고, 이때, 시료가 지방세포분화에 미치는 영향을 관찰하기 위해 시료를 농도별로 함께 처리하였다. 분화 유도 2일 후, 배지를 시료, 10% FBS, 1% P/S, 5 μg/mL insulin이 포함된 DMEM으로 교환하였고, 분화 유도 4일째부터는 시료와 함께 2일에 한번씩 10% FBS와 1% P/S가 포함된 DMEM으로 교환하여 세포를 분화시켜 8일간 지방을 유도한 지방세포에서 실험하였다.
세포 내 생성된 지질의 축적량은 세포 내 생성된 지방구와 특이적으로 반응하는 Oil Red O (Sigma, USA)를 사용하여 측정하였다. Oil-Red O 염색 방법은 Ramirez-Zacarias 등(1992)의 방법을 약간 변형하여 사용하였다. 먼저 지방 분화가 완료된 세포의 배지를 제거한 뒤에 세포를 PBS로 2번 세척하고, 10% formalin으로 4℃에서 1시간 동안 고정한 다음 증류수로 3번 세척하였다. 세척된 세포는 Oil Red O working solution (stock solution: 3.5 mg/mL in isopropanol; working solution: 60% oil red O stock solution and 40% distilled water)으로 30분 동안 실온에서 염색하였다. 염색 후, 염색액을 제거하고 증류수를 이용해 3번 세척한 다음 증류수를 well에 채우고 현미경으로 관찰하였다. 중성지방의 정량은 증류수를 제거하고, 완전히 마른 well에 100% iso-propyl alcohol을 2 mL 첨가하여 Oil-Red O를 다시 용출시킨 후 ELISA reader로 520 nm에서 흡광도를 측정하였다.
분리․선정된 K6 균주는 MRS 액체배지에서 2회 이상 계대 배양하여 활성을 높인 후 실험에 사용하였다. 젖산균의 동정은 Hammes 등(1992)의 방법에 의하여 실시하였다. 순수 분리된 균주는 Gram 염색, 포자생성, 호기적 및 혐기적 생장, Catalase 생성, 15℃ 및 45 ℃에서의 생장, glucose로부터 가스 생성, arginine으로부터 ammonia 생성을 측정하였으며, 현미경 관찰과 API 20 strep kit(API bioMerieux, France)를 이용한 당 발효 실험을 실시하였다. 젖산균의 DNA sequence 분석에는 universal primer 27F(5'-AGA GTT TGA TCC TGG CTC AG-3')와 1492R(5'-GGT TAC CTT GTT ACG ACT T-3')를 사용하였으며, solgent EF-Taq을 사용하여 PCR을 실시하였다. 증폭과정은 95℃, 15분을 한 후 95℃, 20초; 50℃, 40초; 72℃, 1분 30초를 30회 시행하였으며, 72℃, 5분으로 마무리 하였다. 서열 분석은 PCR product를 solgent PCR purification kit (SolGent, Korea)로 purify한 후 ABI 3730XL DNA sequencer (Applied Biosystems, USA)로 자동 분석하였다.
항생제 내성 시험은 MRS 액체배지에 L. plantarum K6 균주를 접종하고, 37℃에서 18시간 배양한 후 0.1% peptone 용액에 적정농도로 희석하였다. 각 항생제가 각 농도 별로 포함된 tryptic soy 액체배지에 105~106 CFU/mL 수준으로 접종하고 37℃에서 48시간 배양한 후 육안으로 관찰하여 생장 여부를 결정하였다. 항생제 내성 측정은 2배 희석방법을 사용하였으며, 억제된 가장 낮은 농도를 MIC(Minimal inhibitory concentration) 값으로 결정하였다. 항생제는 Sigma (USA)로부터 구매하여 사용하였다. 항생제는 Amikacin, Gentamicin, Kanamycin, Streptomycin, Ampicillin, Penicillin-G, Oxacillin, Bacitracin, Polymyxin B, Ciprofloxacin, Tetracycline, Clindamycin, Erythromycin, Rifampicin, Vancomycin 및 Chloramphenicol을 시험에 사용하였다.
MRS 액체배지에서 37℃, 18시간 동안 배양한 L. plantarum K6 균주를 생리식염수로 희석하여 105~106 CFU/mL 수준의 시료를 조제한 후, API ZYM kit (API bioMerieux, Lyon, France)를 이용하여 37℃에서 5시간 배양한 다음 효소반응시켰다. 효소활성은 표준색상표를 비교하여 0~5의 수치로 표시하였으며, 대조구 이외의 alkaline phosphatase, eterase(C4), esterase lipase(C8), lipase(C14), leucine arylamidase, valine arylamidase, cystine arylamidase, trypsin, chymotrypsin, acid phosphatase, naphthol-AS-BI-phosphohydrolase, α-galactosidase, β-galactosidase, β-glucuronidase, α-glucosidase, β-glucosidase, N-acetyl-β-glucosaminidase, α-mannosidase, β-fucosidase 효소의 활성을 측정하였다.
Gilliland와 Walker (1990)의 방법에 따라 MRS 액체배지에서 37℃, 18시간 배양된 L. plantarum K6 균주를 0.05% cysteine이 함유된 MRS 액체배지에 0.3% oxgall을 첨가한 배지와 대조구로서 oxgall을 첨가하지 않은 배지에 각각 1% 접종하였다. 37℃의 incubator에서 7시간까지 혐기배양하면서 시간별로 BCP plate count agar 평판에서 부어 굳힌 후 37℃에서 48시간 혐기배양하여 계수하였다.
Clark 등(1993)의 방법에 따라 37% HCl을 증류수에 섞어 pH 2, 3, 4 용액과 대조구로서 pH 6.4 용액을 제조하였고, 제조된 pH 용액 10 mL에 0.05% cysteine이 함유된 MRS 액체배지에서 37℃, 24시간 배양된 L. plantarum K6 균주(약 109 CFU/mL)를 1 mL씩 섞은 후 37℃에서 혐기 배양하면서 0, 1, 2, 3시간 후의 생균수를 BCP plate count agar 평판에서 부어 굳힌 후 37℃에서 48시간 혐기배양한 다음 계수하였다.
Gilliland와 Speck(1977)의 방법에 따라 항균력 측정에 사용한 지시균인 Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes 및 Staphylococcus aureus는 한국식품연구원으로부터 분양받았으며, 지시균의 증식배지로서 Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes,Staphyloccous aureus는 nutriunt 액체배지에서 호기적으로 37℃, 24시간 배양하였다. 혼합배양 및 대조군에 사용된 배지는 MRS 액체배지로서 젖산균과 지시균을 각각 접종하여 37℃에서 24시간 배양하였다. 선택배지로서 Escherichia coli는 EMB agar, Salmonella Typhimurium은 Bismuth sulfite agar, Listeria monocytogenes는 Supplement(X123)가 함유된 Listeria Isolation Agar,Staphyloccous aureus는 Baird parker agar를 사용하여 37℃에서 6시간 배양하였다. 젖산균에 의한 지시균의 억제율은 다음의 식으로 구하였다.
Inhibition (%) = (대조군의 균수 CFU/mL-혼합배양 후의 균수 CFU/mL)/대조군의 균수 CFU/mL
실험에 사용한 HT-29 세포는 한국세포주은행(Seoul, Korea)을 통하여 구입하였고, Kim 등(2008)의 방법에 따라 10% fetal bovine serum (FBS; Gibco, USA)과 1% penicillin-streptomycin (P/S; Gibco, USA)이 첨가된 RPMI 배지를 이용하여 37℃, 5% CO2/95% air가 공급되는 조건의 항온기(incubator)에서 배양하였다. HT-29 세포를 배양하기 위하여 세포를 12 well plate의 각 well에 106 cells/well로 분주하고, 2일에 한 번씩 배지를 교체해 주며, 실험 전날, 95%까지 세포가 찼을 때 serum free medium으로 교체하여 cell이 더 이상 차는 것을 막아주었다. 균주의 장 내 부착능을 실험하기 위해 2차 계대배양한 균주 1 mL를 취해 12,000 rpm에서 3분간 원심분리하고 serum free medium을 이용해 두 번 세척하였다. 세척한 균주를 RPMI 배지로 희석하여 600 nm에서 흡광도를 측정하여 0.5값이 나오도록 맞춘 후 0.1% peptone 용액으로 희석한 다음 BCP plate count agar에 pouring 하여 초기 균수를 측정하였다. OD 값을 맞춘 균체 100 mL를 well에 분주한 후 37℃, 5% CO2에서 2시간 배양한 뒤 PBS를 이용해 붙지 않은 균을 5번 세척해 준다. Trypsin-EDTA 1 mL를 첨가하여 cell-bacteria를 떼어낸 후 0.1% peptone 용액으로 희석한 다음 BCP plate count agar에 pouring하여 균수를 측정하였다.
아미노산 전구체(L-Tyrosine disodium salt, L-Histidine monohydrochloride monohydrate, L-Ornithine monohydrochloride, L-Lysine monohydrochloride)를 0.1% 첨가한 MRS broth를 만든 다음 18시간 배양한 Lactobacillus plantarum K6균주 1% 접종한 뒤 5~10번 교대 배양하여, decarboxylase 효소를 활성화시켰다. Bover-Cid and Holzapfel(1999)에 의해 고안된 decarboxylase media에 효소 활성화된 균을 도말하고 37℃에서 24~48시간 배양 후 보라색으로 변함을 통하여 BA 생성균을 판별하였다.
결과 및 고찰
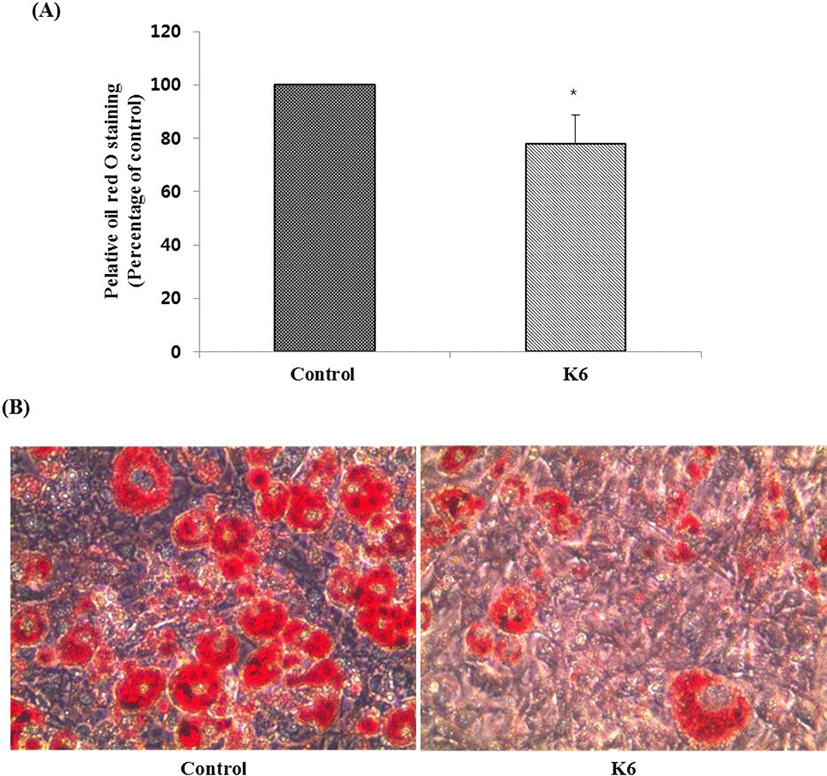
분리된 젖산균을 대상으로 α-amylase 억제활성, α-glucosidase 억제활성, lipase 억제활성을 측정한 결과 K6 균주가 각각 96.78± 3.29%, 92.55±9.62%, 85.17±0.79%로서 가장 높은 억제 활성을 나타내었다(Table 1). K6 균주가 3T3-L1 세포에 세포독성을 나타내는지 측정하기 위해 MTT assay를 수행한 결과 100 μg/mL 농도수준 이하에서 세포의 생존력에 영향을 주지 않아 세포독성이 없는 것으로 나타났다(데이터 생략). 따라서 분화 과정에서 3T3-L1 세포에 100 μg/mL 농도로 K6 균주를 첨가하였다. 분화가 끝난 후, 세포 내에 생성된 지방구를 Oil-Red O 염색액으로 염색하여 현미경으로 관찰한 결과, 분화배지만 처리한 군에 비해서 균주를 처리한 군의 염색된 지방구 수가 농도의존적으로 감소하는 것을 확인할 수 있었다. 이를 용출하여 520 nm에서 흡광도를 측정한 결과 각각 대조군 대비 22.3%의 지방 분화 억제율을 보였다(Fig. 1).
| Strain | α-Amylaseinhibition | α-Glucosidaseinhibition | Lipaseinhibition |
|---|---|---|---|
| K6 | 96.78±3.29 | 92.55±9.62 | 85.17±0.79 |
선발된 K6 균주의 genus와 species를 결정하기 위하여 생리적, 생화학적 시험을 하였다. 선발된 K6 균주는 Gram 양성을 나타내었고, 현미경으로 관찰 시 rod 형태의 homo균이며, 산소 유무와 상관없이 잘 생장하였고, catalase와 운동성은 음성으로 나타났다. 45℃와 15℃에서는 생장하지 않았으며, glucose와 arginine으로부터 각각 gas와 암모니아를 생성하지 않아 genus Lactobacillus에 속하였다(Table 2). Species를 정하기 위하여 API 50 CHL kit (Bio Mereux, France)를 이용하여 49종의 당 발효 시험을 실시한 결과(Table 3), K6 균주는 L-Arabinose 등 23종으로부터 산을 생성하였다. 그 결과를 ATB identification system에 입력한 결과, Lactobacillus plantarum으로 판명되었으며, 16S rRNA 유전자 부분을 universal primer를 이용한 PCR로 증폭하여 서열 분석하였다. 분석된 염기서열을 그대로 이용하여 BLAST search한 결과, L. plantarum (I.D. 99%)으로 동정되었고, Lactobacillus plantarum K6으로 명명하였다.
치료 목적으로 섭취된 항생제나 식품에 존재하는 항생물질에 의해서 probiotics 균주가 사멸될 경우에 생체 내에서의 기능성이 낮아지게 되는데, 이러한 측면에서 항생제에 대한 내성은 매우 중요한 요소로 인식되고 있는 실정이다(Charteris et al., 2001). 따라서 시중에서 이용되고 있는 총 16가지의 항생제에 대해 L. plantarum K6 균주가 내성이 있는지를 Table 4에 나타내었다. 그 결과, vancomycin에 대한 항생제 내성의 MIC 농도가 2,048 μg/mL로서 가장 내성이 높았고, ampicillin, polymyxin B 순이었다. 반면, erythromycin에 대한 MIC 농도는 0.125 μg/mL로서 가장 감수성이 높았고, clindamycin, rifampicin 등도 감수성이 높은 것으로 나타났다. 균주의 항생제 내성은 균주마다 다양하게 나타난다(Mathur and Singh, 2005).
효소활성 또한 probiotics로 이용하기 전에 고려되어야 하는 주요 요소 중 하나이다. Probiotics는 우선 β-glucuronidase를 생성하지 않아야 하는데, 이는 Benzopyrene을 발암성 물질로 전환시키는 발암효소이기 때문이다(Borriello et al., 2003). 반면, lipase와protease, β-galactosidase와 같은 효소는 유당을 분해하여 유당을 소화시켜주는 이점을 가지고 있다(Kumar et al., 2012). L. plantarum K6의 효소활성 결과는 Table 5에서 보는 바와 같다. Leucine arylamidase와 β-galactosidase가 공히 3을 나타내 효소활성이 다른 효소들에 비해 높게 나타났으나, 전반적으로 효소활성이 높지 않은 것으로 나타났다. 유당을 glucose와 galactose로 분해시키는 유당분해효소인 β-galactosidase는 3을 나타내어 유당불내증 해소에 약간 도움이 될 것이라고 보여진다. 반면 발암 효소인 β-glucuronidase의 경우에도 효소활성이 0으로 나타나, 안전성이 있는 것으로 나타났다.
* A value ranging from 0 to 2 is assigned to the standard color: zero represents a negative; 5 represents a reaction of maximum intensity. Values 1 through 4 represent intermediate reactions depending on the level of intensity. The approximate activity may be estimated from the color strength: 1 corresponds to the liberation of 5 nanomoles, 2 to 10 nanomoles, 3 to 20 nanomoles, 4 to 30 nanomoles, and 5 to 40 nanomoles or more.
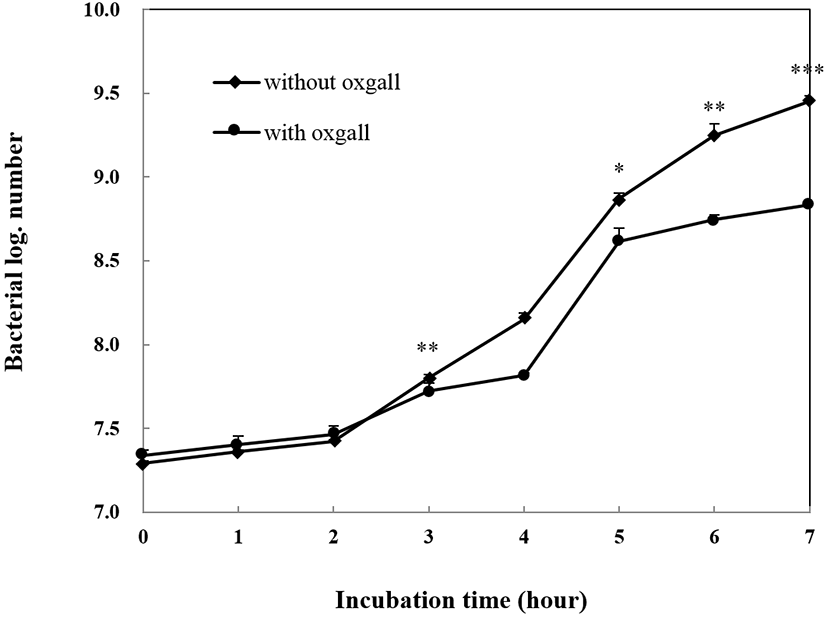
담즙 내성은 소장에서 살아남기 위해 꼭 지녀야 하는 특징 중 하나이다. 답즙산은 십이지장에서 분비되는 물질로 세균의 세포막을 파괴하여 성장을 억제하기 때문에 probiotics로의 기능을 하기 위해서는 담즙에 대한 내성을 지니고 있어야 한다(Gilliand and Speck, 1977; Saarela et al., 2000). 또한 적어도 0.3% 농도의 담즙산에서 생존해야지만 인간의 위 장간에서도 생존할 수 있다고 보고 있다(Gilliland et al., 1984). L. plantarum K6 균주의 담즙 내성 결과는 Fig. 2에서 보는 바와 같이 7시간 동안 배양 후 생균수를 비교해 보았을 때, 0.3% oxgall을 첨가하지 않았을 때의 생균수는 log 9.45 CFU/mL, 0.3% oxgall을 첨가하였을 때의 생균수는 log 8.84 CFU/mL로 약간 억제를 받기는 하였으나, 담즙 내성이 있는 것으로 나타났다.
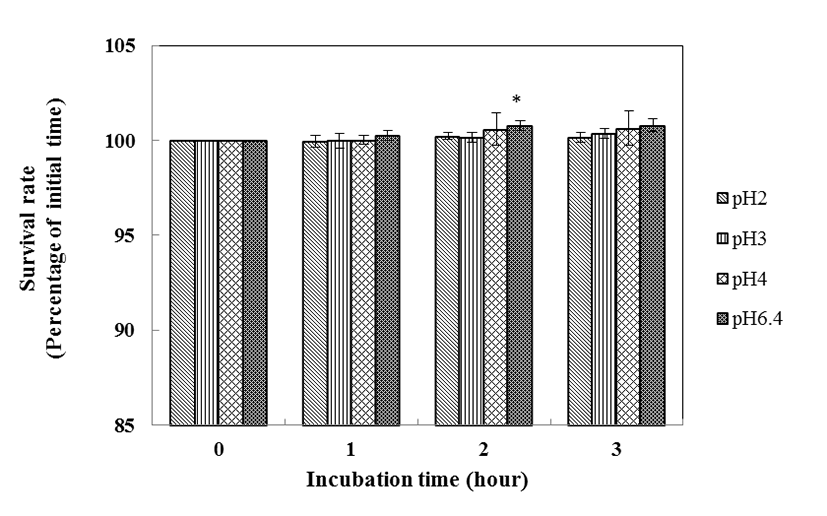
좋은 probiotics가 되기 위해서는 적어도 pH 3보다 낮은 pH에서 생존하여 위 장관을 통과하고, 소장 내로 도달하여야만 한다(Booth, 1985; Mcdonald et al., 1990). 위액의 pH는 pH 0.9이지만 음식을 섭취하였을 경우 위의 pH는 pH 3까지 올라가기 때문이다(Erkkila and Petaja, 2000). 산에 대한 L. plantarum K6의 내성 결과는 Fig. 3에서 보는 바와 같다. 대조구인 pH 6.4에서의 균수와 비교한 결과, L. plantarum K6 균주는 pH 3과 pH 4에서 생존율 감소를 보이지 않았을 뿐만 아니라 pH 2에서 0시간에는 생존율이 100%이던 것이 3시간 이후에도 100%로 변함이 없었다. Pennacchia 등(2004)의 실험에서 젖산균을 pH 2.5의 PBS에 3시간 동안 37℃에서 배양한 결과 60~80%의 생존율을 보인 결과와 비교해 보았을 때, L. plantarum K6 균주는 내산성 실험에서 우수한 결과를 보였다.
L. plantarum K6가 식중독균에 대해 어느 정도 억제하는지를
측정하기 위해 혼합배양을 실시한 결과는 Table 6과 같다. L. plantarum K6은 Escherichia coli,Salmonella Typhimurium, Listeria monocytogenes, Staphyloccous aureus에 대해 각각 51.8%, 42.4%, 61.6%, 54.9%로서 Listeria monocytogenes에 대해 가장 억제효과가 있는 것으로 나타났다. 배양 후 pH의 변화를 보았을 때 대조구인 식중독균은 pH 5.9이며, 혼합배양액은 pH 5.5~5.6로서 pH가 약간 감소하였지만 pH의 저하가 식중독균의 억제에 큰 영향은 미치지 않은 것으로 보인다. 균주의 항균력은 같은 종의 균주라 하더라도 병원균에 따라 각기 다른 정도를 보인다(Jacobsen et al., 1999; Larsen et al., 1993). Daeschel(1989)과 Havinaar 등(1992)은 pH 강하, 산화 환원 전위의 감소, 유해균과의 경쟁적 영양성분 소비, 과산화수소의 생성, 젖산균이 생산하는 유기산과 박테리오신의 살균 작용과 강한 항균 활성 물질 분비에 의해 젖산균의 항균 효과가 나타낸다고 보고하였다. 본 실험에서 L. plantarum K6에 의한 Escherichia coli와 Salmonella Typhimurium, Listeria monocytogenes, Staphyloccous aureus의 생육 억제는 이러한 억제 요소들의 작용에 기안하는 것으로 사료된다.
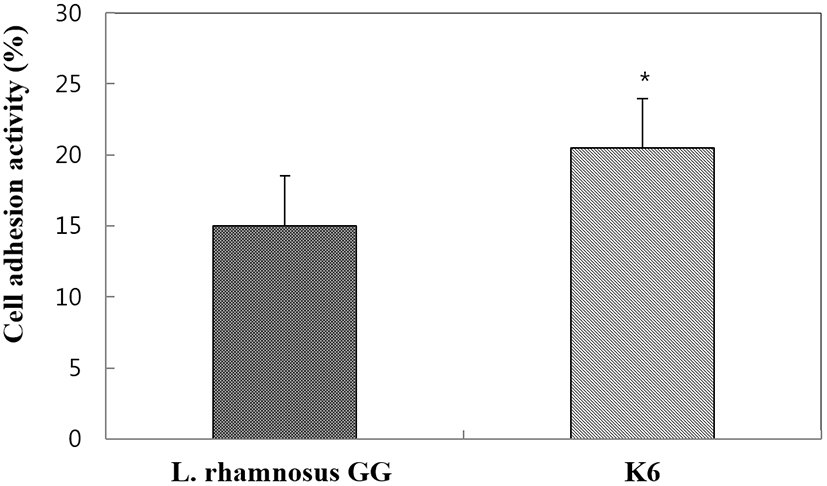
숙주의 장 상피세포 부착능은 프로바이오틱 균주 선발의 주요 기준 중 하나이다. 프로바이오 틱스의 점막 부착시간 연장은 위장 면역계와 숙주의 균총에 영향을 끼칠 수 있다. 따라서 장표면의 부착능은 프로바이오틱 균주의 효율성과 일치하는 것으로 사료된다(O’halloran et al., 1997). Fig. 4에서 보는 바와 같이 L. plantarum K6는 20.50%가 HT-29 cell에 부착된 반면, 양성 대조구로 사용된 L. rhamnosus GG 균주는 14.97%가 부착되었다. 많은 일련의 연구에서 L. rhamnosus GG는 상피세포에 부착능력이 우수한 것으로 알려지고 있다(Gopal et al., 2001). 따라서 L. plantarum K6 균주는 상피세포 표면에 부착능이 우수한 것으로 나타났다.
바이오제닉 아민은 생선제품, 고기, 치즈, 와인 및 기타 발효식품 등에서 광범위하게 나타난다(Vidal-Carou et al., 1990; Izquierdo-Pulido et al., 1994). 아민은 통상적으로 아미노산의 탈카르복실화에 의해 식품에서 생성되는데, 아민 생성은 산성환경에 대해 미생물의 보호메카니즘과 연관되어 있다(Vandekerckove, 1977). 젖산균은 산성과일주스 및 와인에서 성장할 수 있어 안전한 것으로 인식되고 있지만 젖산균의 대사활동은 바이오제닉 아민을 형성할 수 있다. Table 7에서 보는 바와 같이 Putrescine, Tyramine, Histamine, Cadaverine 모두 음성을 나타내어 안전한 것으로 나타났다.
| Strain | Biogenic amines | |||
|---|---|---|---|---|
| Putrescine | Tyramine | Histamine | Cadaverine | |
| K6 | - | - | - | - |
요 약
본 연구는 김치로부터 비만 억제능력이 있는 젖산균을 분리 및 동정하고, 이 균주의 생리적 특성을 규명하여 상업적으로의 이용가능성을 검토하고자 실시하였다. 이를 위해 Modified MRS 분별배지를 사용하여 노란색 집락을 형성하는 균주를 대상으로 각각 α-amylase inhibitory activity, α-glucosidase inhibitory activity와 lipase inhibitory activity가 우수한 균주를 선발한 결과 K6 균주가 최종 선발되었다. K6 균주는 α-amylase 억제활성 96.78±3.29%, α-glucosidase 억제활성 92.55±9.62%, lipase 억제활성 85.17± 0.79%, 지방분화 억제활성 27.4±1.4%로 나타났으며, 동정결과 Lactobacillus plantarum으로 판명되었고, Lactobacillus plantarum K6으로 명명하였다. L. plantarum K6은 답즙산과 산성의 pH에서 모두 우수한 생존력을 나타내었고, 효소활성은 전반적으로 낮았으나 arylamidase와 β-galactosidase에 대해 비교적 높은 효소 활성을 나타내었다. 항생제 내성 실험 결과 vancomycin, ampicillin, polymyxin B에 내성이 있는 반면 erythromycin에 감수성을 나타냈으며, Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes와 Staphyloccous aureus에 대해 각각 51.8%, 42.4%, 61.6%와 54.9%의 억제 효과를 지니고 있는 것으로 나타났다. 또한, 아민을 생성하지 않으며, 장부착성은 대조구인 L. rhamnosus GG보다 우수하였다.






