ARTICLE
Sialic Acid를 지표성분으로 하는 유청가수분해단백분말의 기능성식품 개발연구
- I. 효소분리로 7% Siailc Acid가 표준적으로 함유된 유청가수분해단백분말(7%)의 랫드를 이용한 90일 반복경구투여 독성시험 평가 연구 -
노혜지1,*, 조향현1, 김희경1
Development and Research into Functional Foods from Hydrolyzed Whey Protein Powder with Sialic Acid as Its Index Component
- I. Repeated 90-day Oral Administration Toxicity Test using Rats Administered Hydrolyzed Whey Protein Powder containing Normal Concentration of Sialic Acid (7%) with Enzyme Separation Method -
Hye-Ji Noh1,*, Hyang-Hyun Cho1, Hee-Kyong Kim1
Author Information & Copyright ▼
1MEDINUTROL Co., Yeonggwang 57024, Korea
*Corresponding Author : Hye-Ji Noh, MEDINUTROL Co., Yeonggwang 57024, Korea. Tel.: +82-61-352-2166, Fax: +82-61-352-2167, E-mail :
hyeji124@naver.com
ⓒ Copyright 2016, Korean Society of Milk Science and Biotechnology. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 1, 2016 ; Revised: Jun 19, 2016 ; Accepted: Jun 22, 2016
Published Online: Jun 30, 2016
Abstract
We herein performed animal safety assessment in accordance with Good Laboratory Practice (GLP) regulations with the aim of developing sialic acid from glycomacropeptide (hereafter referred to as “GMP”) as an index ingredient and functional component in functional foods. GMP is a type of whey protein derived from milk and a safe food, with multiple functions, such as antiviral activity. A test substance was produced containing 7% (w/w) sialic acid and mostly-hydrolyzed whey protein (hereafter referred to as “7%-GNANA”) by enzymatic treatment of substrate GMP. The maximum intake test dose level was selected based on 5,000 mg/kg/day dose set for male NOEL (no-observed-effect-level) and female NOAEL (no-observed- adverse-effect-level) determined by a dose-range finding (DRF) test (GLP Center of Catholic University of Daegu, Report No. 15-NREO-001) that was previously conducted with the same test substance. To evaluate the toxicity of a repeated oral dose of the test substance in connection with the previous DRF study, 1,250, 2,500, and 5,000 mg/kg of the substance were administered by a probe into the stomachs of 6-week-old SPF Sprague-Dawley male and female rats for 90 d. Each test group consisted of 10 male and 10 female rats. To determine the toxicity index, all parameters, such as observation of common signs; measurements of body weight and food consumption; ophthalmic examination; urinalysis, electrolyte, hematological, and serum biochemical examination; measurement of organ weights during autopsy; and visual and histopathological examinations were conducted according to GLP standards. After evaluating the results based on the test toxicity assessment criteria, it was determined that NOAEL of the test substance, 7%-GNANA, was 5,000 mg/kg/day, for both male and female rats. No animal death was noted in any of the test groups, including the control group, during the study period, and there was no significant difference associated with test substance, as compared with the control group, with respect to general symptoms, body weight changes, food consumption, ophthalmic examination, urinalysis, hematological and serum biochemical examination, and electrolyte and blood coagulation tests during the administration period (P<0.05). As assessed by the effects of the test substance on organ weights, food consumption, autopsy, and histopathological safety, change in kidney weight as an indicator of male NOAEL revealed up to 20% kidney weight increase in the high-dose group (5,000 mg/kg/day) compared with the change in the control group. However, it was concluded that this effect of the test substance was minor. In the case of female rats, reduction of food consumption, increase of kidney weight, and decrease of thymus weight were observed in the high-dose group. The kidney weight increased by 10.2% (left) and 8.9% (right) in the high-dose group, with a slight dose-dependency compared with that of the control group. It was observed that the thymus weight decreased by 25.3% in the high-dose group, but it was a minor test substance-associated effect. During the autopsy, botryoid tumor was detected on the ribs of one subject in the high-dose group, but we concluded that the tumor has been caused by a naturally occurring (non-test) substance. Histopathological examination revealed lesions on the kidney, liver, spleen, and other organs in the low-dose test group. Since these lesions were considered a separate phenomenon, or naturally occurring and associated with aging, it was checked whether any target organ showed clear symptoms caused by the test substance. In conclusion, different concentrations of the test substance were fed to rats and, consequently, it was verified that only a minor effect was associated with the test substance in the high-dose (5,000 mg/kg/day) group of both male and female rats, without any other significant effects associated with the test substance. Therefore, it was concluded that NOAEL of 7%-GNANA (product name: Helicobactrol) with male and female rats as test animals was 5,000 mg/kg/day, and it thus was determined that the substance is safe for the ultimate use as an ingredient of health functional foods.
Keywords: glycomacropeptide (GMP); sialic acid; animal safety assessment; food material development
서 론
Glycomacropeptide(이하 GMP)는 안전식품인 우유를 원료로 치즈를 제조하고 남은 부산물인 유청단백질에서 분리 및 분말화 과정을 거쳐 생산 및 국내외적으로 식품 및 식품첨가물로 판매되고 있다.
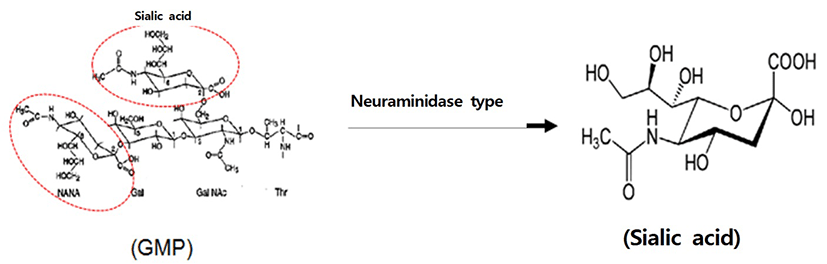
GMP는 우유 속 단백질의 일종인 κ-casein에 chymosin의 작용으로 105번 Phe와 106번 Met 사이의 펩타이드 결합이 절단되어 생성되는 C-말단 63개의 펩타이드를 의미하며, 생산 방법에 따라 당과 인의 함량에 상당한 차이를 가진다고 한다(Yoon et al., 2000). GMP는 Vibrio cholera와 Escherichia coli의 enterotoxins과 부착하는 능력을 가지고 있고, Bifidobacterium의 생장을 촉진하며, 박테리아와 바이러스의 장기와의 접착을 억제하는 효능을 가지고 있다(Brody, 2000). 또한 chymosin에 의하여 κ-casein의 phenylalanine-methione peptide bond가 절단되면 친수성의 GMP가 유리되는데, N-acetylneuraminic acid (sialic acid), galactose(gal), N-acetylgalactosamine(GalNAc)의 3개의 당이 3개 또는 4개가 연결된 형태로 Thr나 Ser 잔기에 연결되어 있는데, 이때 말단에 위치한 sialic acid를 자르는 효소를 neuraminidase라고 한다(Fig. 1). Silaic acid는 nine-carbon sugar family에 속하는 단당으로 세포나 수용성 단백질에 당사슬 형태로 부착되어 있으며, 고등동물의 세포나 미생물에서 glucose로부터 복잡한 과정을 거쳐 생성된다(Moon et al., 2005; Wang and Brand-Miller, 2003). Sialic acid는 우리 몸 속의 수용기의 인지, 신경 신호전달 등에 역할을 하며, 뇌의 ganglioside의 구조와 기능에 역할을 하는 구성 물질이고(Wang and Brand-Miller, 2003; Wang and Springer-Verlag, 1984; Wang et al., 2001), 뇌의 발달과 인지능력에 중요한 역할을 하는 필수 성분으로 영아기에 섭취는 기억과 학습 능력 향상에 역할을 하는 것으로 알려져 있다(Wang et al., 2001; Wang, 2009; Wang et al., 2007). 이 밖에도 항염증 효과나 몸속의 과산화수소 제거에 역할을 한다고 알려져 있어 현재 기능성 식품으로 연구되어지고 있다(Gorog and Kovacs, 1978; Iijima et al., 2004). Sialic acid는 현재 대부분 재조합 E. coli에서 합성되거나, E. coli로부터 생산된 효소를 이용해 N-acetyl-D-glucosamine으로 부터 합성되며, 일부가 화학적 합성방법으로 생산되고 있다(Ishikawa and Koizumi, 2010; Zimmermann et al., 2007). Sialic acid는 대부분 의료용 소재로 활용되고 있으며, 유청단백질에서 분리한 sialic acid를 식품산업에 적용된 예는 국내외적으로 아직까지는 없다. 본 연구에서는 식품첨가물로 사용되고 있는 유청 단백질의 일종인 GMP 내 결합되어 있는 sialic acid를 식품으로서 활용성을 높이기 위하여, 효소분리 과정을 거쳐 시험물질인 7%-GNANA를 제조하였다. Sialic acid는 생리 및 약리적 효능을 나타내며, 활용도를 증가시키기 위한 효능 연구가 진행되고 있다고 할지라도 소재에 대한 안전성자료 확보는 무엇보다도 중요하다고 할 수 있다. 특히 Sialic acid를 효소분리시켜 제조한 유청가수분해단백분말을 식품원료로 사용하거나, 식품공전이나 기능성 식품공전에 등록을 위해서는 독성시험을 통한 안전성 자료가 필수적이다. 따라서 본 연구에서는 시험물질인 7%-GNANA의 안정성 평가의 일환으로 반복투여 시 나타날 수 있는 독성의 질적, 양적인 평가를 위해 “의약품 등의 독성시험관리기준(식품의약품안전처 고시 제2014-136호)(Ministry of Food and Drug Safety(KFDA), 2014)”과 “OECD test guideline(Organization for Economic Co- operation and Development(OECD), 2008)”에 준하여 90일 반복경구투여 독성시험을 실시하였으며, 유청가수분해단백분말에 대한 일반 독성의 특성을 평가하였다.
재료 및 방법
1. 시험물질 준비
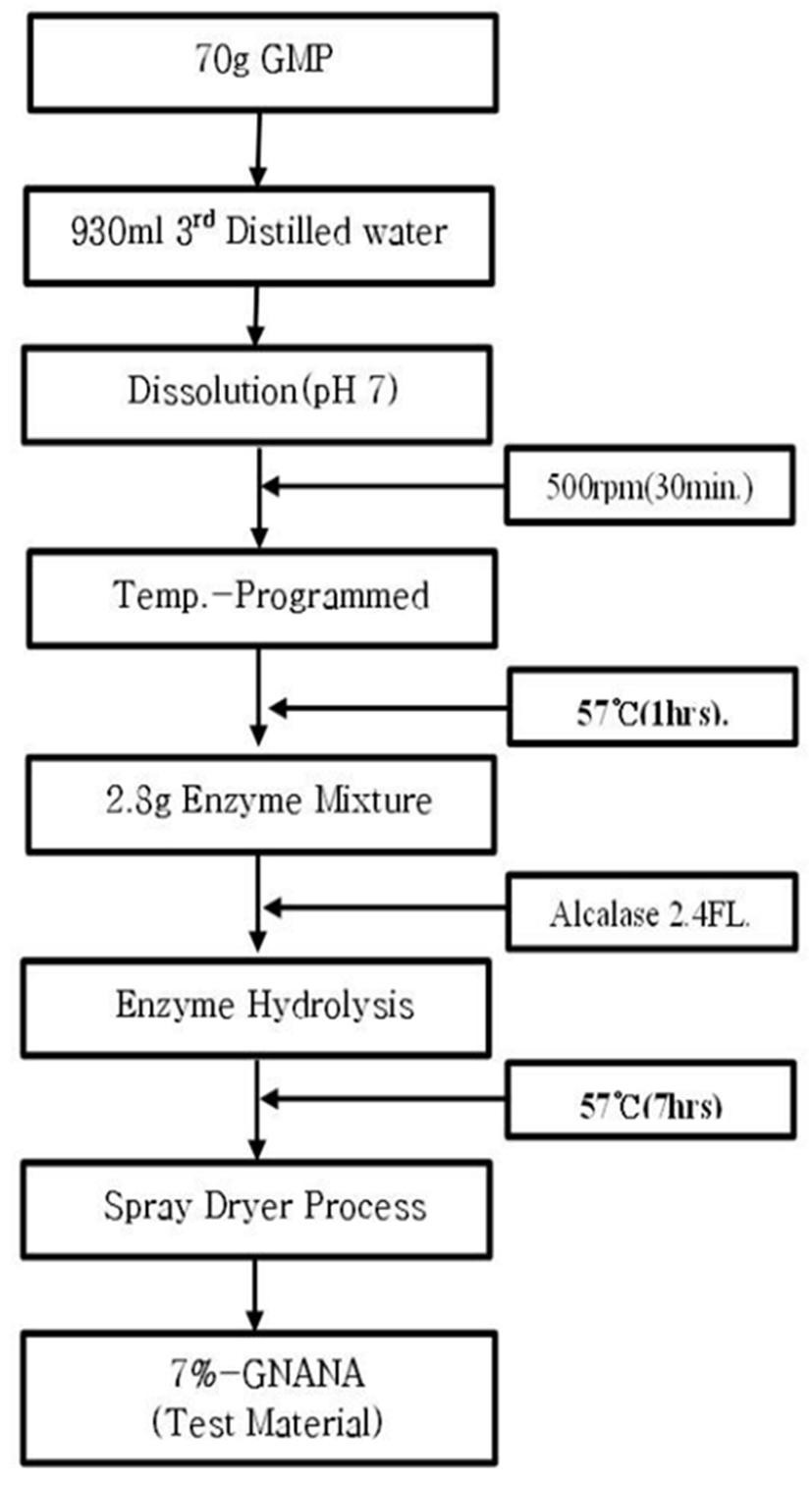
GMP는 sialic acid가 7%가 결합된 형태로 판매되는 NatraPep GMP(Murry Goulburn Co-Operative Co., Australia)을 구입하여 시험물질 제조를 위한 원료로 사용하였다. 시험물질 제조는 원료 GMP를 우선 정제수에 7%(w/v)로 용해시킨 후, Alcalase 2.4FL(Novozymes Co., Denmark) 효소를 원료 대비 0.2%(w/v)로 혼합 및 57℃에서 1시간 동안 가수분해시킨 용액을 동결분말로 제조한 7%-GNANA(제품명: HELICOBACTROL-7)을 한일바이오메드사(한국)로 공여 받아 시험물질로 사용하였다(Fig. 2).
Fig. 2.
Content evaluation results of sialic acid in hydrolyzed whey protein (7%-GNANA), a test substance, applying the HPLC analysis method compared to standard sialic acid. A: Standard sialic acid (10 ppm), B: Sialic acid content in 7%-GNANA (10 ppm).
Download Original Figure
2. 시험물질 내 지표성분 Sialic acid 분리 및 함유량 검정
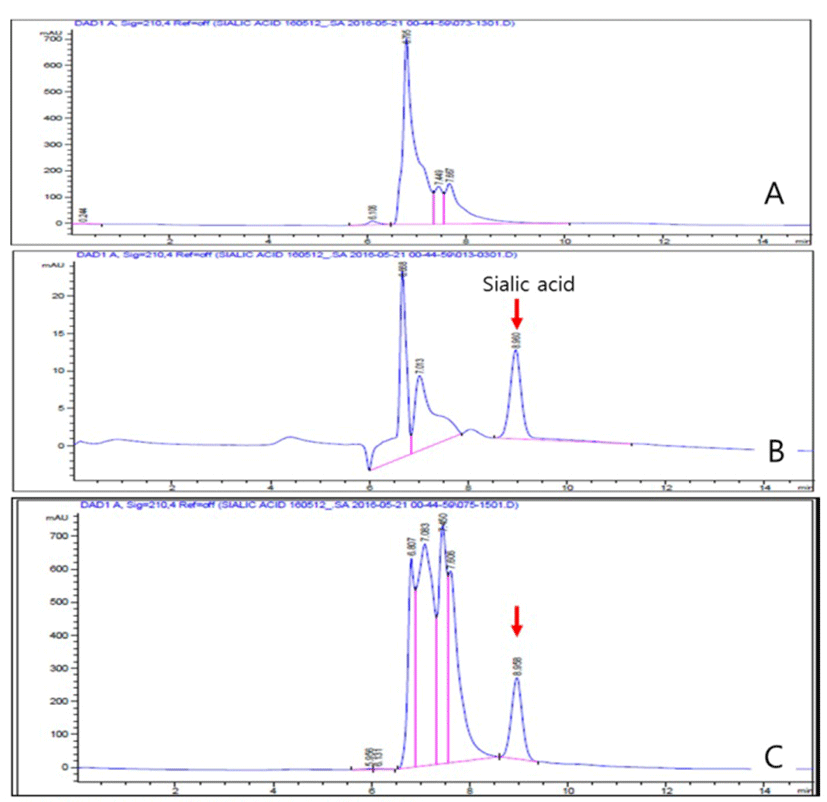
10 mM Sodium Acetate Buffer 용액에 시험물질인 7%-GNANA를 완전히 용해시킨 후, 에탄올 8 mL에 희석액 2 mL를 혼합한 후 sonication(25℃) 및 원심분리(3,000 rpm×20 min, 25℃)과정을 거쳐 상등액만을 0.22 μm membrane으로 여과 후 이를 최종 HPLC System(Agilent 1260, USA) 시료로 사용하였다. 시험물질 내 지표성분인 sialic acid의 분리 여부 및 함유량 검정을 위한 표준체 sialic acid는 Sigma-Aldrich사(A2090)의 것을 구입하여 0.1 ppm(w/w), 1 ppm 및 10 ppm 되게 희석하여 분석간 표준용액으로 사용하였다(Table 1). 시험물질 내 sialic acid의 분리효율 및 함유량 검정을 위한 표준체는 Sigma- Aldrich사(A2090)의 것을 구입하여 0.1 ppm(w/w), 1 ppm 및 10 ppm 되게 희석하여 표준용액으로 사용하였다. 분석간 검출허용 표준편차는 90~110% 범위 내에서 평가하였다(Fig. 3).
Fig. 3.
Result of evaluation for sialic acid in 7% G-NANA, a test substance, vs. the standard sialic acid applying the HPLC analysis method. A: Standard siaic acid (10 ppm), B: Sialic acid content (10 ppm) inside test substance.
Download Original Figure
Table 1.
HPLC operation conditions for analysis of sialic acid
| 1. HPLC system(Agilent 1260) |
2. Analysis conditions |
∙Pump: G1311C
∙Auto sampler: G1329B
∙Column: G1316A
∙UV detector: G1314F |
∙Wavelength: 205 nm
∙Column: Aminex® HPX-87H Ion Exclusion Column(300×7.8 mm, 9 μm, Bio-Rad Co.)
∙Mobile phase: 10 mM H2SO4
∙Running time: 20 min
∙Flow rate: 0.5 mL/min
∙Injection volume: 10 μL
∙Temperature: 40℃
∙Standard sol.(w/w): Silaic acid 0.1 ppm, 1 ppm, 10 ppm |
Download Excel Table
3. 실험동물 및 시험방법
2) 실험동물 및 시험방법
시험동물은 5주령의 SPF Sprague-Dawley 계통의 암수 랫드를 대한바이오링크(한국)로부터 구입한 후 7일간의 검역과 순화 과정을 거쳐 건강한 암․수 각각 40마리를 선발하여 암․수 4군으로 하고, 시험군당 10마리를 시험에 사용하였다. 사육환경 및 운영은 시험법을 준수하여 실시하였다.
3) 시험군 구성 및 투여용량
투여용량 설정은 4주 반복경구투여 용량범위설정(dose-range finding, DRF) 독성시험의 결과인 암수 랫드의 NOEL 5,000 mg/kg/day를 적용하였다. 본 시험에서는 멸균생리수를 섭이 시킨 대조군과 투여군은 5,000 mg/kg/day(고용량군)를 최고용량으로, 2,500(중용량군) 및 1,250(저용량군) mg/kg/day로 설정하였다. 시험물질인 23%-GNANA의 투여는 임상 적용 경로인 경구로 이루어졌다.
4) 일반증상 및 사망률
투여 당일은 투여 후 1시간부터 6시간까지 관찰하였고, 투여 다음날부터 투여 및 관찰기간 동안 매일 2회 모든 동물에 대해 일정한 시간에 사망 여부, 일반증상의 종류, 발현일 및 증상의 정도를 개별적으로 관찰하여 기록하였다.
5) 체중 변화
투여 개시 전에 체중을 측정하였고, 이후에는 주 1 회, 부검 전날 및 부검일에 측정하였다. 부검일의 체중은 부검 전일에 하루 밤 절식시킨 후의 체중을 측정하였다. 사료섭취량 측정 주기는 체중 측정과 시기적으로 일치하게 이루어졌다.
6) 사료섭취량
투여 개시 전의 사료섭취량은 군 분리일부터 투여 개시 일까지 1일간의 섭취량을 측정하였다. 투여기간에는 7일간의 섭취량을 측정하여 1일의 평균섭취량을 산출하였다. 투여 13주째에는 6일간의 섭취량을 측정하여 1일의 평균섭취량을 산출하였다.
7) 요검사
요검사는 시험물질의 투여 마지막 주에 각 군당 5마리에 대하여 실시하였다. 동물을 대사 케이지에 수용하여 3~4시간 동안 채뇨한 신선뇨 중 약 1 mL를 취하여 요자동분석기(CliniTek AdvantusTM, SIEMENS, USA) 및 요침사 검사로 분석하였다. 또한 24시간 동안 계속 채집한 요로 요총량을 측정하였다. 요분석 항목은 요당(GLU), 빌리루빈(BIL), 케톤체(KET), 요비중(SG), 잠혈(OB), pH, 단백질(PRO), 유로빌리노겐(URO), 아질산염(NIT) 및 백혈구(LEU) 등을 검사하였다.
4. 요침사 검사
일반검사 후 남은 요를 1,500 rpm으로 5분간 원심분리(MF80, Hanil, Korea)한 후, 그 침전물을 S.M(Sternheimer-Malbin) 법으로 염색하여 RBC(red blood cell), WBC(white blood cell), Epithelial cell 및 Casts를 관찰하였다.
1) 안검사
동물 도입 시 모든 동물에 대하여 육안으로 눈의 외관을 관찰하였다. 투여 마지막 주에는 모든 동물을 육안으로 눈의 외관을 관찰한 후, 각 군당 5마리에 대해서는 안구에 산동제(한국알콘, Lot No.: 13C07K)를 점적하여 안저사진기(Genesis, Gowa Co. Ltd., Japan)로 전안부, 중간투광체 및 안저를 관찰하였다.
2) 혈액학적 검사
부검 시까지 생존한 모든 동물에 대하여 혈액학적 검사를 실시하였다. 혈액학적 검사는 랫드를 하룻밤 절식시킨 후 채혈한 혈액을 항응고제인 EDTA-2K가 들어있는 CBC bottle (Vacutainer 3mL, BD, USA)에 주입한 후 자동혈액분석기(ADVIA 2120, SIEMENS, USA)를 통해 이루어졌다. 분석항목은 백혈구(WBC)의 수, 적혈구(RBC)의 수, 혈색소량(HGB), 적혈구 백분율(HCT), 평균적혈구용적(MCV), 평균적혈구혈색소량(MCH), 평균적혈구혈색소농도(MCHC), 혈소판수(PLT), 적혈구 분포폭(RDW), 혈액소 분포폭(HDW), 망상적혈구(RET), 백혈구 백분비(NEU), LYM(Lymphocyte), MONO(Monocyte), EOS(Eosinophil) BASO(Basophil) 그리고 LUC(Large unstained cells) 등이었다.
3) 혈액생화학적 검사
혈액생화학적 검사를 위해 혈액 일부를 clot activator가 들어있는 vacutainer tube(BD, USA)에 주입하고, 15~20분간 상온에 방치하여 응고시켰다. 이 후 3,000 rpm으로 10분간 원심분리(MF80, Hanil, Korea)하여 얻은 혈청으로 혈액생화학분석기(KONELAB 20XT, Thermo, USA)를 사용하여 측정하였다. 측정항목은 Aspartate aminotransferase(AST), Alanine aminotransferase(ALT), Alkaline phosphatase(ALP), Blood urea nitrogen (BUN), Creatinine(CRE), Glucose(GLU), Total cholesterol(CHO), Total protein(PRO), Creatine phosphokinase(CPK), Albumin (ALB), Total bilirubin(BIL), Albumin/globulin ratio(A/G), Triglyceride(TG), Inorganic phosphorus(IP), Ca2+ 등이었다. 또한 Na+, K+, Cl- 등의 함량은 전해질 분석기(744 Na+/K+/Cl-Analyzer, SIEMENS, USA)로 측정하였다.
4) 혈액응고시간 검사
부검시 채혈한 혈액 중 1.8 mL를 3.2% sodium citrate 0.2 mL가 들어있는 vacutainer tube(Vacutainer 1.8 mL, BD, UK)에 주입한 후, 3,000 rpm으로 10분 동안 원심분리(MF80, Hanil, Korea)하여 얻은 혈장으로 PT(prothrombin time), APTT(activated partial thromboplastin time)를 측정하였다. 혈액응고시간검사기: K-98(ACL 7000 Instrumentation Laboratory, USA)을 사용하여 Nephelometric Analysis 방법으로 초(sec) 단위로 측정하였다.
5) 부검
부검 전날 절식한 랫드를 부검 당일에 isofluran으로 흡입 마취하여 복대동맥에서 혈액학적 검사 및 혈액생화학적 검사를 위한 채혈을 실시하였다. 이 후 복대동맥 및 복대정맥을 절단하여 방혈 치사시킨 다음, 모든 장기를 관찰하였다.
6) 장기중량 측정
부검 시 장기를 적출한 후 전자저울(CP-64, Sartorius, Ger)을 이용하여 중량을 측정하였다. 양측성 장기는 양측 장기 모두를 측정하였다. 측정 장기는 난소(ovary), 부신(adrenal gland), 뇌하수체(pituitary), 가슴샘(thymus), 전립샘(prostate), 고환(testis), 부고환(epididymis), 비장(spleen), 신장(kidney), 심장(heart), 폐 (lung), 뇌(brain) 및 간(liver) 등이었다.
7) 병리조직학적 검사
부검을 실시한 모든 동물에 대하여 장기를 적출하여 10% 중성완충포르말린용액에 고정하였으며, 또한 안구는 Davidson 용액에, 고환과 부고환은 Bouin 용액에 고정하였다.
고정 장기는 고환, 부고환, 정낭, 전립샘, 난소, 자궁, 질, 방광, 비장, 위, 췌장, 십이지장, 공장, 회장, 맹장, 결장, 직장, 장간막 림프절, 부신, 신장, 간, 대퇴골, 턱밑림프절, 침샘, 흉골, 가슴샘, 심장, 폐, 대동맥, 흉척수, 혀, 기관, 식도, 갑상샘, 안구, 하더샘, 뇌, 뇌하수체, 피부(젖샘) 등이었다. 고정한 장기 조직은 삭정, 탈수 및 파라핀 포매 등의 일반적인 조직처리과정을 거쳐 조직절편을 제작하였다. 이후 박절하여 Hematoxylin & Eosin(H & E) 염색을 실시하였다. 대조군 및 고용량군(5,000 mg/kg/day)의 모든 고정 장기 조직에 대하여 검경하였다.
Table 2.
Definitions of LOAEL, NOAEL and NOEL by three steps of weight-based classification in toxicity test
| Weight-based classification |
Definitions of criteria |
Criteria of toxicity |
Evaluation endpoints |
| Important compound-related changes |
․The lowest exposure level at which there are statistically or biologically significant increases in the frequency or severity of adverse effects between the exposed population and its appropriate control. |
Criteria oftoxicity |
LOAEL |
| Minor compound-related changes |
․The highest exposure level at which there are no statistically or biologically significant increases in the frequency or severity of adverse effects between the exposed population and its appropriate control.
․Some effects may be produced at this level, but they are not considered to be adverse or precursors to adverse effects. |
Non-adverseeffect |
NOAEL |
| Noncompound-related changes |
․The highest exposure level at which there are no effects (adverse or nonadverse) observed in the exposed population, when compared with its appropriate control. |
No effect |
NOEL |
Download Excel Table
5. 통계학적 분석
대조군과 투여군 간의 평균비교에는 모수적인 다중비교(parametric multiple comparison procedures) 혹은 비모수적인 다중비교(non parametric multiple comparison procedures)를 사용하였으며, 통계학적 분석은 상용으로 널리 사용되고 있는 통계 패키지인 SPSS 14.0을 이용하였다. 체중, 사료섭취량, 혈액학적 검사, 혈액생화학적 검사, 장기중량 등과 같은 연속적인 자료는 one-way ANOVA test로 평균치에 대한 유의성을 검정하였다. 유의성이 있으면 Levene test로 등분산성을 검정하여 등분산일 경우에는 Duncan multiple range test, 이분산일 경우에는 Dunnett’s T-test를 이용하였다. 요검사 결과와 같이 불연속인 자료의 분석 척도변환을 통해 중증도(severity)로 나타내어 통계분석이 이루어졌다(Table 3).
Table 3.
Table of severity values for statistical analysis by item of urinalysis signs during the 90 days oral administration of 7%-GNANA, a test substance to the rats
| Severity |
0 |
1 |
2 |
3 |
4 |
5 |
| GLU |
- |
+/- |
1+ |
2+ |
3+ |
4+ |
| BIL |
- |
+/- |
1+ |
2+ |
3+ |
|
| KET |
- |
+/- |
1+ |
2+ |
3+ |
4+ |
| SG (Specific gravity) |
1.005 |
1.010 |
1.015 |
1.020 |
1.025 |
1.030 |
| PRO |
- |
+/- |
1+ |
2+ |
3+ |
4+ |
| pH |
6.5 |
7.0 |
7.5 |
8.0 |
8.5 |
>=9.0 |
| URO (EU/dL) |
0.2 |
1 |
2 |
4 |
>=8 |
|
| NIT |
- |
+ |
|
|
|
|
| OB (μlmol/L) |
- |
+/- |
1+ |
2+ |
3+ |
|
| LEU |
- |
+/- |
1+ |
2+ |
3+ |
|
| RBC |
0 |
+/- |
1+ |
2+ |
3+ |
|
| WBC |
0 |
+/- |
1+ |
2+ |
3+ |
|
| Epithelial cell |
0 |
+/- |
1+ |
2+ |
3+ |
|
| Cast |
0 |
+/- |
1+ |
2+ |
3+ |
|
Download Excel Table
Table 4.
Investigation results of clinical signs through the autopsy after the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Days |
Signs |
Groups (mg/kg/day)b) |
| G1%,a) |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| 0 |
No finding |
0 / 10a) |
0 / 10a) |
0 / 10a) |
0 / 10 a) |
0 / 10a) |
0 / 10 a) |
0 / 10a) |
0 / 10a) |
| 1~7 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 8~14 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 15~21 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 22~28 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 29~35 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 36~42 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 43~49 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 50~56 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 57~63 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 64~70 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 71~77 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 78~84 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 85~89 |
No finding |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
0 / 10 |
| 90 |
Terminal sacrifice |
10 / 10 |
10 / 10 |
10 / 10 |
10 / 10 |
10 / 10 |
10 / 10 |
10 / 10 |
10 / 10 |
Download Excel Table
6. 독성판정기준
시험물질의 반복투여독성시험을 통해 얻어진 변화 또는 독성은 독성의 정도와 양상에 따라 weight-based classification (Park and Cho, 2011)에 따라 평가하였다(Table 2). Weight- based Classification은 시험물질 유래 중요한 변화(important compound-related changes), 시험물질 유래 경미한 변화(minor compound-related changes)와 비시험물질 유래변화(noncompound-related changes)로 3단계로 구분하여 평가하였다. 시험물질이 비시험물질 유래변화(noncompound-related changes)로 평가되면, 시험의 목적인 NOEL(No Observed Effect Level), NOAEL(No Observed Adverse Effect Level) 및 LOAEL (Lowest Observed Adverse Effect Level)로 구분하였다. 독성지표는 시험물질-유래 중요한 변화는 adverse 그리고 시험물질-유래 경미한 변화는 시험물질에 의한 non-adverse effect로 분류하였다. 일반적으로 NOAEL은 시험물질에 의해 심각한 독성(adverse effect)을 유발하지 않는 최대독성영향이지만 경미한 영향인 non-adverse effect를 나타내는 최대무독성용량이며, LOAEL은 adverse effect를 유발하는 최소독성용량을 의미한다. NOEL은 시험물질에 의한 경미한 변화도 없는 최대무영향용량을 의미한다. 이러한 독성지표의 정의에 따라 최종 독성판정은 NOAEL과 NOEL로 구분하여 실시하였다.
결 과
1. 시험물질 내 지표성분 Sialic acid 검정
Fig. 3은 시험물질인 7%-NANA 내 지표성분인 sialic acid의 함유량을 분석한 결과이다. 시험물질 내 지표성분인 sialic acid의 분리 여부와 더불어 함유량을 확인 결과, 7% sialic acid와 고유 GMP 단백질이 93%(수분함량 제외)로 구성되어 있었으며, 사용효소의 분해효율은 100%였다. 따라서, 시험물질로 사용에 있어 적합함을 확인하였다.
2. 실험물질의 동물안전성 평가
1) 일반증상 및 사망동물
Table 1과 Table 18은 시험물질인 7%-GNANA를 90일 동안 투여 시 일반증상변화 및 사망동물의 발생 여부를 인한 결과이고, 실험기간 중 대조군을 포함한 모든 시험군에서 사망동물은 없었으며, 투여 기간 중 일반증상의 관찰에서 어떠한 이상 소견은 없었다.
2) 체중 변화
Table 5와 Table 18은 7%-GNANA를 90일간 경구투여 과정에서 일정별 체중 변화를 대조군과 비교한 결과, 암수 모두 대조군과 비교하여 유의성 있는 체중 변화는 없었다.
Table 5.
Weekly investigation results of the effects on the body weight changes during the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Weeks |
Groups (mg/kg/day)b) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| 0 |
192.2± 5.46 |
155.1± 7.00 |
191.3± 6.42 |
153.8± 4.71 |
190.4± 7.92 |
153.6± 6.47 |
191.2± 5.05 |
152.2± 9.99 |
| 1 |
248.8±11.93 |
174.0±11.36 |
249.2± 9.26 |
171.8±11.24 |
244.9±12.22 |
171.8± 9.05 |
248.3± 9.26 |
172.9±12.00 |
| 2 |
303.6±17.49 |
194.5±15.46 |
302.3±11.12 |
186.6±7.28 |
297.1±18.25 |
189.0± 7.08 |
300.0±13.58 |
193.1±12.05 |
| 3 |
348.9±23.49 |
211.0±14.11 |
346.2±14.88 |
202.3±10.75 |
336.7±23.12 |
206.3±10.48 |
339.3±18.00 |
211.0±12.09 |
| 4 |
386.3±30.30 |
223.5±12.21 |
380.4±17.54 |
215.2±9.40 |
368.9±26.04 |
219.4±11.90 |
369.4±22.63 |
228.0±11.19 |
| 5 |
418.0±34.94 |
238.8±16.96 |
412.0±21.18 |
224.2±8.56 |
395.9±29.46 |
230.5±12.09 |
397.7±22.87 |
237.6±12.91 |
| 6 |
441.6±40.03 |
248.5±15.74 |
436.9±23.61 |
234.9±11.48 |
419.3±34.58 |
239.0±11.83 |
421.1±23.72 |
243.7±17.51 |
| 7 |
461.8±45.67 |
257.4±18.26 |
455.8±24.05 |
244.7±12.94 |
439.9±38.17 |
246.3± 9.03 |
441.2±21.67 |
255.3±14.88 |
| 8 |
481.3±49.84 |
268.6±16.75 |
475.2±25.78 |
249.5±12.84 |
455.1±40.38 |
254.0±12.17 |
458.3±21.57 |
264.7±16.73 |
| 9 |
497.0±53.12 |
276.5±21.71 |
494.5±28.63 |
253.0±11.56 |
472.6±43.81 |
259.7±12.16 |
472.3±20.01 |
267.6±15.26 |
| 10 |
511.6±56.97 |
277.3±19.02 |
509.8±31.12 |
255.8±11.47 |
488.4±47.95 |
263.8±12.80 |
486.3±22.67 |
269.8±16.88 |
| 11 |
523.2±59.13 |
282.0±19.73 |
521.9±33.53 |
263.0±13.51 |
501.8±53.11 |
268.2± 8.32 |
497.5±24.40 |
277.8±17.34 |
| 12 |
538.3±60.81 |
288.7±19.99 |
539.3±37.42 |
269.7±16.83 |
515.6±56.08 |
271.7±11.61 |
512.1±23.62 |
286.0±18.24 |
| 13 |
538.7±62.09 |
295.3±24.87 |
541.6±37.64 |
272.5±17.62 |
517.8±59.78 |
276.8± 9.83 |
513.1±23.61 |
287.0±17.25 |
| Gainsa) |
346.5±60.02 |
140.2±21.30 |
350.3±34.53 |
118.6±14.55 |
327.4±53.78 |
123.1± 9.04 |
321.8±21.62 |
134.8±16.20 |
Download Excel Table
3) 사료섭취량 조사
Table 6과 Table 18은 7%-GNANA를 투여한 암수 랫드의 일정별 사료섭취량을 대조군과 비교한 결과이다. 암컷 평균 사료섭취량에서 대조군과 비교하여 고용량군에서 통계적으로 유의하게 감소(-6.1%)하였지만, 고용량의 시험물질 투여로 인한 사료섭취량의 감소로 판단되어 시험물질-유래 경미한 변화로 판단하였다(p<0.05). 수컷은 대조군과 비교하여 이상소견이 관찰되지 않았다.
Table 6.
An assessment of the food consumption changes affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Weeks |
Groups (mg/kg/day)a) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| 0 |
23.3±1.67 |
16.6±1.35 |
22.7±1.38 |
15.9±1.03 |
22.2±0.99 |
16.1±1.25 |
23.0±1.17 |
15.2±2.36 |
| 1 |
21.7±1.62 |
14.2±1.14 |
21.0±1.27 |
14.2±0.80 |
20.2±1.58 |
13.9±0.55 |
20.4±1.08 |
13.6±0.95 |
| 2 |
23.3±1.53 |
15.0±1.80 |
22.8±1.63 |
13.8±0.71 |
21.9±1.53 |
13.9±0.10 |
22.0±0.83 |
14.4±0.68 |
| 3 |
25.0±2.04 |
15.8±0.84 |
23.8±1.79 |
15.2±0.91 |
22.8±1.64 |
15.3±0.50 |
22.3±0.94 |
15.3±0.25 |
| 4 |
25.7±2.00 |
15.3±0.46 |
23.9±1.40 |
15.0±0.73 |
23.2±1.48 |
15.3±0.85 |
22.4±0.92 |
15.5±0.49 |
| 5 |
26.2±2.45 |
16.4±1.15 |
24.6±1.56 |
15.4±1.07 |
23.4±1.49 |
15.4±0.90 |
22.8±0.59 |
15.2±0.26 |
| 6 |
25.5±2.37 |
16.1±0.77 |
24.4±1.65 |
15.5±0.97 |
23.4±1.89 |
14.6±1.17 |
22.6±0.61 |
14.7±0.54 |
| 7 |
25.1±2.45 |
15.6±1.32 |
23.8±1.33 |
15.5±1.92 |
23.3±2.43 |
15.0±1.12 |
22.7±0.57 |
15.0±1.17 |
| 8 |
24.8±2.33 |
16.6±1.08 |
23.5±1.10 |
15.0±1.41 |
22.9±2.81 |
15.2±0.82 |
22.3±0.38 |
15.1±1.57 |
| 9 |
24.3±2.16 |
16.1±1.24 |
23.8±1.62 |
14.3±0.75 |
23.1±2.40 |
14.7±0.84 |
22.7±0.43 |
14.4±0.37 |
| 10 |
24.4±2.00 |
15.3±1.36 |
23.4±1.37 |
14.3±0.73 |
22.5±2.41 |
14.6±0.71 |
21.7±0.42 |
13.8±0.74 |
| 11 |
24.2±2.01 |
15.0±0.83 |
23.3±1.58 |
14.3±0.83 |
22.8±2.38 |
14.5±0.51 |
21.9±0.63 |
14.7±0.72 |
| 12 |
24.4±2.13 |
15.5±0.95 |
23.7±1.61 |
15.1±1.03 |
22.0±1.84 |
14.3±1.15 |
21.6±0.24 |
15.1±0.21 |
| 13 |
19.8±1.71 |
13.7±1.05 |
19.5±1.76 |
13.1±1.28 |
17.7±0.82 |
12.7±0.63 |
18.4±0.29 |
12.0±1.10 |
| Average |
24.1±1.96 |
15.5±0.57 |
23.2±1.39 |
14.8±0.50 |
22.2±1.72 |
14.7±0.45 |
21.9±0.39 |
14.6±0.48* |
Download Excel Table
4) 안검사
Table 7과 Table 18은 암수 랫드의 시험군 분리 시 외안검사와 투여 마지막 주에 수행된 안저검사 결과이고, 대조구와 비교 시 전체 시험구에서 이상소견은 관찰되지 않았다.
Table 7.
A clinical investigation of the ophthalmic findings affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Sites |
Findings |
Groups (mg/kg/day)b) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Left eye |
Normal |
0 / 5a) |
0 / 5a) |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
| Right eye |
Normal |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
0 / 5 |
Download Excel Table
5) 장기중량
Table 14, Table 15 및 Table 18은 7%-GNANA를 투여한 암수 랫드의 장기절대중량(absolute weight) 및 상대중량(relative weight)을 대조군과 비교한 결과이다.
Table 14.
An assessment of the changes in absolute organ weights affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Organ weight#(g) |
Groups (mg/kg/day)a) |
| G1%* |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Adrenal(L) |
0.0260±0.00294 |
0.0634±0.01079 |
0.0243±0.00242 |
0.0609±0.00845 |
0.0256±0.00303 |
0.0602±0.00714 |
0.0259±0.00310 |
0.0655±0.00816 |
| Adrenal(R) |
0.0244±0.00347 |
0.0647±0.01186 |
0.0243±0.00202 |
0.0654±0.01014 |
0.0243±0.00237 |
0.0634±0.01206 |
0.0257±0.00275 |
0.0683±0.01172 |
| Pituitary |
0.0133±0.00161 |
|
0.0124±0.00141 |
|
0.0130±0.00154 |
|
0.0129±0.00174 |
|
| Thymus |
0.4588±0.09823 |
0.3136±0.06780 |
0.4471±0.10037 |
0.2451±0.05655 |
0.4425±0.13683 |
0.2520±0.03107 |
0.4321±0.06935 |
0.2344±0.04380* |
| Pituitary |
|
0.0312±0.00446 |
|
0.0319±0.00308 |
|
0.0324±0.00561 |
|
0.0334±0.00489 |
| Ovary(L) |
|
0.0304±0.00361 |
|
0.0297±0.00330 |
|
0.0307±0.00416 |
|
0.0319±0.00412 |
| Ovary(R) |
|
0.0163±0.00253 |
|
0.0158±0.00176 |
|
0.0173±0.00218 |
|
0.0180±0.00131 |
| Prostate |
0.7492±0.15138 |
|
0.7916±0.12675 |
|
0.6470±0.15774 |
|
0.7047±0.11978 |
|
| Testis(L) |
1.9440±0.16247 |
|
1.8693±0.18969 |
|
1.8509±0.16331 |
|
1.9046±0.18961 |
|
| Testis(R) |
1.9791±0.18432 |
|
1.7446±0.35818 |
|
1.8530±0.15628 |
|
1.9120±0.19394 |
|
| Epididymis(L) |
0.6816±0.05997 |
|
0.6816±0.07728 |
|
0.6609±0.06245 |
|
0.6812±0.05264 |
|
| Epididymis(R) |
0.6975±0.05698 |
|
0.6495±0.08645 |
|
0.6848±0.06111 |
|
0.6982±0.04752 |
|
| Spleen |
1.0666±0.24859 |
0.5887±0.10268 |
1.1236±0.21456 |
0.5799±0.07361 |
1.1258±0.30077 |
0.5730±0.07541 |
0.9650±0.18379 |
0.5903±0.10374 |
| Kidney(L) |
1.4185±0.14116 |
0.7994±0.06339 |
1.4113±0.08042 |
0.7903±0.06262 |
1.4211±0.15464 |
0.7757±0.06449 |
1.5246±0.13816 |
0.8581±0.04814 |
| Kidney(R) |
1.4209±0.12167 |
0.8044±0.04636 |
1.4522±0.09971 |
0.7817±0.07460 |
1.4361±0.13310 |
0.7986±0.05700 |
1.5268±0.12167 |
0.8541±0.04648 |
| Heart |
1.4230±0.13770 |
0.8644±0.06959 |
1.4238±0.15498 |
0.8420±0.08140 |
1.3826±0.10954 |
0.8429±0.07471 |
1.3981±0.12799 |
0.8480±0.06259 |
| Lung |
1.8385±0.19198 |
1.2578±0.11501 |
1.7574±0.14490 |
1.2794±0.08861 |
1.7622±0.07097 |
1.2682±0.08068 |
1.7882±0.15544 |
1.2864±0.06129 |
| Brain |
2.2381±0.07477 |
2.0151±0.10113 |
2.2191±0.07777 |
1.9880±0.08094 |
2.1878±0.08788 |
2.0035±0.11266 |
2.1944±0.09831 |
2.0017±0.07320 |
| Liver |
13.8765±1.99662 |
6.7533±1.17137 |
13.7635±1.21293 |
6.3858±0.68144 |
13.4108±1.90139 |
6.5099±0.54514 |
13.5237±1.33087 |
6.8268±0.56704 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
Table 15.
An assessment of the changes in relative organ weights (% of body weight) affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Organ weight(g)# |
Groups (mg/kg/day)a) |
| G1%* |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Adrenal(L) |
0.0050±0.00053 |
0.0229±0.00380 |
0.0047±0.00055 |
0.0237±0.00415 |
0.0052±0.00077 |
0.0229±0.00286 |
0.0052±0.00056 |
0.0244±0.00374 |
| Adrenal(R) |
0.0047±0.00074 |
0.0234±0.00428 |
0.0047±0.00037 |
0.0255±0.00465 |
0.0049±0.00053 |
0.0241±0.00465 |
0.0052±0.00050 |
0.0252±0.00373 |
| Pituitary |
0.0026±0.00021 |
0.0113±0.00163 |
0.0024±0.00024 |
0.0124±0.00128 |
0.0026±0.00031 |
0.0123±0.00196 |
0.0026±0.00034 |
0.0124±0.00180 |
| Thymus |
0.0880±0.01341 |
0.1122±0.02049 |
0.0864±0.02290 |
0.0941±0.01688 |
0.0880±0.01989 |
0.0963±0.01479 |
0.0877±0.01314 |
0.0875±0.01979 |
| Ovary(L) |
|
0.0110±0.00145 |
|
0.0115±0.00097 |
|
0.0117±0.00130 |
|
0.0118±0.00170 |
| Ovary(R) |
|
0.0059±0.00097 |
|
0.0061±0.00078 |
|
0.0066±0.00084 |
|
0.0067±0.00050 |
| Prostate |
0.1448±0.02427 |
|
0.1513±0.02024 |
|
0.1296±0.02875 |
|
0.1432±0.02411 |
|
| Testis(L) |
0.3779±0.04179 |
|
0.3583±0.03393 |
|
0.3740±0.03992 |
|
0.3865±0.03005 |
|
| Testis(R) |
0.3841±0.03758 |
|
0.3340±0.06588 |
|
0.3742±0.03695 |
|
0.3882±0.03307 |
|
| Epididymis(L) |
0.1323±0.01261 |
|
0.1307±0.01507 |
|
0.1334±0.01453 |
|
0.1383±0.00861 |
|
| Epididymis(R) |
0.1354±0.01291 |
|
0.1249±0.01929 |
|
0.1381±0.01308 |
|
0.1419±0.00831 |
|
| Spleen |
0.2061±0.04519 |
0.2110±0.02591 |
0.2143±0.03298 |
0.2239±0.02055 |
0.2271±0.06144 |
0.2186±0.03265 |
0.1956±0.03444 |
0.2183±0.03465 |
| Kidney(L) |
0.2741±0.01348 |
0.2891±0.03081 |
0.2711±0.02207 |
0.3063±0.02508 |
0.2862±0.02674 |
0.2949±0.01793 |
0.3094±0.02196* |
0.3185±0.02325* |
| Kidney(R) |
0.2754±0.02132 |
0.2907±0.02340 |
0.2788±0.02398 |
0.3031±0.03198 |
0.2899±0.02872 |
0.3039±0.01906 |
0.3102±0.02247* |
0.3167±0.01676* |
| Heart |
0.2754±0.01906 |
0.3121±0.02798 |
0.2722±0.01623 |
0.3264±0.03347 |
0.2787±0.02187 |
0.3208±0.02791 |
0.2840±0.02408 |
0.3143±0.01968 |
| Lung |
0.3564±0.03426 |
0.4531±0.03020 |
0.3377±0.03376 |
0.4959±0.03694 |
0.3567±0.03688 |
0.4827±0.02846 |
0.3629±0.02254 |
0.4780±0.03868 |
| Brain |
0.4359±0.04430 |
0.7295±0.07218 |
0.4264±0.03163 |
0.7715±0.05495 |
0.4427±0.04191 |
0.7625±0.03782 |
0.4461±0.02088 |
0.7443±0.06426 |
| Liver |
2.6702±0.18633 |
2.4282±0.36368 |
2.6330±0.10828 |
2.4762±0.28171 |
2.6862±0.22023 |
2.4762±0.17913 |
2.7435±0.19710 |
2.5284±0.16711 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
암수 투여군의 절대중량 및 상대중량에서 대조군과 비교하여 유의한 차이가 없었으나, 수컷은 고용량군에서 양쪽 신장(kidney)에서 상대중량의 증가되었다. 암컷의 경우는 고용량군에서 양쪽 신장의 상대중량 증가와 더불어 가슴샘(thymus)에서 절대중량이 통계적으로 유의하게 증가(P<0.05)하였으나, 그러나 이러한 유의한 차이는 용량의존성이 없어 시험물질 유래 경미한 변화로 판단되었다.
6) 요검사
Table 8, Table 10 및 Table 18은 7%-GNANA를 투여한 암수 랫드에 대한 요검사 결과를 나타낸 것이다. 수컷에서 SG 및 pH 중증도가 중용량군에서 통계적으로 유의하게 증가하였지만(p<0.05), 용량 의존성이 없었으며, 정상범위(historical data) 내에서 변화하여 비시험물질 유래 변화로 판단되었다. 또한, PRO 중증도 수치는 저용량군에서 그리고 KET(ketone body) 및 SG(specific gravity)는 중용량군에서 대조군과 비교하여 통계적으로 유의하게 증가하였지만(p<0.05), 정상범위(historical data) 내의 변화로 추정되어 생물학적 유의성(biological significance)이 없는 비시험물질 유래 변화로 판단되었다. 암컷의 경우는 암컷의 경우는 대조군과 비교하여 이상소견이 관찰되지 않았다.
Table 10.
An assessment of the changes in urine volume and color affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Groups (mg/kg/day) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Volume (mL) |
10.3±3.60 |
7.8±2.89 |
10.6±2.63 |
7.8±4.15 |
8.6±3.63 |
8.3±4.81 |
12±3.02 |
6.3±1.96 |
| Color-yellow |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| No. of animals |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
Download Excel Table
Table 8.
An assessment of the urinalysis changes affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Result |
Severity |
Groups (mg/kg/day) |
| Male |
|
Female |
| G1% |
G2 |
G3 |
G4 |
|
G1 |
G2 |
G3 |
G4 |
| 0 |
1,250 |
2,500 |
5,000 |
|
0 |
1,250 |
2,500 |
5,000 |
| GLU |
- |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| BIL |
- |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| KET |
- |
0 |
4 |
2 |
|
|
5 |
5 |
5 |
5 |
| +/- |
1 |
|
1 |
|
2 |
|
|
|
|
| 1+ |
2 |
1 |
2 |
5 |
3 |
|
|
|
|
| SG |
≤1.005 |
0 |
|
|
|
|
1 |
|
|
|
| 1.010 |
1 |
4 |
2 |
|
1 |
1 |
4 |
3 |
|
| 1.015 |
2 |
1 |
2 |
4 |
3 |
|
|
|
4 |
| 1.020 |
3 |
|
1 |
1 |
1 |
3 |
1 |
2 |
1 |
| pH |
≤6.5 |
0 |
|
|
|
|
1 |
|
|
|
| 7.0 |
1 |
|
|
|
|
|
|
1 |
|
| 7.5 |
2 |
|
|
|
|
1 |
|
2 |
1 |
| 8.0 |
3 |
1 |
1 |
2 |
3 |
1 |
1 |
1 |
2 |
| 8.5 |
4 |
4 |
4 |
3 |
2 |
2 |
4 |
1 |
2 |
| PRO |
- |
0 |
2 |
|
|
|
3 |
4 |
3 |
|
| +/- |
1 |
1 |
|
|
1 |
2 |
1 |
1 |
3 |
| 1+ |
2 |
2 |
4 |
3 |
1 |
|
|
|
2 |
| 2+ |
3 |
|
1 |
1 |
3 |
|
|
1 |
|
| 3+ |
4 |
|
|
1 |
|
|
|
|
|
| UROa) |
0.2 |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
3 |
| 1 |
1 |
|
|
|
|
|
|
|
2 |
| NIT |
- |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| OB |
- |
0 |
2 |
2 |
5 |
5 |
5 |
5 |
4 |
5 |
| +/- |
1 |
3 |
2 |
|
|
|
|
|
|
| 1+ |
2 |
|
1 |
|
|
|
|
|
|
| 2+ |
3 |
|
|
|
|
|
|
1 |
|
| LEU |
- |
0 |
2 |
|
|
1 |
4 |
5 |
4 |
4 |
| +/- |
1 |
1 |
3 |
1 |
|
1 |
|
|
1 |
| 1+ |
2 |
1 |
2 |
3 |
2 |
|
|
1 |
|
| 2+ |
3 |
1 |
|
|
2 |
|
|
|
|
| 3+ |
4 |
|
|
1 |
|
|
|
|
|
| No. of animals |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
Download Excel Table
3. 요침사 검사
Table 9과 Table 18은 7%-GNANA를 투여한 암수 랫드에 대한 요침사 검사 결과를 나타낸 것이다. 결과로서, 암컷 및 수컷 모두에서 대조군과 비교하여 이상소견이 관찰되지 않았다.
Table 9.
An assessment of the changes in urine sediments affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Result |
Severity |
Groups (mg/kg/day)a) |
| Male |
|
Female |
| G1% |
G2 |
G3 |
G4 |
|
G1 |
G2 |
G3 |
G4 |
| RBC |
- |
0 |
4 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| +/- |
1 |
1 |
|
|
|
|
|
|
|
| WBC |
- |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| Epithelial cell |
- |
0 |
3 |
4 |
4 |
4 |
4 |
3 |
5 |
4 |
| +/- |
1 |
2 |
1 |
1 |
1 |
1 |
2 |
|
1 |
| Casts |
- |
0 |
4 |
4 |
4 |
5 |
4 |
4 |
3 |
4 |
| +/- |
1 |
1 |
1 |
1 |
|
1 |
1 |
2 |
1 |
| No. of animals |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| " "= no finding, %: Control group (G1), Low-dose group (G2: 1,250 mg/10 mL/day), Medium-dose group (G3: 2,500 mg/10 mL/day), High-dose group (G4: 5,000 mg/10 mL/day) |
| Grade |
RBC (mean/field) |
WBC (mean/field) |
Epithelial cell |
Casts (mean/field) |
| - |
0 |
0 |
0 / 20 fields |
0 |
| +/- |
≤4 |
≤5 |
Few / 20 fields |
1 |
| 1+ |
5~8 |
6~20 |
Around 1 / few field |
2~5 |
Download Excel Table
1) 혈액학적 검사
Table 11과 Table 18은 7%-GNANA를 투여한 수컷 및 암컷 랫드에 대한 혈액학적 검사를 나타낸 것이다. 암수 모두에서 대조군과 비교하여 이상소견은 관찰되지 않았다(p<0.05).
Table 11.
An assessment of the changes in hematological values affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Units |
Groups (mg/kg/day) |
| G1 |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| WBC |
103/μL |
3.97±0.884 |
2.03±0.813 |
4.03±0.750 |
1.72±0.787 |
3.71±1.148 |
1.73±0.689 |
3.72±0.701 |
1.82±0.621 |
| RBC |
106/μL |
9.03±0.282 |
8.26±0.405 |
9.44±0.510 |
8.32±0.407 |
9.20±0.481 |
8.34±0.462 |
9.27±0.498 |
8.31±0.358 |
| HGB |
g/dL |
13.9±0.79 |
13.8±0.65 |
13.8±0.82 |
14.0±0.29 |
13.4±1.38 |
13.8±0.39 |
14.1±0.54 |
13.8±0.47 |
| HCT |
% |
44.2±1.56 |
43.1±2.01 |
44.6±1.72 |
43.3±0.73 |
44.5±1.73 |
42.9±1.13 |
44.7±1.21 |
42.7±1.10 |
| MCV |
fL |
49.0±2.56 |
52.2±1.15 |
47.3±2.58 |
52.1±2.07 |
48.4±2.53 |
51.6±2.24 |
48.3±2.22 |
51.4±2.13 |
| MCH |
pg |
15.4±1.13 |
16.8±0.53 |
14.7±1.26 |
16.8±0.86 |
14.5±1.48 |
16.6±0.90 |
15.2±1.12 |
16.6±0.91 |
| MCHC |
g/dL |
31.4±1.13 |
32.2±0.44 |
31.0±1.00 |
32.3±0.50 |
30.0±2.58 |
32.1±0.43 |
31.4±0.90 |
32.3±0.54 |
| RDW |
% |
13.4±0.94 |
11.6±1.07 |
13.4±0.96 |
11.6±1.20 |
13.2±0.77 |
12.0±1.40 |
13.1±0.66 |
12.0±1.34 |
| HDW |
g/dL |
3.26±0.450 |
2.80±0.408 |
3.42±0.426 |
2.83±0.346 |
3.35±0.460 |
2.90±0.461 |
3.35±0.464 |
2.91±0.477 |
| PLT |
103/μL |
1,075±252.3 |
977±104.1 |
1,112±82.9 |
881±308.3 |
1,076±187.3 |
1,038±132.2 |
1,027±86.3 |
1,040±112.0 |
| MPV |
fL |
7.6±0.28 |
7.7±0.43 |
7.7±0.50 |
8.0±1.04 |
7.7±0.37 |
7.9±0.52 |
7.6±0.36 |
7.7±0.30 |
| RET |
% |
1.93±0.526 |
1.86±0.375 |
2.04±0.553 |
1.84±0.542 |
1.96±0.440 |
1.95±0.422 |
1.70±0.250 |
1.88±0.340 |
| NEU |
% |
26.7±9.62 |
21.0±3.91 |
25.0±4.08 |
20.4±7.13 |
26.6±5.79 |
23.0±6.25 |
27.4±7.72 |
20.9±6.48 |
| 103/μL |
1.05±0.451 |
0.44±0.223 |
1.01±0.273 |
0.35±0.175 |
0.99±0.376 |
0.40±0.204 |
1.00±0.265 |
0.37±0.166 |
| LYM |
% |
68.2±10.15 |
73.3±3.33 |
68.9±4.07 |
73.9±6.81 |
67.6±5.83 |
71.5±7.01 |
66.9±8.22 |
73.6±6.47 |
| 103/μL |
2.71±0.690 |
1.48±0.576 |
2.77±0.506 |
1.28±0.664 |
2.49±0.795 |
1.24±0.499 |
2.50±0.607 |
1.35±0.481 |
| MONO |
% |
2.5±0.53 |
2.3±0.96 |
3.1±0.52 |
2.1±0.61 |
3.0±0.81 |
2.1±0.55 |
2.9±0.62 |
2.2±0.46 |
| EOS |
% |
2.1±0.36 |
2.9±0.98 |
2.3±0.54 |
2.7±1.21 |
2.2±0.71 |
2.8±1.02 |
2.3±0.84 |
2.8±0.88 |
| BASO |
% |
0.1±0.06 |
0.1±0.11 |
0.1±0.05 |
0.3±0.26 |
0.1±0.07 |
0.2±0.14 |
0.0±0.05 |
0.1±0.09 |
| LUC |
% |
0.5±0.27 |
0.3±0.19 |
0.8±0.29 |
0.5±0.31 |
0.6±0.37 |
0.4±0.23 |
0.4±0.18 |
0.4±0.13 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
2) 혈액생화학적 검사
Table 12과 Table 18은 7%-GNANA를 투여한 수컷 및 암컷 랫드에 대한 혈액생화학적 이상 여부를 대조군과 비교한 결과이다. 결과로서, 암컷에서만 Ca2+(Calciumion) 수치가 대조군과 비교하여 저용량군 및 중용량군에서 통계적으로 유의하게 감소하였지만 용량의존성이 없고, 정상범위(historical data) 내의 변화로 비시험물질-유래 변화로 판단하였다(p<0.05).
Table 12.
An assessment of the changes in serum biochemical values affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Units |
Groups (mg/kg/day) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| ALB |
g/dL |
3.3±0.12 |
3.6±0.13 |
3.3±0.09 |
3.5±0.09 |
3.3±0.12 |
3.5±0.15 |
3.4±0.09 |
3.6±0.15 |
| ALP |
U/L |
185±34.1 |
135±22.7 |
189±38.6 |
130±28.7 |
194±52.4 |
135±31.6 |
196±29.3 |
130±25.9 |
| ALT |
U/L |
28±4.8 |
21±2.9 |
34±1.2 |
20±1.9 |
32±11.1 |
25±6.1 |
33±9.1 |
22±5.3 |
| AST |
U/L |
81±18.8 |
78±12.7 |
93±22.8 |
74±12.9 |
85±11.7 |
79±8.7 |
92±24.5 |
88±17.2 |
| BIL |
mg/dL |
0.1±0.03 |
0.1±0.04 |
0.1±0.01 |
0.1±0.03 |
0.1±0.01 |
0.1±0.03 |
0.1±0.03 |
0.1±0.05 |
| BUN |
mg/dL |
17.2±2.22 |
17.0±3.15 |
17.2±2.47 |
17.7±2.86 |
19.2±2.82 |
17.9±3.01 |
18.6±1.54 |
17.7±2.74 |
| CHO |
mg/dL |
11.0±0.20 |
10.9±0.28 |
11.0±0.30 |
10.7±0.23 |
10.9±0.33 |
10.6±0.24 |
10.9±0.32 |
10.8±0.25 |
| CPK |
U/L |
86±12.8 |
86±23.6 |
82±15.6 |
76±21.8 |
95±17.9 |
84±14.6 |
80±12.0 |
78±21.2 |
| CRE |
mg/dL |
108±46.2 |
73±21.9 |
127±75.7 |
76±38.5 |
102±41.1 |
91±24.7 |
103±43.6 |
109±75.7 |
| GLU |
mg/dL |
0.6±0.08 |
0.6±0.09 |
0.6±0.07 |
0.7±0.04 |
0.6±0.04 |
0.7±0.06 |
0.6±0.03 |
0.7±0.04 |
| IP |
mg/dL |
177±26.7 |
135±16.4 |
170±21.4 |
126±12.3 |
165±24.1 |
134±16.9 |
177±21.0 |
141±19.6 |
| PRO |
g/dL |
5.84±0.585 |
5.38±0.729 |
6.04±0.482 |
4.83±0.732 |
5.78±0.449 |
4.81±0.773 |
5.68±0.655 |
5.21±0.825 |
| TG |
mg/dL |
6.3±0.25 |
6.4±0.26 |
6.3±0.24 |
6.2±0.20 |
6.2±0.35 |
6.2±0.24 |
6.4±0.19 |
6.5±0.32 |
| A/G |
Ratio |
72±49.0 |
33±8.2 |
53±13.3 |
33±9.0 |
60±26.6 |
34±8.9 |
47±10.7 |
30±9.9 |
| Ca2+ |
mg/dL |
1.1±0.07 |
1.3±0.07 |
1.1±0.06 |
1.3±0.07 |
1.2±0.07 |
1.3±0.04 |
1.1±0.05 |
1.2±0.10 |
| Na+ |
mg/dL |
139.0±0.81 |
137.1±0.88 |
139.3±0.55 |
137.7±0.63 |
139.0±1.36 |
137.9±1.20 |
139.0±0.65 |
137.4±0.36 |
| K+ |
mmol/L |
4.13±0.253 |
3.76±0.105 |
4.26±0.116 |
3.84±0.198 |
4.26±0.260 |
3.78±0.232 |
4.03±0.221 |
3.70±0.214 |
| Cl- |
mmol/L |
106.2±1.23 |
107.6±0.53 |
106.4±0.47 |
108.8±0.63 |
105.8±1.12 |
109.2±0.87 |
105.6±0.86 |
108.0±1.02 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
3) 혈액응고 검사
Table 13과 Table 18은 7%-GNANA를 투여한 수컷 및 암컷 랫드의 혈액응고시간에 미치는 결과를 대조군과 비교한 결과로서, 암수 모두에서 대조군과 비교하여 이상소견이 관찰되지 않았다(p<0.05).
Table 13.
An assessment of the changes in plasma coagulation values affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Tests |
Groups (mg/kg/day)a) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| PT (sec) |
8.54±0.370 |
8.67±0.509 |
8.66±0.354 |
8.94±0.448 |
8.33±0.341 |
8.88±0.281 |
8.49±0.293 |
8.78±0.369 |
| APTT(sec) |
17.6±1.52 |
17.0±1.50 |
16.7±1.53 |
17.0±1.34 |
17.4±1.89 |
16.6±1.19 |
18.0±1.89 |
16.6±2.14 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
4) 부검소견
Table 16과 Table 18은 7%-GNANA를 투여한 암수 랫드에 대한 부검결과를 나타낸 것이다.
수컷 우측고환 왜소가 1례에서 관찰되었지만 다른 개체에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 또한, 저용량군 1례에서 늑골(rib)에 포도상(bortyoid)의 종양(tumor)이 관찰되었지만 다른군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 암컷의 경우, 가슴샘(thymus) 발적(redness)이 중용량군 및 고용량군에서 각각 1례씩 관찰되었지만 랫드에 흔히 나타나는 자연발생적 증상으로 비시험물질-유래 변화로 판단하였다. 그리고 자궁내 맑은 액체 저류(retention of clearfluid)는 대조군 1례에서 관찰되었지만 다른 군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 또한, 폐(lung) 발적(redness)이 대조군 2례와 저용량군 2례, 중용량군 4례 및 고용량군 2례에서 관찰되었으나 비시험물질-유래 변화로 판단하였다.
Table 16.
An assessment of the changes in necropsy findings affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Organs |
Observed signs |
Groups (mg/kg/day)a) |
| G1%* |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Testis |
Undersized |
0 |
|
1 |
|
0 |
|
0 |
|
| Rib |
Tumor |
0 |
|
1 |
|
0 |
|
0 |
|
| Uterus |
Retention of clear fluid |
|
1 |
|
1 |
|
1 |
|
1 |
| Ovary |
Retention of red fluid |
|
1 |
|
0 |
|
0 |
|
0 |
| Lung |
Redness |
|
2 |
|
2 |
|
4 |
|
2 |
| Thymus |
Redness |
|
0 |
|
0 |
|
1 |
|
1 |
| No. of animals |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Download Excel Table
5) 조직병리학적 검사
Table 17과 Table18은 7%-GNANA를 투여한 암수 랫드에 대한 조직병리학적 검사 결과를 나타낸 것이다. 수컷에서의 결과는 다음과 같다. 신장(Kidney)에서 미약한(minimal) 사구체 경화(glomerulosclerosis)가 고용량군 2례가 나타났으나, 대조군 3례에서도 같은 정도로 나타나, 비시험물질-유래 변화로 판단하였다. 신장내 미약한(minimal) 염증세포침윤(inflammatory cells infiltration)이 고용량군 1례가 나타났는데, 대조군 3례에서도 나타나, 비시험물질-유래 변화로 판단하였다. 신장(kidney) 내 미약한(minimal) 세뇨관 세포의 재생(regeneration)이 고용량군 1례에서 나타났으나 대조군 2례에서도 나타나, 비시험 물질-유래 변화로 판단하였다. 간(liver)에서 미약한(minimal) 간세포 공포변성(vacuolization)이 고용량군 1례에서 나타났으나, 다른 군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 심장(Heart)에서 미약한(minimal) 심근염(myocarditis)이 대조군 1례에서 “minimal”로 나타났으나, 다른 군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 이러한 결과는 비시험물질-유래 변화로 판단되었으며, 통계적 유의성은 있지만 생물학적 유의성(biological significance)은 없는 것으로 판단되었다. 암컷에서의 결과는 다음과 같다. 신장(kidney)에서 미약한(minimal) 사구체경화(glomerulosclerosis)가 대조군 1례와 고용량군 3례 나타나, 이는 시험물질-유래 경미한 변화로 판단하였다. 신장내 염증세포 침윤(inflammatory cells infiltration)이 대조군 2례에서만 미약한(minimal) 수준으로 나타나 비시험물질-유래 변화로 판단하였다. 신장내 세뇨관 세포의 재생(regeneration)이 고용량군 1례에서 나타났으나, 대조군 1례에서도 “minimal”로 나타나 비시험물질-유래 변화로 판단하였다. 신장(kidney)에서 미네랄 침착(mineralization)이 고용량군 1례에서 나타났으나, 대조군 1례에서도 “minimal”로 나타나 비시험물질-유래 변화로 판단하였다. 방광(urinary bladder)에서 미약한(minimal) 염증세포 침윤(inflammatory cells infiltration)이 대조군 1례에서만 나타나 비시험물질-유래 변화로 판단하였다. 간(liver)에서 미약한(minimal) 국소적인 괴사(forcal necrosis)가 대조군 1례에서만 나타났을 뿐, 다른 군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다. 비장(spleen)에서 미약한(minimal) Hemosiderin pigment이 고용량군 1례에서 나타났으나, 다른 군에서는 관찰되지 않아 비시험물질-유래 변화로 판단하였다.
Table 17.
An assessment of the changes in histopathological findings affected by the 90-day oral administration of 7%-GNANA, a test substance to the male and female rats (n=10)
| Organs |
Observed signs |
Groups (mg/kg/day)a) |
| G1% |
|
G2 |
|
G3 |
|
G4 |
| Male |
Female |
|
Male |
Female |
|
Male |
Female |
|
Male |
Female |
| Kidney |
Glomerulosclerosis |
3 |
1 |
|
|
|
|
2 |
3 |
| Inflammatory cells infiltration |
3 |
2 |
|
|
|
|
1 |
- |
| Regeneration |
2 |
1 |
|
|
|
|
1 |
1 |
| Mineralization |
|
1 |
|
|
|
|
|
1 |
| Liver |
Vacuolization of hepatocytes |
- |
1 |
|
|
|
|
1 |
- |
| Urinary bladder |
Inflammatory cells infiltration |
|
1 |
|
|
|
|
|
- |
| Heart |
Myocarditis |
1 |
|
|
|
|
|
- |
|
| Spleen |
Hemosiderin pigment |
|
- |
|
|
|
|
|
1 |
| No. of animals |
10 |
10 |
|
|
|
|
10 |
10 |
Download Excel Table
4. 독성판정(Result summary and Toxicity evaluation)
Table 18은 7%-GNANA를 90일 동안 반복경구투여 시 시험물질에 대한 암수 랫드에서 독성판정을 위한 종합결과이다. 본 시험은 7%-GNANA을 Sprague-Dawley 계통의 랫드에 90일간 반복경구투여를 하여 나타나는 독성 유무를 파악하기 위해 실시되었다. 시험결과, 시험물질투여 및 관찰기간(90일)동안 사망동물은 발생하지 않았다. 또한 일반증상소견, 체중 변화, 사료섭취량, 안과학적 검사, 요침사 및 혈액학적 검사, 혈액화학적 검사 및 혈액응고 시간검사 등 에서도 특이한 변화가 관찰되지 않았다. 요검사의 경우, 수컷에서만 SG, pH, KET(ketone body) 및 SG(specific gravity) 중증도가 중용량군에서 그리고 PRO 중증도가 저용량 및 고용량군에서 유의하게 증가하였다. 그러나 용량의존성이 없고 정상범위(historical data) 내 변화로 판단되었으며, 요침사 결과, 이상이 없어 시험물질에 의한 독성적인 변화로 판단되지 않았다. 따라서, 요검사에서 통계적 유의성은 있지만, 생물학적 유의성(biological significance)은 없는 것으로 판단되었다(Table 8). 부검소견 결과에서, 수컷에서는 우측고환 왜소, 가슴샘의 발적(redness) 및 늑골(rib)에 포도상(bortyoid)의 종양(tumor)증상이 일부 관찰되었으며, 암컷의 경우는 가슴샘의 발적(redness), 자궁 내 맑은 액체 저류(retention of clear fluid)와 폐(lung) 발적(redness) 증상이 일부 관찰되었다(Table 16, 18). 이러한 결과는 비시험물질-유래 변화로 판단되었으며, 통계적 유의성은 있지만 생물학적 유의성(biological significance)은 없는 것으로 판단되었다. 조직이상조사 결과에서, 수컷은 신장(kidney)에서 사구체 경화(glomerulosclerosis), 염증세포 침윤(inflammatory cells infiltration), 세뇨관 세포의 재생(regeneration) 증상이 나타났으며, 간(liver)에서는 간세포 공포변성(vacuolization) 증상과 더불어 심장(heart)에서도 심근염(myocarditis) 증상이 나타났으나 미약한(minimal) 수준이었고, 비시험물질-유래 변화로 판단하였다(Table 17, 18). 암컷의 경우에서도 신장(kidney)에서 사구체 경화(glomerulosclerosis), 염증세포 침윤(inflammatorycells infiltration), 세뇨관 세포의 재생(regeneration), 미네랄 침착(mineralization) 증상이 나타났으나, 미약한(minimal) 수준이었다. 또한, 방광(urinary bladder)에서 염증세포 침윤(inflammatory cells infiltration)과 비장(spleen)에서 hemosiderin pigment 증상이 나타났으나, 역시 미약한(minimal) 수준이었다. 암수 모두에서 이러한 결과는 비시험물질-유래 변화로 판단되었으며, 통계적 유의성은 있지만 생물학적 유의성(biological significance)은 없는 것으로 판단되었다(Table 17, 18). 시험물질에 의한 변화 및 독성평가 결과를 기초로 하여 weight-based classification(Table 2)를 적용한 최종독성 판정결과는 다음과 같다. 시험을 통해 암수 모두에서 시험물질-유래 중요한 변화 없이 시험물질-유래 경미한 변화만인 5,000 mg/kg/day에서 확인되었다. 암컷의 경우에서 5,000 mg/kg/day의 용량에서 신장의 경우에서만 시험물질-유래 경미한 변화가 나타났다. 따라서 시험의 독성 판정기준에 따라 수컷의 경우 NOEL은 5,000 mg/kg/day로 확인되었으며, 암컷의 경우 NOAEL은 5,000 mg/kg/day로 확인되었다.
Table 18.
Result of toxicity test by weight-based classification in SD rats administrated orally with 7%-GNANA for 90 days
| Weight-based classification |
Male |
|
Female |
| Finding |
Dose(mg/kg/day) |
|
Finding |
Dose(mg/kg/day) |
| Important compound-related changes |
Not detected |
|
Not detected |
|
| Minour compound-related changes |
Weigh of organ (kidney, increase) |
5,000 |
Food consumption decrease |
5,000 |
| Weight of organ (kidney increase) |
5,000 |
| Weight of organ (thymus, decrease) |
5,000 |
| Histological examination (kidney, glomerulosclerosis) |
0, 5,000 |
| Noncompound-related changes |
Urinalysis (PRO, increase) |
1,250 |
Blood chemistry (Ca2+ decrease) |
1,250, 2,500 |
| Urinalysis (KET, SG increase) |
2,500 |
Diagnosis of autopsy (redness of thymus) |
2,500, 5,000 |
| Histological examination (testis, dwarf) |
1,250 |
Diagnosis of autopsy (retention of clearfluid in uterus) |
0, 1,250, 2,500, 5,000 |
| Histological examination (bortyoid tumor of rib) |
1,250 |
Diagnosis of autopsy (retention of clearfluid in ovary) |
0 |
| Diagnosis of autopsy (redness of lung) |
0, 1,250, 2,500, 5,000 |
| Histological examination (glomerulosclerosis of kidney) |
0, 5,000 |
Histological examination (kidney, inflammatory cellular infiltration) |
0 |
| Histological examination (inflammatory cell infiltration of kidney) |
0, 5,000 |
Histological examination (cytothesis of kidney) |
0, 5,000 |
| Histological examination (kidney tissue regeneration) |
0, 5,000 |
Histological examination (kidney remain cool minereol) |
0, 5,000 |
| Histological examination (hepatocyte vacuolation) |
5,000 |
Histological examination (cystitis Jeungsepojimyun) |
0 |
| Histological examination (heart myocarditis) |
0 |
Histological examination (liver, focal necrosis) |
0 |
| Histological examination (spleen, hemosiderin pigment) |
5,000 |
Download Excel Table
요 약
본 시험은 sialic acid가 7%를 함유하도록 제조한 유청가수분해단백분말제제(whey protein of hydrolysis)의 기능성 식품 원료로 개발을 위한 동물안전성을 평가함에 연구목표를 두었다. GMP를 원료로 제조한 시험물질은 sialic acid 7%(v/v)와 원료인 GMP 가수분해 단백질이 93%로 구성되어 있었다(시험명: 7%-GNANA). 시험물질의 독성 유무는 한국식품의약안전청(KFDA, 2014)과 OECD(2008)의 의약품 등의 독성시험 기준에 따라 실시하였다. 평가방법으로서, 시험물질의 투여용량을 0, 1,250, 2,500 및 5,000 mg/kg/day로 하여 SPF Sprague- Dawley 계열 암수 랫드에 90일 동안 반복경구투여하였을 때 나타나는 독성 여부를 평가하였다.
평가항목으로서는 사망률, 일반증상관찰, 체중 변화, 사료섭취량 측정, 안검사, 요검사, 혈액학적 및 혈액생화학적 검사, 부검 시 장기의 중량측정, 부검 시 육안적 검사 및 조직병리학적 검사 등을 평가하였다. 90일 반복경구투여 실험결과로서, 시험물질투여 및 관찰기간 동안 사망동물은 발생하지 않았다. 또한 일반증상, 체중 변화, 사료섭취량, 안과학적 검사, 요검사 그리고 혈액학적 및 혈액이화학적 이상 및 혈액응고검사에서 대조군 대비 특이한 변화는 관찰되지 않았다(p<0.05). 부검 및 병리조직학적 평가 결과, 암수 모두에서 시험물질-유래 중요한 변화 없이 시험물질-유래 경미한 변화(non- adverse effect)만인 5,000 mg/kg/day에서 확인되었다. Weight- based classification(독성 강도에 따른 분류)을 적용한 최종 독성평가 결과, 수컷의 경우 NOEL(No Observed Effect Level)은 5,000 mg/kg/day 그리고 암컷의 경우는 NOAEL(No Observed Adverse Effect Level)은 5,000 mg/kg/day로 최종 확인되었다. 따라서, 암수 모두에서 시험물질의 NOAEL은 투여최대용량인 5,000 mg/kg/day로 확인되었다. 결론적으로, GMP를 원료로 하여 제조한 7%-GNANA(유청가수분해단백분말)는 투여 가능 최대용량에서도 독성이 없는 안전한 천연물이라는 것을 확인하였고, 의약품이나 기능성 식품으로서의 개발 가능성을 확인하였다.
감사의 글
본 연구는 농림축산식품부(기질 특이적 유기태화-미네럴류 제조법 확립을 통한 다기능성 사료첨가제 개발 및 수출용 기능성 미네럴 강화란 대량생산시스템 정립, 고부가가치식품개발산업, 제 113024-3호)에 의해 이루어진 것임.
References
Boorman, G. A. et al. 2006. Pathology of the fischer rat. Academic Press, INC., pp. 132-134 .

Gikins, Mary L. A. 2006. Clinical laboratory parameters for Crl:CD(SD) rats. Charles River Laboratories .

Iijima, R., Takahashi, H., Namme, R., Ikegami, S. and Yamazaki, M. 2004. Novel biological funtion of sialic acid (N-acetylneuraminic acid) as a hydrogen peroxide scavenger. FEBS Letters 561:163-166 .


Keenan, C., Elmore, S., Francke-Carroll, S., Kemp, R., Kerlin, R., Peddada, S. and Pletcher, J. 2009. Best practices for use of historical control data of proliferative rodent lesions. Toxicol. Pathol. 37:679-693 .



Lewis, R. W., Billington, R., Debryune, E., Gamer, A, Lang, B. and Carpanini, F. 2002. Recognition of adverse and nonadverse effects in toxicity studies. Toxicologic Pathology 30:66-74 .



Ministry of Food and Drug Safety (KFDA) Notice No. 2014-136 (Jul. 30, 2014) 'Guidelines for toxicity tests in drugs, etc.' KFDA Notice No. 2014-67 (Feb. 12, 2015) .

Moon, Y. I., Lee, W. J. and Sejong, O. H. 2005. Glycomacropeptide hydrolysed from bovine κ-casein ; Ⅱ. Chromatographic changes of κ-casein macropeptide as related to trichloroacetic acid concentration. Korean J. Food Sci. Ani. Resour. 25:478-482 .

Oh, S. J., Kim, S. H., Jeon, W. M., Kim, B. C. and Ki, Y. K. 1997. Glycomacropeptide hydrolysed from bovin κ-casein (I. The fractionation of glycomacropeptide). Korean J. Food Sci. Ani. Resour. 17(1):51-57 .

Organization for Economic Co-operation and Development (OECD). 2008. OECD guidelines 408 for the testing of chemicals: Repeated Dose 90 day oral toxicity study in oodents Organization for Economic Co-operation and Development. Paris, France. pp.1-10 .

Springer-Verlag, R. S. 1984. Sialic acids: Chemistry, metabolism and function. Carbohydrate Research 129:c5-c7 .


United States of Food and Drug Administration (USFDA). 2005. Guidance for industry estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers. Pharmacology and Toxicology. United States of Food and Drug Administration. Rockville. MD, USA. pp. 5-6 .

Wang, B., Yu, B., Karim, M., Hu, H., S., McGreevy, Y., Petocz, H. P., Held, S. and Miller, J. B. 2007. Dietary sialic acid supplementation improves learning and memory in piglets1-3. Am. J. Clin. Nutr. 85:561-569 .



Yoon, Y. C., Cho, J. K., Song, C. H., Lee, S. and Chung, C. I. 2000. Purification of the glycomacropeptide from cheese whey. Korean J. Food Sci. Ani. Resour. 20:159-165 .