ARTICLE
효소분리 및 용매정제법으로 제조한 고농도 Sialic Acid(23%)가 함유된 GMP 가수분해분말의 마우스 골수세포의 소핵시험을 이용한 안전성 평가연구
김희경1,*, 조향현1, 노혜지1
In Vivo Evaluation of the Safety of Hydrolyzed GMP Powder containing Highly Concentrated Sialic Acid (23%) produced by Enzyme Separation and Solvent Enrichment Method using Micronucleus Test in Mice
Hee-Kyong Kim1,*, Hyang-Hyun Cho1, Hye-Ji Noh1
Author Information & Copyright ▼
1MEDINUTROL Co., Yeonggwang 57024, Korea
*Corresponding Author : Hee-Kyong Kim, MEDINUTROL Co., Yeonggwang 57024, Korea. Tel.: +82-61-352-2166, Fax: +82-61- 352-2167, E-mail :
mulsambong@naver.com
ⓒ Copyright 2016, Korean Society of Milk Science and Biotechnology. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 8, 2016 ; Revised: Jun 15, 2016 ; Accepted: Jun 20, 2016
Published Online: Jun 30, 2016
Abstract
This study was designed to determine the mutagenic potential of hydrolyzed glycomacropeptide (GMP) powder (hereafter referred to as 23%-GNANA; product name: HELICOBACTROL-23) in a micronucleus test using bone marrow in ICR mice. Three experimental groups were used: a 3-step concentration group, with a maximum concentration of 2,000 mg/kg, and other sequentially two-fold lower concentrations, a negative control group, and a positive control group. The test material was administered for 2 d to observe the frequency of micronucleus formation up to 48 h after the test material was absorbed by the body. When the polychromatic erythrocyte (PCE) content of erythrocytes was compared, no significant differences were noted between the negative control group and the test group (p<0.05). Similarly, when the average numbers of micronucleated PCE (MNPCE) in 2,000 PCE per animal were compared, no significant difference was observed between the negative control group and the test group (p<0.05). No dose-response relationship with regard to the concentration of the test material administered was noted. These results allow us to conclude that hydrolyzed whey protein powder does not cause formation of micronuclei in mouse bone marrow cells under the applied conditions. In this study, the average frequency of micronucleus formation in PCE was significantly higher in the positive control group compared with the negative control group; thus, the test conditions were appropriate for detecting the frequency of micronucleus formation induced by the test material. In conclusion, the safety of 23%-GNANA test substance was verified in an in vivo micronucleus test in mice, conducted before the registration of HELICOBACTROL-23 as a food additive.
Keywords: hydrolyzed GMP (glycomacropeptide) powder; sialic acid; in vivo micronucleus test; frequency of micronucleus formation
서 론
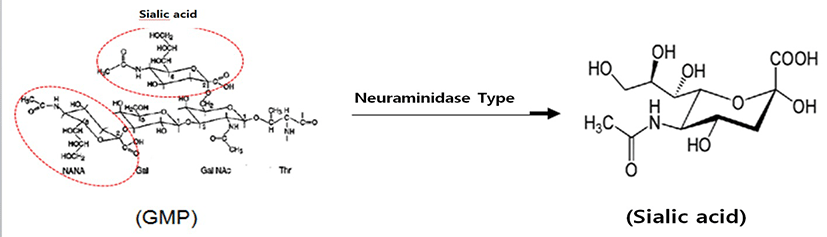
GMP(Glycomacropeptide)는 우유 속 단백질의 일종인 κ- casein에 chymosin의 작용으로 105번 Phe와 106번 Met 사이의 펩타이드 결합이 절단되어 생성되는 C-말단 63개의 펩타이드이며, 수용성 단백질이다(Yoon et al., 2000). 그리고 N-acetylneuraminic acid(sialic acid), galactose(gal) 그리고 N- acetylgalactosamine(GalNAc)의 3개의 당이 3개 또는 4개가 연결된 형태로 Thr나 Ser 잔기에 연결되어 있다(Ernest et al., 2000). 이중 sialic acid는 효소인 Neuraminidaseg가 분리(Fig. 1)할 수 있다(Moon et al., 2005).
Sialic acid는 nine-carbon sugar family에 속하는 단당으로 세포나 수용성 단백질에 당사슬 형태로 부착되어 있으며, 고등동물의 세포나 미생물에서 glucose로부터 생성된다(Wang et al., 2003). 그리고 기능성으로서는 수용기의 인지 및 신경 신호전달(Schauer et al., 1984), 뇌의 ganglioside의 구조와 기능에 역할을 하는 구성 물질이고(Wang et al., 2001), 뇌 발달과 인지능력 향상(Wang et al., 2009; Karim et al., 2007), 항염 및 항산화 등에 역할을 하는 것으로 알려져 있으며(Gorog et al., 1978), 현재 대부분 재조합 E. coli에서 합성되거나, E. coli로부터 생산된 효소를 이용해 N-acetyl-D-glucosamine으로 부터 합성되며, 일부가 화학적 합성방법으로 생산되어 대부분 의료용 소재로 활용되고 있으며(Iijima et al., 2004), 유청 단백질에서 분리한 sialic acid를 식품산업에 적용된 예는 국내외적으로 아직까지는 없다.
미소핵 검사(micronuclei test)는 1973년에 최초로 도입된 유전독성 검사 방법으로 마우스 골수(bone marrow)를 채취하여 도말한 후 다염성 적혈구(PCE, polychromatic erythrocyte)를 측정하면서부터 널리 이용되고 있다(Wandl et al., 1989; Heddle et al., 1973). 미소핵은 골수, 말초혈액, 체세포 조직 등 분화하는 세포 어느 곳에서도 관찰이 가능하지만, 그 중 적혈구가 핵을 가지고 있지 않으므로 관찰이 쉬어 많이 사용되고 있다(Ledeur, 1973; Schmid et al., 1975). 적혈구에서 미소핵은 May- Grünwald Giemsa stain에 의해 미성숙 적혈구인 PCE와 성숙한 적혈구인 정염성 적혈구(normochromatic erythrocyte, NCE)로 구분할 수 있다. 각종 약제 또는 독성물질의 세포유전학적 독성평가에는 Metaphase analysis, Sister chromatid exchange(SCE) 등이 많이 사용되었으나, 요즘에는 분석시간과 비용이 절약되면서 간편하게 정확한 결과를 도출시킬 수 있는 방법 중의 하나인 미소핵 검사가 널리 보편화되어 있다(Fenench et al., 1985; Sudharsan et al., 1982; Joskic et al., 1997).
본 연구에서는 안전식품 및 식품첨가물로 사용되고 있는 유청 단백질 내 지표성분인 sialic acid를 식품소재로 활용성을 높이기 위하여, 시험물질인 GMP 가수분해단백분말(23%- GNANA)을 GLP 가이드라인에 따라 “마우스 골수세포의 소핵시험”을 통한 안전성을 평가하였다.
재료 및 방법
1. 시험물질 준비
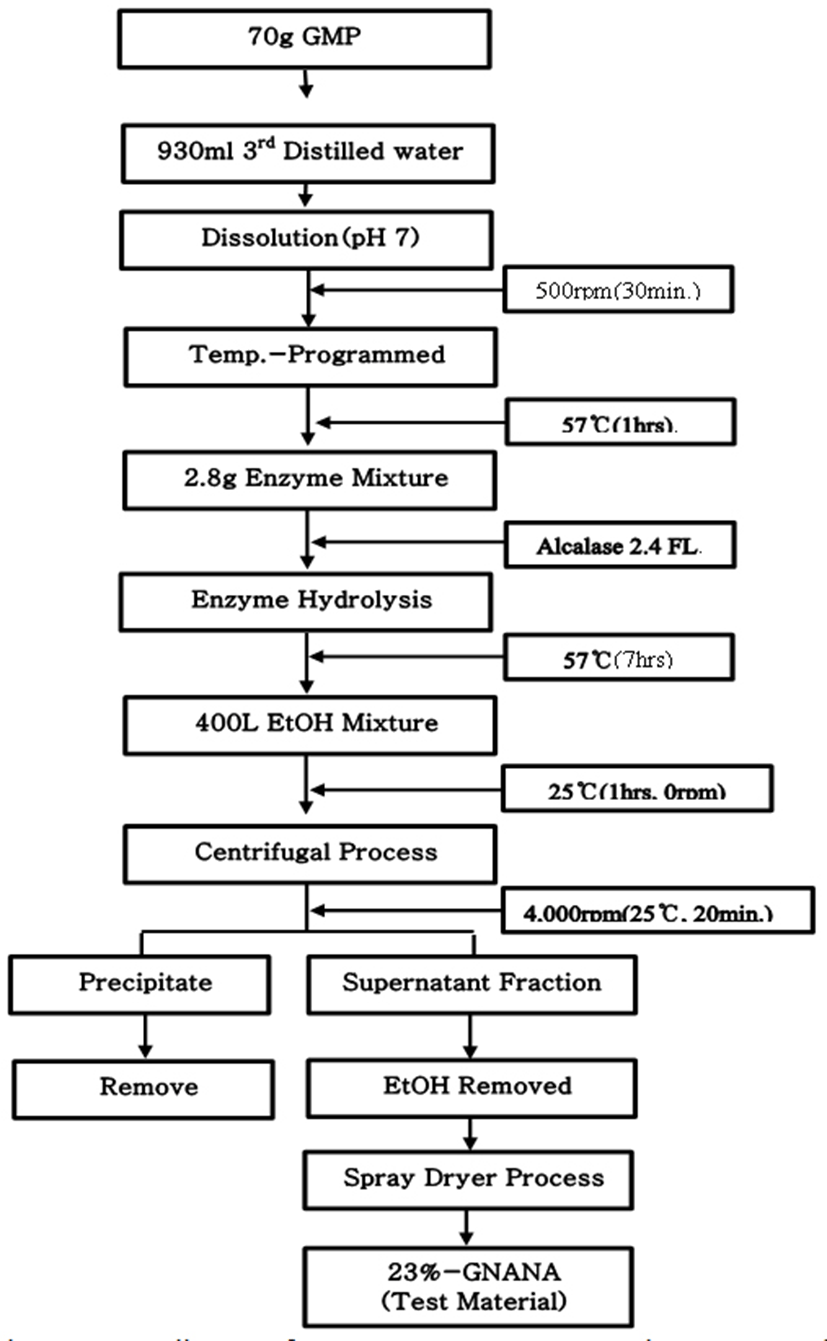
GMP는 sialic acid가 7%가 결합된 형태로 판매되는 Natra PepGMP(Murry Goulburn Co-Operative Co., Australia)을 구입하여 원료로 사용하였다. 시험물질 제조를 위하여, 정제수에 7% (w/v)되게 GMP를 용해시킨 후 효소 Alcalase 2.4FL(Novozymes Co., Denmark)를 기질 대비 0.24%(w/v)로 혼합하여 7시간(57℃) 동안 가수분해를 시켰다(Fig. 1). 그리고 가수분해 용액 2와 에탄올의 비율이 8이 되도록 혼합 후 에탄올 혼합에 따라 생성된 침전물을 제거한 후 이중 상등액만을 동결 건조시켜 제조한 HELICOBACTROL 제품(23%-GNANA)을 한일바이오메드사(한국)로 공여 받아 시험물질로 사용하였다(Fig. 2).
Fig. 2.
Manufacturing process diagram for 23%-GNANA, a test substance containing 23% sialic acid, through the enzyme (Alcalase 2.4 FL) separation mechanism of sialic acid, the marker compound having the glycomacropeptide (GMP) as a substrate, and the ethanol refining process.
Download Original Figure
2. 시험물질 내 지표성분 sialic acid 검정
시험물질 내 sialic acid의 분리효율 및 함유량을 확인을 위하여 10 mM Sodium Acetate Buffer 용액에 시험물질을 용해시킨 후, 에탄올 8 mL에 희석액 2 mL를 혼합한 후 이를 30분 동안 Sonication(25℃) 및 원심분리(3,000 rpm × 20 min, 25℃)과정을 실시하였다. 그리고, 상등액만을 0.22μm membrane으로 여과하여 이를 HPLC System(Agilent 1260, USA) 분석을 위한 시료로 사용하였다(Table 1).
시험물질 내 sialic acid의 분리효율 및 함유량 검정을 위한 표준체는 Sigma-Aldrich사(A2090)을 구입하여 0.1 ppm(w/w), 1 ppm 및 10 ppm 되게 희석하여 표준용액으로 사용하였다. 지표성분인 sialic acid의 검출허용오차는 90~110% 범위 내에서 평가하였다.
Table 1.
HPLC operation conditions for analysis of sialic acid
| 1. HPLC system (Agilent 1260) |
2. Analysis conditions |
․Pump: G1311C
․Auto sampler: G1329B
․Column: G1316A
․UV detector: G1314F |
․Wavelength: 205 nm
․Column: Aminex® HPX-87H Ion Exclusion Column (300×7.8 mm, 9 μm, Bio-Rad Co.)
․Mobile phase: 10 mM H2SO4
․Running time: 20 min
․Flow rate: 0.5 mL/min
․Injection volume: 10 μL
․Temperature: 40℃
․Standard Sol.(w/w): Silaic acid 0.1 ppm, 1 ppm, 10 ppm |
Download Excel Table
3. 마우스 골수세포의 소핵시험
1) 시험지침
본 연구는 한국식품의약품안전처의 “의약품등의 독성시험기준(고시 제 2014-136호, 2014.1.30), 비임상시험관리기주(고시 제 2014-6호, 2014. 2.12)”에 따라 실시하였다.
2) 시험동물 및 시험방법
시험동물은 7주령의 ICR 계통의 수컷 마우스(SFP)를 (주)코아텍(한국)로부터 구입한 후, 7일간의 검역과 순화 과정을 거쳐 건강한 개체만을 시험에 사용하였다. 사육환경 및 운영은 시험법을 준수하여 SPF 실험동물실 및 사육조건에서 실시하였다. 사료 및 음용수 공급을 위하여 실험동물용 고형사료(Altromin Spezialfutter GmbH & Co. KG, Germany)와 멸균된 음용수를 SOP 규정에 따라 검사를 거쳐 자유 섭이토록 하였다.
3) 시험물질 투여량 및 투여횟수 설정
시험물질은 유청단백질을 가수분해한 경우이므로 독성이 크게 없을 것으로 추정됨에 따라 예비시험을 생략하고, 마우스 2마리에 2,000 mg/kg을 투여하는 한계용량시험(limit dose test)를 실시하였다. 그 결과, 2마리 모두 생존하였기에 본 시험에서는 2,000 mg/kg 최고용량으로 하여 1,000 mg/kg과 500 mg/kg으로 투여량을 설정하였다. 또한 본 시험물질이 체내에서 대사되는 시간을 고려하여 시험물질을 2일간 투여하였다.
4) 시험군 구성
본 시험에서 시험군을 용매대조군 1군, 투여군 3군(500 mg/kg, 1,000 mg/kg, 2,000 mg/kg 투여군)과 양성대조군(Mitomycin C, 2 mg/kg)으로 구성하여 총 5군을 구성하였다. 각 군당 5마리씩 총 25마리의 마우스를 사용하였다.
5) 시험물질의 조제 및 투여방법
시험물질의 조제 및 투여액량 시험물질의 적정량을 용매대조물질인 멸균증류수에 용해하여 각각의 농도로 조제하였다. 조제된 시험물질의 투여액량은 체중 측정일에 측정한 체중을 기준으로 10 mL/kg으로 투여액량을 계산하였다. 투여횟수는 1일 1회로 하여 2일간 투여하였다. 투여경로는 사람에 대한 노출 예정경로로써 경구투여를 선택하였으며, 경배부 피부를 고정하고, 금속제 경구투여용 존데를 이용하여 시험기간 중 오후 2시에 강제 경구투여하였다.
6) 일반 증상 관찰
시험물질을 투여한 동물에 대하여 투여당일 및 부검 시 각 1회 관찰을 실시하여 사망동물 및 이상징후의 발생 여부를 관찰하였다.
7) 골수세포의 회수 및 검체 제작
문헌조사로 투여농도를 결정하여 2일간 시험물질을 투여하고, 최종투여로부터 약 24시간 후에 희생시켜 Fetal bovine serum (FBS)을 사용하여 대퇴골에서 골수세포를 회수하였다. 골수세포의 도말 표본을 만들어 고정한 후 광학현미경을 사용하여 도말 상태와 세포밀도를 확인하였다. 좋은 도말 표본을 선정하여 염색한 후 형광현미경을 사용하여 전체 적혈구와 PCE(Polychromatic erythrocytes) 중의 소핵 출현 적혈구를 계수하였다.
8) 표본의 염색
메탄올로 고정시킨 표본에 acridine orange(40 μg/mL)로 점적하여 커버글라스를 덮어 염색한 후 골수세포증식과 다염성 적혈구에 생성된 소핵을 관찰하였다.
9) 표본의 관찰방법
맹검법(blind method)에 의해 실시하였으며, FITC filter가 장착된 형광현미경을 사용하여 관찰하였다. 표본의 관찰기준은 핵이 없이 적색 형광빛을 나타내는 것을 PCE로 하였으며, NCE(normochromatic erythrocyte)는 형광빛을 나타내지 않고 음영으로만 구분되는 것으로 하였다. 소핵의 판정기준으로서 크기는 제일 큰 것은 적혈구 직경의 1/2 크기의 것으로, 제일 작은 것은 식별이 가능한 것까지로 하였다. 형태는 주로 원형이나 기타 도너츠형, 반원형 등의 형태의 것을 포함시켰으며, 색깔은 Acridine 염색표본에서 근접한 유핵세포의 핵과 동일하게 녹색 형광빛을 띠는 것으로 하였다.
10) 소핵의 계수
각 투여군의 동물로부터 제작한 검체 중 염색상태가 양호한 1매를 선택하여 무직위로 코드화한 후 검경하였다. 시험결과는 개체당 2,000개의 PCE 중에 나타나는 MNPCE 수치를 계수하여 mean±S.D로 표시하였으며, 이를 소핵 유발빈도로 하였다. 소핵 계수 후에 소핵 유무와 상관없이 합계 500개의 PCE와 NCE를 계수하여 PCE/(PCE+NCE)의 비율을 산출하고, 이를 세포독성의 지표로 설정하였다.
4. 통계처리
본 소핵시험의 결과 용매대조군에 대한 시험물질 투여군의 소핵출현빈도와 전체 적혈구당 다염성 적혈구 비율에 대한 유의성 검정은 5%의 유의수준(p=0.05)에서 one-way ANOVA, multiple comparision 분석을 통해 SPSS 19.0K 통계 프로그램을 이용하여 실시하였다.
결 과
1. 시험물질내 지표성분 sialic acid 검정
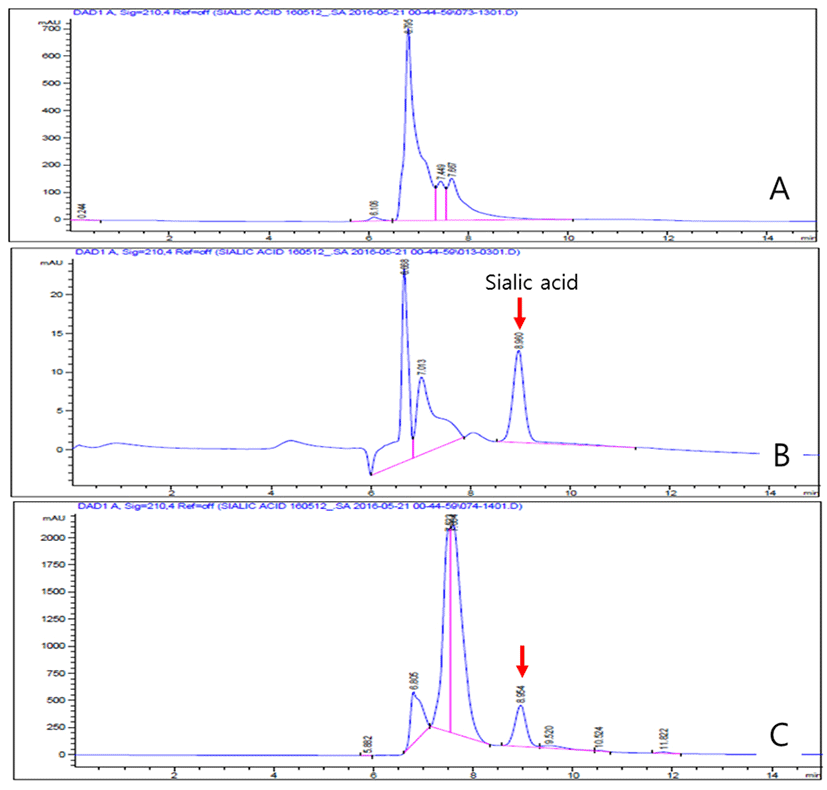
Fig. 3은 시험물질인 23%-GNANA 내 지표성분인 sialic acid의 분리효율 및 함유량을 분석한 결과로서, 23% sialic acid와 GMP 단백질이 87%(수분함량 제외)로 구성되어 있었으며, 분해효율은 100%였다. 따라서, 시험물질로 사용에 있어 적합함을 확인하였다.
Fig. 3.
Content evaluation results of sialic acid in hydrolyzed whey protein (23%-GNANA), a test substance, applying the HPLC analysis method compared to standard sialic acid. A: Non-enzymatically modified GMP, B: Standard sialic acid (25 ppm), C: Result of sialic acid detection in 23%-GNANA. 23%-GNANA was prepared through the ethanol enriching process and final hot air drying process after treating the 0.2% (v/v) alclase for 1 hour (40℃) versus GMP.
Download Original Figure
2. 일반증상 및 체중의 변화
Table 2는 시험물질인 23%-GNANA의 섭이에 따른 실험동물의 사망 및 일반증상 및 체중 변화의 검정결과, 시험기간 동안 모든 투여군에서 사망동물은 관찰되지 않았으며, 일반증상 관찰 결과, 이상증상이 관찰되지 않았다. 투여에 의한 시험군간 체중을 관찰한 결과, 모두 용매대조군에 비해 유의한 차이가 없었다(p<0.05).
Table 2.
The body weights changes after administered once on the day of 2nd oral administration of 23%-GNANA, a test substance to the male mice (n=25)
| Dose(mg/kg) |
Animal# |
Body weights (grams) |
| Grouping administration |
Sacrifice |
| 0(D.W.) |
1101 |
30.4 |
37.1 |
| 1102 |
33.2 |
33.7 |
| 1103 |
34.9 |
34.5 |
| 1104 |
35.9 |
33.7 |
| 1105 |
337.2 |
35.9 |
| Mean±S.D. |
34.3±2.63* |
35.0±1.50* |
| 500 |
1201 |
32.5 |
35.1 |
| 1202 |
33.9 |
36.8 |
| 1203 |
35.2 |
33.0 |
| 1204 |
36.2 |
35.0 |
| 1205 |
37.0 |
34.2 |
| Mean±S.D. |
35.0±1.81 |
34.6±1.05 |
| 1,000 |
1301 |
29.4 |
36.1 |
| 1302 |
34.4 |
34.3 |
| 1303 |
34.9 |
34.3 |
| 1304 |
36.3 |
35.6 |
| 1305 |
36.4 |
33.8 |
| Mean±S.D. |
34.2±2.85 |
34.8±0.96 |
| 2,000 |
1401 |
32.6 |
35.0 |
| 1402 |
34.4 |
34.3 |
| 1403 |
34.5 |
35.0 |
| 1404 |
35.8 |
34.9 |
| 1405 |
36.5 |
32.3 |
| Mean±S.D. |
34.8±1.49 |
34.3±1.16 |
| 2(Mitomycin C) |
1501 |
32.5 |
35.1 |
| 1502 |
33.9 |
35.0 |
| 1503 |
35.7 |
35.9 |
| 1504 |
36.1 |
33.3 |
| 1505 |
36.3 |
32.7 |
| Mean±S.D. |
34.9±1.65 |
34.4±1.33 |
Download Excel Table
3. 적혈구 증식억제 및 소핵출현 빈도 조사
Table 3은 시험물질인 23%-GNANA의 섭이에 따른 적혈구 증식억제 및 소핵출현빈도를 검정한 결과이다. 본 시험에서 양성대조군은 음성대조군과의 적혈구 증식억제율과 비교에서는 유의한 차이가 없었지만, 다염성 적혈구에서 관찰한 소핵출현 적혈구의 평균빈도에서는 유의하게 높아 시험물질의 소핵출현 빈도 확인을 위한 시험조건으로 적절한 것으로 판단된다.
Table 3.
The observations of micronucleus after administered once on the day of 2nd oral administration of 23%-GNANA, a test substance to the male mice (n=25)
| Dose(mg/kg) |
Animal# |
MNPCE observed |
MNPCE /2,000 PCE (%) |
PCEcounted |
PCE/200 RBC (%) |
| 0(D.W.) |
1101 |
3 |
0.15 |
81 |
40.5 |
| 1102 |
3 |
0.15 |
84 |
42.0 |
| 1103 |
3 |
0.10 |
77 |
38.5 |
| 1104 |
2 |
0.10 |
83 |
41.5 |
| 1105 |
3 |
0.10 |
82 |
41.0 |
| Mean±S.D. |
2.6±0.56* |
0.13±0.027* |
81.4±2.70* |
40.7±1.35* |
| 500 |
1201 |
3 |
0.15 |
81 |
40.5 |
| 1202 |
3 |
0.15 |
81 |
40.5 |
| 1203 |
3 |
0.15 |
76 |
38.0 |
| 1204 |
4 |
0.20 |
84 |
42.0 |
| 1205 |
2 |
0.10 |
80 |
40.0 |
| Mean±S.D. |
3.0±0.71 |
0.15±0.035 |
80.4±2.88 |
40.2±1.44 |
| 1,000 |
1301 |
2 |
0.10 |
77 |
38.5 |
| 1302 |
3 |
0.15 |
81 |
40.5 |
| 1303 |
3 |
0.15 |
77 |
38.5 |
| 1304 |
3 |
0.15 |
82 |
41.0 |
| 1305 |
3 |
0.15 |
80 |
40.0 |
| Mean±S.D. |
2.8±0.45 |
0.14±0.022 |
79.4±2.90 |
39.7±115 |
| 2,000 |
1401 |
2 |
0.10 |
80 |
40.0 |
| 1402 |
2 |
0.10 |
78 |
39.0 |
| 1403 |
3 |
0.15 |
80 |
40.0 |
| 1404 |
2 |
0.10 |
84 |
42.0 |
| 1405 |
4 |
0.20 |
77 |
38.5 |
| Mean±S.D. |
2.6±0.89 |
0.13±0.045 |
79.86±2.68 |
39.9±1.34 |
| 2(MMC) |
1501 |
32 |
1.60 |
87 |
43.5 |
| 1502 |
32 |
1.60 |
85 |
42.5 |
| 1503 |
31 |
1.55 |
83 |
41.5 |
| 1504 |
32 |
1.60 |
85 |
42.5 |
| 1505 |
35 |
1.75 |
81 |
40.5 |
| Mean±S.D. |
32.4±1.52 |
1.62±0.078 |
84.2±2.28 |
42.1±1.14 |
Download Excel Table
전체 적혈구 중 다염성 적혈구의 평균비율은 음성대조군에서 40.7±1.35%, 500 mg/kg 투여군에서 40.2±1.44%, 1,000 mg/kg 투여군에서 39.7±1.15% 그리고 2,000 mg/kg 투여군에서는 39.9±1.34%로 관찰되었다. 통계적 검정결과, 모든 투여군의 평균비율이 음성대조군과 비교하여 유의성이 없었고(p>0.05), 시험물질 투여군들에 있어서 시험물질에 의한 용량의존성 반응이 없었다. 동물개체별로 다염성 적혈구에서 관찰한 소핵출현 적혈구의 평균빈도는 음성대조군에서 0.13±0.027%, 500 mg/kg 투여군에서 0.15±0.035%, 1,000 mg/kg 투여군에서 0.14±0.022% 그리고 2,000 mg/kg 투여군에서는 0.13±0.045%로 관찰되었다.
통계적 검정결과, 소핵출현 적혈구의 평균빈도는 음성대조군과 비교하여 유의성이 없었으며(p>0.05), 시험물질 투여군들에 있어서 시험물질에 의한 용량의존성 반응이 없었다.
요 약
본 시험물질인 GMP으로부터 sialic acid를 분리 및 이의 농도를 23%로 높게 정제한 GMP 가수분해물(23%-GNANA) 분말에 대해 발암성 유발 유․무 판단의 기초자료를 얻기 위하여 마우스 골수세포를 이용한 소핵시험을 실시하였다. 결과로서, 다염성 적혈구의 소핵출현 적혈구의 출현비율은 음성대조군과 시험물질 투여군간 평균 차이의 유의성이 없었다(p<0.05). 또한 동물개체별로 관찰한 결과에서도 음성대조군과 시험물질 투여군간 유의성이 없었으며(p<0.05), 시험물질의 용량의존성 반응은 전체적으로 나타나지 않았다. 이러한 결과로 보아, GMP로부터 제조한 23%-GNANA는 고농도로 sialic acid가 농축되었을 뿐, 일반 식품인 GMP 수준에서 마우스 골수세포에 대해 소핵의 유발성이 없는 것으로 판단되었다.
감사의 글
본 연구는 농림축산식품부(기질 특이적 유기태화-미네럴류 제조법 확립을 통한 다기능성 사료첨가제 개발 및 수출용 기능성 미네럴 강화란 대량생산시스템 정립, 고부가가치식품개발산업, 제 113024-3호)에 의해 이루어진 것임.
References
Ernest, P. B. 2000. Biological activities of bovine glycomacropeptide. British Journal of Nutrition 84:39-46 .

Fenench, M. and Morley, A. A. 1985. Measurement of micronuclei in lymphocyte. Mutation Research 147:29-36 .


Heddle, J. A. A. 1973. Rapid in vivo test for chromosome damage. Mutation Research 18:187-190 .


Iijima, R., Takahashi, H., Namme, R., Ikegami, S. and Yamazaki, M. 2004. Novel biological funtion of sialic acid (N-acetylneuraminic acid) as a hydrogen peroxide scavenger. FEBS Letters 561:163-166 .


Joskic, G. Nikolic, M. and Tisma, V. S. 1997. Radiosensitivity of different aged human lymphocytes following electron irradiation in vitro. Neoplasma 44(2):117-121 .

Ledeur, M. V. and Schmid. W. 1973.The micronucleus test methodological aspects. Mutation Research 19:109-117 .


Moon, Y. I., Lee, W. J. and Oh, S. J. 2005. Glycomacropeptide hydrolysed from bovine κ-casein; Ⅱ. Chromatographic changes of κ-casein macropeptide as related to trichloroacetic acid concentration. Korean J. Food Sci. Ani. Resour. 17(1): 478-482. .

Schauer, R. and Wien, S. V. 1984. Sialic acids: Chemistry, metabolism and function. Carbohydrate Research 129:5-7 .


Schmid, W. 1975. The micronucleus test. Mutation Res. 31:9-15 .


Sudharsan, A. and Heddle, J. A. 1982. Simultaneous detection of chromosomal aberration and sister-chromatid exchanges. Toxicology and Applied Pharmacology 62:445-454 .

Wandl, E. O., Kain, R., Herbsthofer, T., Hienert, G. and Hobarth, G. 1989. Linear correlation between surviving fraction and the micronucleus frequency. J. Int. Radiat. Biol. 56(5): 771-775 .


Wang, B., Yu, B., Karim, M., Hu, H., S., McGreevy, Y., Petocz, H. P., Held, S. and Miller, J. B. 2007. Dietary sialic acid supplementation improves learning and memory in piglets1-3. Am. J. Clin. Nutr. 85:561-569 .



Yoon, Y. C., Cho, J. K., Song, C. H., Lee, S. and Chung, C. I. 2000. Purification of the glycomacropeptide from cheese whey. Korean J. Food Sci. Ani. Resour. 20:159-165 .