서론
젖소의 초유(colostrum)란 분만 후 약 48시간 이내에 분비되는 유즙을 말하며, 유즙의 조성분은 정상유(normal milk)와는 많은 차이가 있다. 초유는 분비되는 시간이 지남에 따라 고형분 성분이 급속히 감소된다. 초유는 송아지가 꼭 섭취해야 하는 물질로, 갓 태어난 송아지의 면역체계 기능을 강화하고, 외부로부터 침입한 병원성 미생물의 감염을 억제하여 개체를 방어하는 기능을 한다. 초유의 주요 성분은 면역인자(immune factors) 및 항균활성(antimicrobial activity)과 성장인자(growth factor)로, 면역인자와 항균활성 성분은 immunoglobulins, lactoferrin, lysozyme, lactoperoxidase, cytokines(Larson et al., 1977; Besser and Gay, 1994) 등이 있고, 성장인자는 IGF(insuline-like growth factor), EGF(epithermal growth factor), TGF-β(transforming growth factor), FGF(fibroblast growth factor) 등이 있다(Playford et al., 2000). IGF는 인슐린 유사성장인자로 기능을 하고 치매예방과 당뇨예방 효과가 있는 것으로 알려져 있다. EGF는 상피세포 성장인자로 피부염에 효과가 있고, TGF는 결합조직의 세포분열 증식을 하는 기능이 있어 뼈와 연골의 재생 및 상처 회복에 도움을 준다(Playford et al., 2000). 우리나라에서는 젖소 초유에서 성장인자들의 분리정제에 대한 연구가 활발히 이루어졌는데, Nam 등(2002)은 TGF-β1의 정제, Cho 등(2003)은 분리 정제된 IGFs의 안전성평가에 관한 연구, Hwang 등(2004)은 IGF-1 함유분획이 세포 성장에 미치는 영향에 대해 보고하였다.
우리나라의 초유 이용실태에 대해 Bae 등(2007)이 보고한 바에 의하면 1일 초유 생산량이 20~30 kg이지만, 송아지가 1일 섭취하는 초유량은 5 kg 전후로 조사되었는데, 남는 초유는 대부분의 목장에서 버리고 있는 실정이다. 따라서 송아지가 섭취하지 못한 잉여초유를 이용할 필요성에 대해 91%의 목장이 찬성하였다. 한편, 국내에 수입되는 초유 제품은 주로 뉴질랜드산으로 기능성 식품 및 조제분유 제조에 이용하고 있는데 수요가 급증하고 있지만, 국내산 초유 및 초유제품은 식약처에서 법적으로 허용하지 않고 있다. 초유 이용에 대한 소비자들의 관심은 높아가고 있지만, 법적 제한으로 이용할 수 없기 때문에 국내의 우수한 초유 자원을 이용하지 못하는 것이 현실이다. 따라서 소중한 식품자원인 초유의 이용성에 대해 깊이 고민할 시점이라 생각한다.
본 보고는 젖소 초유에 함유된 성장인자의 분포와 기능에 대해 이미 보고된 내용을 정리하여 살펴봄으로써 국내산 초유를 식품자원으로 이용을 하기 위한 기초 자료로 활용하고자 한다.
정상유와 초유는 몇 가지 성장인자 peptide를 함유하는데, 이는 포유동물 세포의 성장과 분화를 촉진시키는 기능이 있다. 성장인자는 모유에서 처음 발견(Klagsburn, 1978)되었고, 젖소 초유에서는 Klagsburn과 Neumann이 1979년에 발견하였다. 젖소 초유는 혈관 내피와 섬유아세포 성장인자를 포함하고 있고, 혈소판 유도 성장인자 또한 존재하는데, 섬유아세포 유사분열에 중요하고, 상처 치유에 도움을 주는 것으로 판단된다(Sacerdote et al., 2013).
젖소 초유에 가장 풍부하게 함유(IGF-1; 50~2,000 μg/L, IGF-2; 200~600 μg/L)되어 있고, 특성이 잘 밝혀진 성장인자로 알려져 있다. 열과 산에 안정하고, 세포 성장 발달과 분화의 매개체로 널리 분포되어 있다. 분자량은 7.6 kD로 single polypeptide chain으로 구성된 A, B, C, D 4개의 domain으로 구성되어 있다. Insulin은 D domain이 없고, C domain은 후에 잘려져 나간다. 생리활성 효과를 나타내기 위해서 IGF-1,2 receptor가 많은 세포에 존재해야 한다(Rathe et al., 2014).
세포의 분화촉진(특히 결합조직) 기능이 있고, T 세포나 상피세포의 활성화를 억제한다. 또한 배(embryo) 형성, 조직의 상처 회복, 뼈와 연골의 재생에 도움을 주고, IgA 생산 촉진 및 면역 체계 조절 기능이 있다. 점막면역/신생아의 장 상피세포 분화를 촉진하고, 항염증 효과 기능이 있다(Pakkanen et al., 1997; Playford et al., 2000). Cox와 Bürk(1991)는 우유로부터 TGF-β2 관련 polypeptide인 우유성장인자의 분리와 섬유아세포의 이동에 자극을 주는 특성을 보고하였고, Jin 등(1991)은 우유에서 milk growth factor(MGF)를 분리 정제하였고, 아미노산 서열을 밝힌 결과 TGF-β1과 TGF-β2로 구성되어 있으며, TGF-β2가 85%로 우세하게 함유되어 있다고 보고하였다.
EGF는 분만 직전에 유선의 발달의 조절인자로써 역할을 한다(Plaut, 1993). 53잔기의 아미노산으로 구성되어 있고, 침샘과 성인의 십이지장의 Brunners 선에 의해 생산되어진다. 사람 초유에는 200 μg/L, 정상유에는 30~50 μg/L 정도 함유되어 있고(Read et al., 1985), 젖소 초유에는 3~5 μg/L(Iacopetta et al., 1992) 정도 함유되어 있다. 피부 성장과 세포 재생 촉진 기능과 항염 작용 및 상처 치유 기능이 있다.
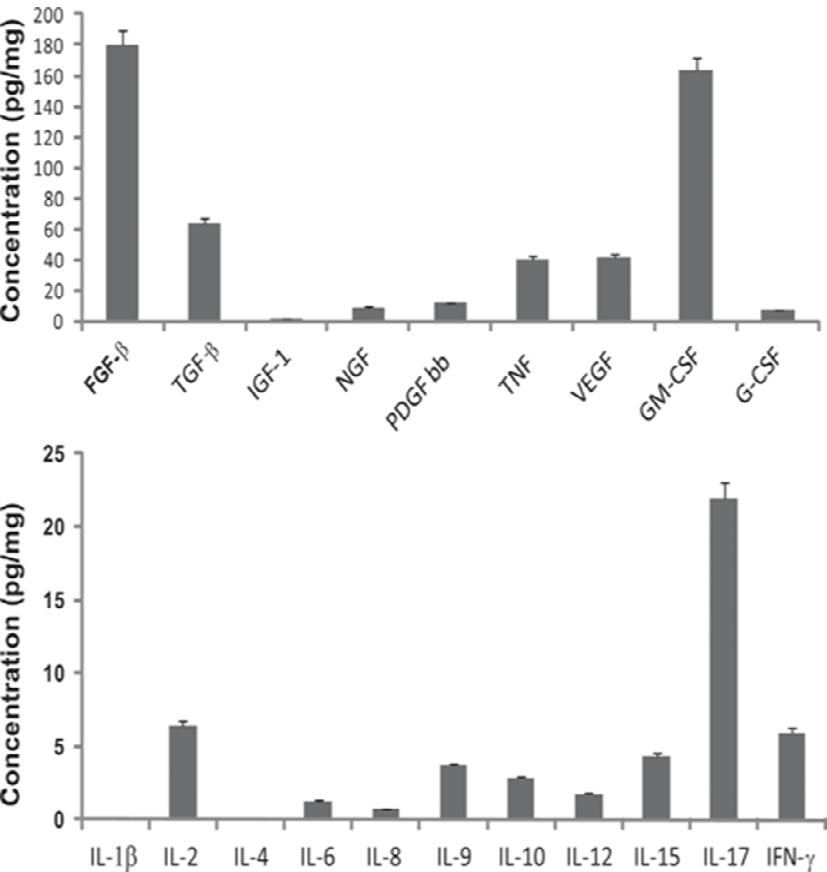
Fig. 1과 Table 1에 제시된 바와 같이 성장인자의 종류가 다양하고, 함유된 농도도 범위의 폭이 매우 넓다. Fig. 1에 나타난 바와 같이 초유에서 유도된 성장인자 중 FGF-β가 약 180 pg/mg으로 가장 높고, 그 다음이 GM-CSF로 170 pg/mg, TGF-β가 65 pg/mg, VEGF, TNF, PDGF bb, NGF 순으로 나타났다. Cytokine 중 T 세포에서 생산되고 미생물과 곰팡이 감염에 대하여 중요한 역할을 하고, proinflammatory 활성화(Gaffen, 2011)와 조혈세포의 조절 (Krstic et al., 2012)을 하는 IL-17이 23 pg/mg으로 가장 높고, IL-2가 7 pg/mg, IFN-γ가 6 pg/mg, IL-15, IL-9 순으로 나타났다. 또한 Table 1에 제시한 바와 같이 성장인자의 함량은 초유가 정상유보다 높게 함유되어 있음을 알 수 있다.
| Colostrum | Milk | Reference | ||
|---|---|---|---|---|
| EGF | Human | 200 μg/L | 30~50 μg/L | Playford et al. (2000) |
| Bovine | trace | trace | ||
| IGF-1 | Human | 18 μg/L | - | Playford et al. (2000) |
| Bovine | 50~2,0000 μg/L | 10 μg/L | ||
| IGF-2 | Human | 18 μg/L | - | Playford et al. (2000) |
| Bovine | 200~600 μg/L | 10 μg/L | ||
| TGF-β1 | Human | - | - | Purup et al. (2007) |
| Bovine | 6.3 μg/L | 1.5 μg/L | ||
| TGF-β2 | Human | - | - | Purup et al. (2007) |
| Bovine | 143 μg/L | 21 μg/L | ||
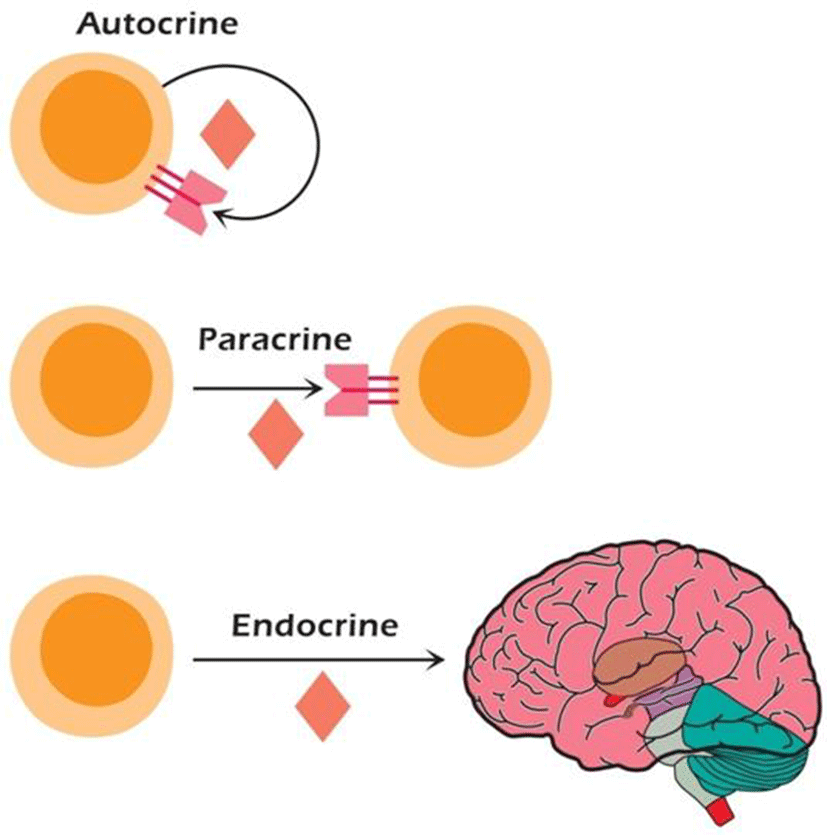
성장인자의 합성과 기능은 매우 신속히 일어나는데, 10-10~ 10-15 M의 아주 낮은 농도에서 세포간의 의사소통을 촉진한다. 또한 국소적 또는 전신적으로 작용할 수 있다. 국소적으로 작용하는 성장인자는 분비한 자신에 작용하는 자기분비(autocrine), 다른 세포에 작용하는 주변 분비(paracrine)가 있고, 전시적인 효과를 보이는 내분비(endocrin)가 있다(Fig. 2). 표적세포상의 특이적인 수용체에 결합하여 효과를 나타내므로 표적세포는 주어진 성장인자에 대한 수용체를 발현할 수 있어야 한다(Coci and Sunshine, 2009).
Kovacs 등(2009)의 보고에 의하면 인간 각질세포인 HaCaT cell의 배양에서 무혈청배지와 비교하여 보면 젖소 초유를 5%와 10% 처리하여 24시간 배양한 군이 HaCaT cell의 분화를 현저하게 촉진하였다. 이러한 결과는 10% FBS가 첨가된 배지에 배양한 HaCaT cell의 분화와 비슷한 결과를 나타내었다. 반면에 48시간 배양했을 때는 2%, 5%, 10% 초유 처리군과 무혈청 처리군은 차이가 없었으며, 10% FBS 처리군은 높게 나타났다. 한편, 20%의 고농도 초유 처리군은 24시간과 48시간 배양시에 세포의 성장이 억제되었다. 또한 젖소 초유가 Madin-Darby canine kidney epithelial cells(MDCK, Klagsburn, 1980)와 mouse hybridoma cells의 성장(Pakkanen et al., 1992)에 미치는 효과가 있는 것으로 나타나, HaCaT cell의 성장에 미치는 효과와 일치하였다.
Fig. 3은 인간 각질세포인 HaCaT cell에 무혈청, 5% 초유, 10% 초유, 105 FBS를 처리하여 24시간 동안 배양하여 세포의 성장을 관찰한 것이다. 세포 분화를 측정하는 방법으로 새롭게 만들어지는 DNA를 측정하는 방식으로 BrdU에 특이 항체에 형광물질 수용체 신호를 이용하여 측정하였다. Fig. 3의 a, c, e, g 는 BrdU incorporation assay를 나타내고, b, d, f, h는 현미경으로 세포의 성장을 관찰한 것이다. 무혈청배지 처리(a, b)에 비해 5%(59.8±2%)와 10%(59.2±3.4%) 초유 처리(c, d, e, f)가 10% FBS 처리(66±9.2%)와 비슷하게 세포의 분화가 현저하게 증가됨을 알 수 있었다. 젖소 초유의 성장촉진 활성은 이미 다양한 세포에서 성장인자를 포함한 고농도의 생리활성물질과 관련이 있다고 여러 학자가 보고하였다(Hironaka et al., 1997; Playford et al., 1999; Torre et al., 2006; Purup et al., 2007; An et al., 2009).
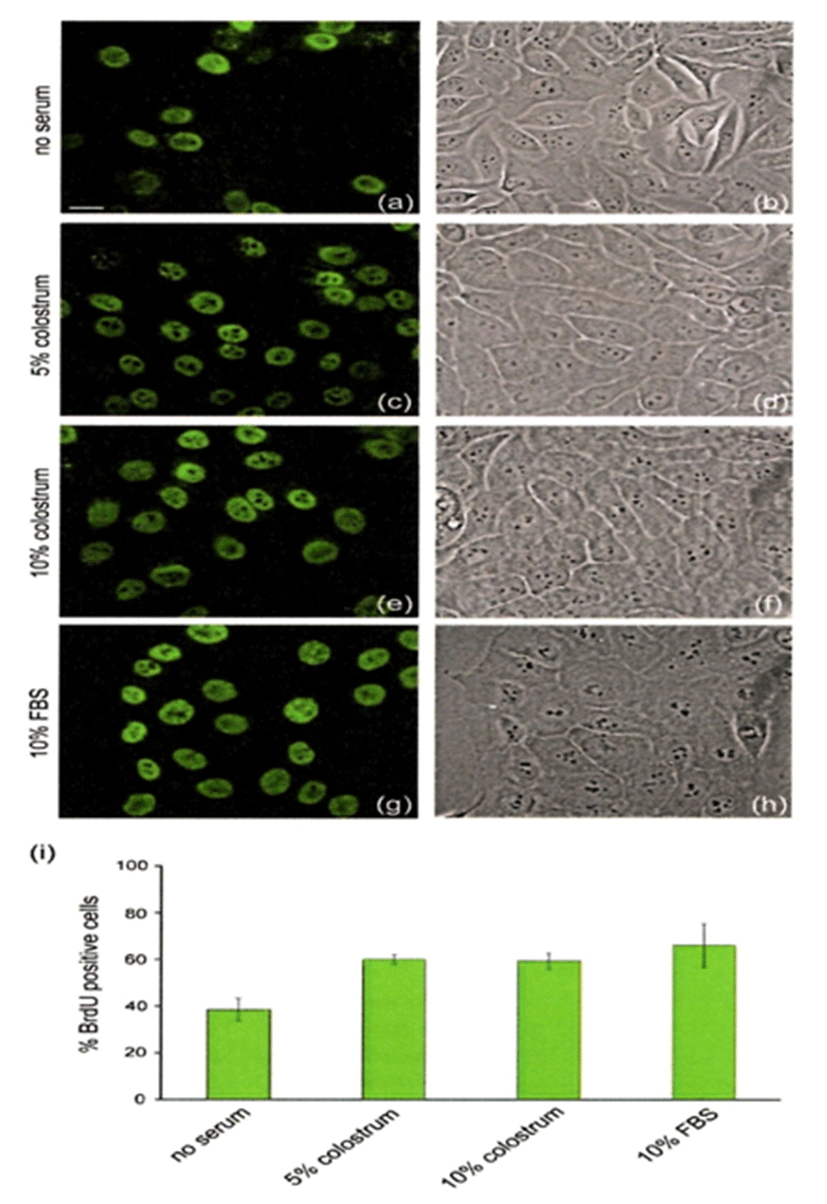
Fig. 4는 HaCaT cell에 무혈청, 10% 초유, 10% FBS를 처리하여 근육을 구성에 필요한 단백질인 actin 세포골격의 재구성에 대해 관찰한 것이다. 대조구인 무혈청 처리에 비해 10% 초유 처리(Fig. 4b)로 세포의 형태가 더욱 신장되었고, 이동성의 표현형이 전형적인 것으로 나타났다. 10% FBS 처리(Fig. 4C)의 경우는 positive control로써 10% 초유와 비슷하게 세포의 이동성이 유지되었다.
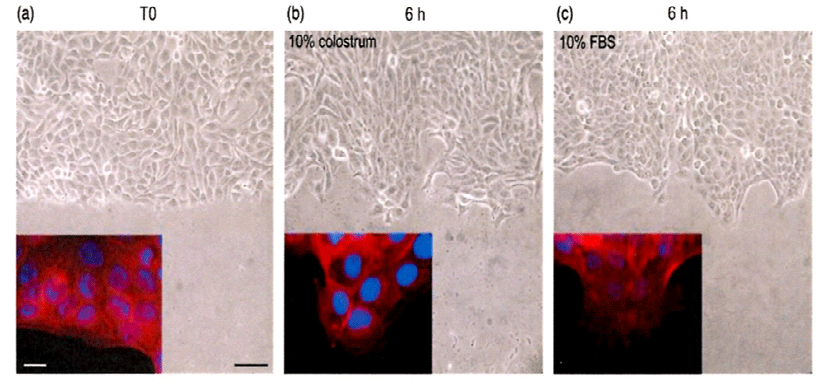
Fig. 5는 사람의 정상 피부조직을 획득한 후 젖소 초유가 각질형성세포의 분화에 어떠한 영향을 주는지 알아보기 위해 농도별로 처리하고, 각질분화가 일어날 때 증가하는 관련 구조단백질의 변화를 Western blot으로 분석한 것이다. 초유처리가 각질형성세포의 후기 분화표지자인 filaggrin과 loricrin이 현저하게 증가하는 것으로 나타났다. 아울러 초기 분화표지자인 K1, K10, involucrin 등의 발현도 증가하였다. 따라서 젖소 초유가 각질형성세포의 분화를 촉진하는 효과가 있어, 비정상 각질분화에 기인하는 아토피와 같은 만성피부질환에 적용이 가능하리라 생각된다.
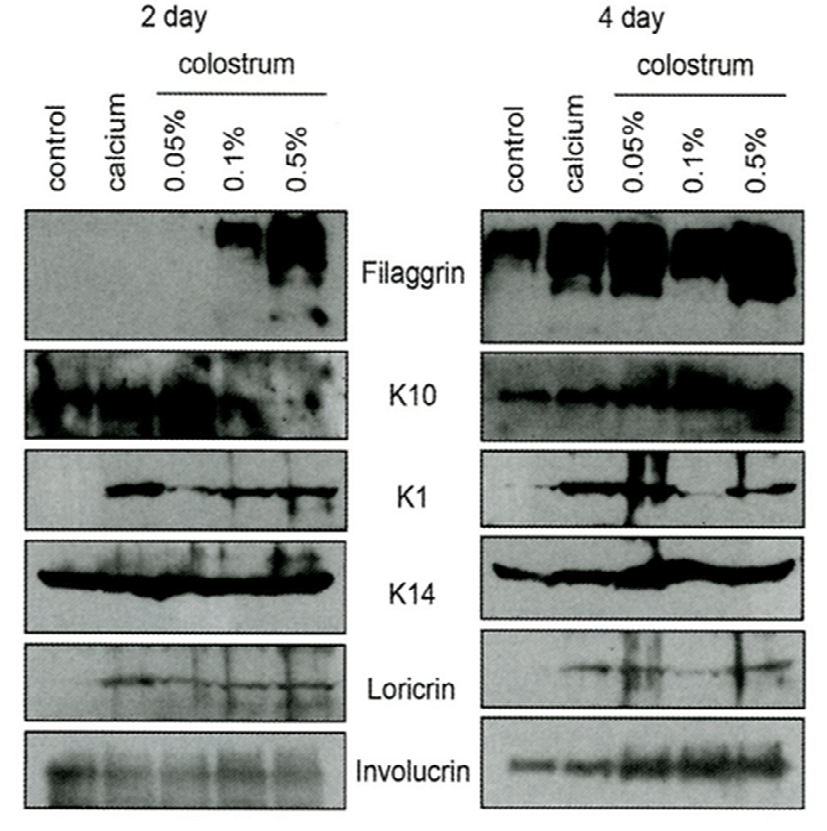
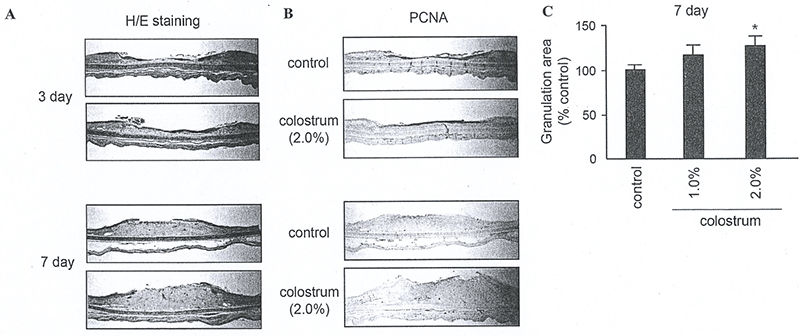
Fig. 6은 초유성분이 상처회복에 도움이 되는지 확인하기 위하여 토끼 귀를 시료로 사용하였다. 토끼 귀의 안쪽 면에 상처를 내고, 초유를 1일 1회씩 7일간 도포하고, 상처 회복을 관찰하였다. Fig. 6A와 같이 초유 처리군이 대조군에 비해 상처회복이 현저히 증가되지는 않았다. 또한 Fig. 6B에 나타난 바와 같이, 표피의 각질현성세포 및 진피의 섬유아세포 분열에 대한 효과는 뚜렷하게 세포분열 증가 효과가 나타나지 않았다. 그러나 Fig. 6C에 나타난 바와 같이 진피부에 형성되는 granulation tissue의 volume을 측정한 결과, 초유 처리군에서 20~30% 정도 증가하는 것으로 확인되었기에 초유가 상처회복에 어느 정도 도움을 줄 수 있을 것으로 판단된다. 이러한 결과는 초유가 각질형성세포 분화 초기 및 후기에 신호전달계를 활성화하기 때문으로 생각된다. Calcium과 같은 각질형성 분화촉진 인자는 protein kinase C(PKC)를 활성화 시키고, 하위 단계의 신호전달계에 영향을 주는 것으로 보고되어졌다(Bollag et al., 1993; O'Driscoll et al., 1994). 또한 ERK1/2 및 p38과 같은 mitogen activated protein kinase (MAPK)의 활성화가 각질형성세포 분화에 중요한 역할을 하는 것으로 알려졌다(Eckert et al., 2002; Efimova et al., 2003).
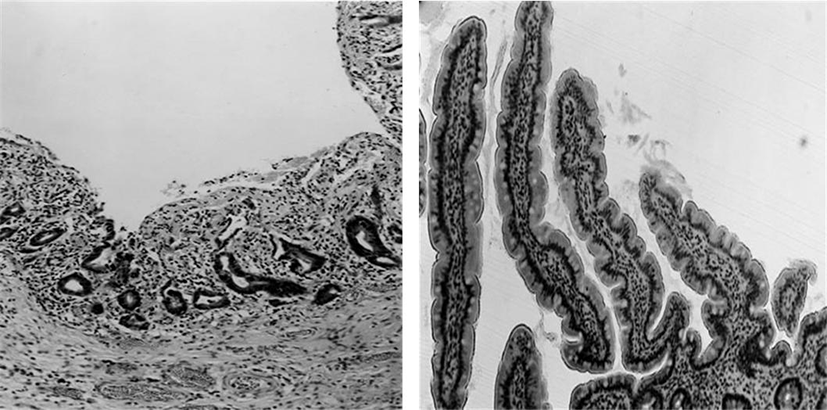
괴사성 소장결장염은 영유아의 생명에 위험을 주는 심각한 질병으로 소장과 대장에 심각한 괴사를 야기한다. 병인학은 불명확하지만 많은 위험 요소가 있는데, 조산, 장 감염, 장의 국부적 혈액 부족, 비정상적인 면역반응 등이 있다. 영유아에서 EGF의 연속적인 투여 결과, 현저하게 장의 조직학적으로 회복 효과가 나타났다(Fig. 7).
요 약
젖소 초유에는 성장인자가 풍부하게 함유되어 있는데, 상처 치유에 중요한 역할을 하고, 초유의 생리활성 기능을 담당하고 있다. Tyrosine kinase receptor의 활성을 유도하는 성장인자가 특이적으로 관여하여 세포의 분화, 면역기능, 신경기능 등 세포간 상호작용에 관여하는 EGFR(상피증식인자 수용체)와 FGFR(섬유아세포 증식인자)가 있다. 또한 VEGFR(혈관내피 증식인자)와 PDGF(혈소판유래 증식인자)도 존재한다. 조직회복을 위한 각질세포 분화와 세포의 이행에 성장인자가 상승효과를 나타내었고, 초유 또는 초유에 포함된 성장인자 peptide들은 장관질환 치료에 효과가 있으므로 치료제로 이용 가능성을 보여주었다.






