서 론
지방조직은 중성지방의 형태로 에너지를 저장하고 필요 시 지방산으로 분해하여 전신 대사 항상성 유지에 중요한 역할을 할 뿐만 아니라 adiopokine을 포함한 다양한 사이토카인 및 호르몬을 분비하는 주요 분비기관으로서도 역할을 한다[1]. 이러한 지방조직의 기능은 지방조직을 구성하는 지방세포의 상태와 밀접하게 연관되어 있으며 지방세포의 수와 크기는 대사 항상성 유지에 결정적인 영향을 미친다. 지방세포는 전구세포인 지방전구세포로부터 지방세포분화(adipogenesis) 과정을 통해 형성되며, 이 과정은 PPARγ, C/EBPs 등의 전사인자와 체내 에너지 신호 등에 의해 정밀하게 조절된다. 그러나 과영양 또는 운동 부족 등에 의한 과도한 지방세포 분화 활성은 비정상적인 지방세포의 크기 증가(hypertrophy) 및 숫자 증가(hyperplasia)로 과잉지방축적에 의한 비만의 직접적인 주요 원인 중 하나가 될 수 있다[2]. 비만은 단순한 체중 증가를 넘어 지방세포 기능 저하에 의한 인슐린저항성 및 지방조직 내 만성 저등급 염증(chronic low-grade inflammation) 등의 대사이상을 동반하며 당뇨병 및 심혈관질환 등 다양한 합병증의 위험 요소로 작용한다[1,3].
프로바이오틱스를 활용한 비만 조절은 대사질환의 치료 전략으로써 최근 주목 받고 있다. 유산균은 프로바이오틱스 미생물 중 하나로 숙주의 장내 미생물 조성을 개선하고 비만, 당뇨 예방 및 혈중 콜레스테롤 감소, 장-지방조직 축을 통한 지방조직의 염증완화 및 면역력 강화 등의 효과를 가지는 것으로 보고되고 있다[4–6]. 특히 최근 우리 연구에서는 다양한 Lactobacillussp.의 경구투여를 통해 고지방식이 마우스에서 지방세포 갈색화 촉진을 통한 에너지 소모 증가 및 체중 감소, 지방간 억제 및 인슐린저항성 개선 등의 효과를 확인하였다[7–12].
특히 본 연구에 사용된 Lactiplantibacillus plantarum L67(L67) 균주는 고지방 식이 마우스의 지방조직에서 SIRT1 발현 증가를 통해 PPARγ의 전사활성을 조절하여 지방세포의 에너지 소모를 촉진하고, adipose triglyceride lipase(ATGL)의 발현을 조절을 통해 지방분해를 촉진하였으며, 인슐린 저항성 개선 및 체중 감소 효능을 가지는 것으로 보고되었다[7]. 그러나 기존 연구와 비교하여 볼 때, L67에 의한 지방세포분화 과정에서 지방 축적 및 지방 분화 관련 유전자 발현을 포함한 대사 및 분자적 조절에 대한 영향을 명확히 규명되지 않았다.
본 연구에서는 L67이 지방세포의 지방세포분화에 미치는 효과를 검증하기 위해 3T3-L1 지방전구세포를 이용하여 지방분화 과정의 주요 유전자 발현과 지방축적에 대한 L67의 영향을 조사하였다.
재료 및 방법
3T3-L1 지방전구세포는 10% Bovine calf serum(Gibco, USA)과 1% penicillin/streptomycin(Gibco)이 포함된 DMEM(WELGENE, Korea) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. 3T3-L1 지방전구세포의 분화를 유도하기 위해 confluent 상태에서 2일 후 5% Fetal bovine serum(Gibco)와 1% penicillin/streptomycin을 포함한 DMEM(5% FBS DMEM)에 250 μM IBMX, 250 nM Dexamethasone 및 5 μg/mL insulin를 혼합한 분화유도 배지로 교체하였다(day 0). 이후 2일 간격으로 day 2와 day 4에 5% FBS DMEM에 5 μg/mL insulin을 혼합한 분화 유지 배지를 처리하였다. L67 균주는 MRS broth(BD Difco, USA)를 사용하여 37℃ 조건에서 24시간 배양 후 4,000×g에서 15분간 원심분리 후 상등액만 분리하여 L67 조건 배지(L67-CM)로 사용하였다. L67-CM은 3T3-L1 배양배지에 1/100 희석비율로 희석하여 48시간 간격으로 처리하였다.
3T3-L1 지방세포에서 RiboEX™(GeneAll, Korea)를 사용하여 total RNA 회수 후 MMLV-RTase (Promega, USA)와 Oligo dT primer(Promega)를 사용하여 cDNA를 합성하였다. RT-qPCR은 이전 연구와 동일한 방법대로 수행하였으며[10], 결과값은 36B4 발현을 기준으로 대조하여 분석하였다. PCR product의 상대적 정량은 2–ΔΔCt 방법을 이용하여 타겟 유전자와 36B4 유전자의 Ct 값의 차이로 계산되었다. 프라이머의 서열은 Table 1과 같다.
Day 6 3T3-L1 지방세포를 10% formalin에서 1시간 동안 고정시킨 후 60% isopropanol로 washing 하였다. 이후 Oil red O staining solution을 사용하여 10분간 염색 후 증류수로 washing 하여 Biotek Cytation 5(Agilent, USA)를 사용하여 관찰하였다. Oil red O 염색의 정량을 위해 isopropanol을 사용하여 3T3-L1 지방세포에 염색된 Oil red O 염색시약을 추출 후 490 nm에서 흡광도를 측정하였다.
결과 및 고찰
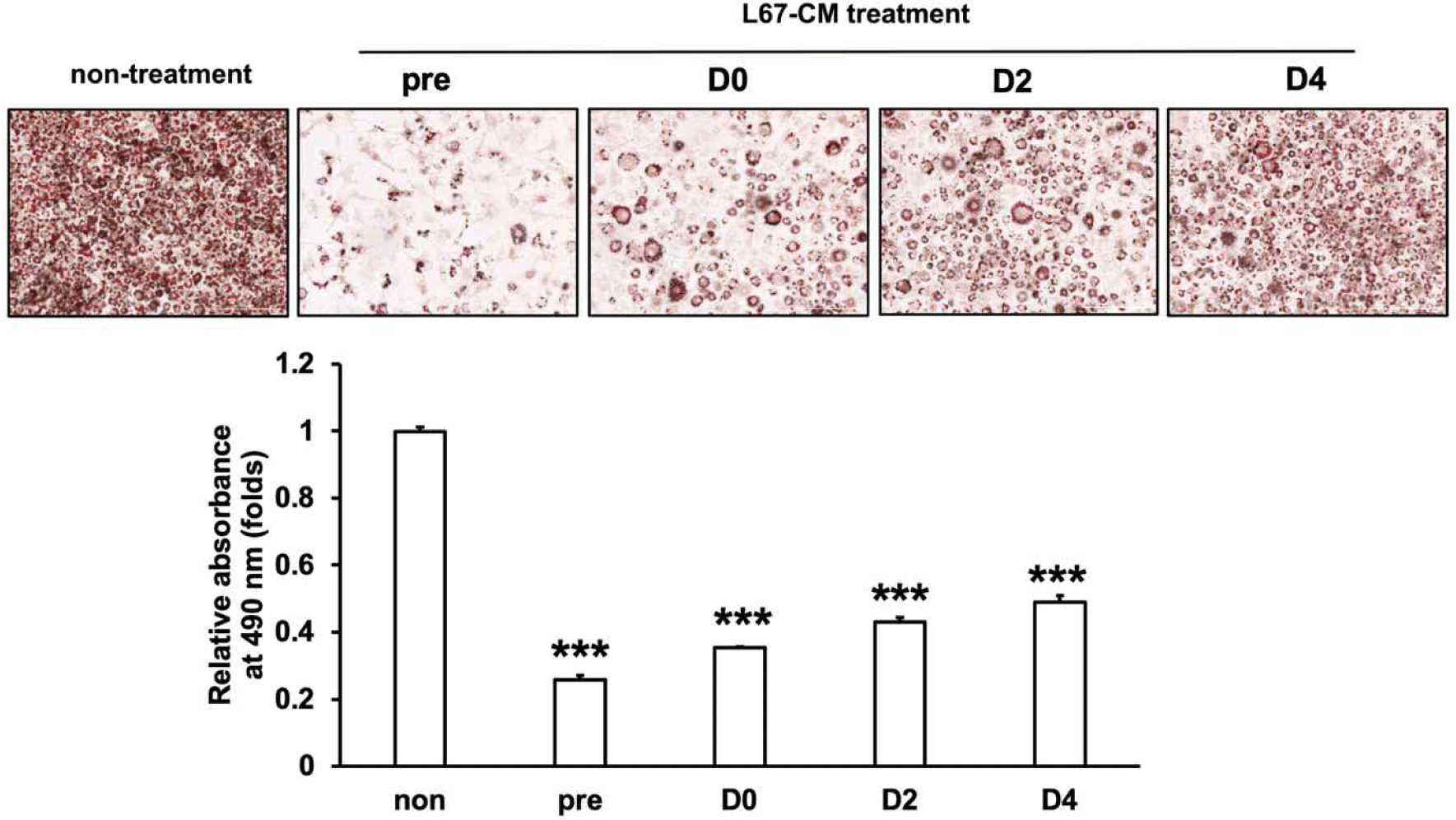
이전의 연구에서 고지방식이(high-fat diet, HFD) 유도 비만 마우스에 L67의 경구투여는 고지방식이에 의한 체중 증가 감소와 간 및 지방조직에서의 지질축적 및 인슐린 저항성 개선 효과를 가지는 것으로 확인되었다[7]. 특히 분화가 완료된 성숙된 지방세포에 L67-CM의 처리할 경우, 지방 축적을 억제하는 것으로 보고되었다. 본 연구에서는, 지방세포 분화 과정에서 유도되는 지방 축적에 L67이 미치는 영향을 조사하기 위해 3T3-L1 지방세포의 분화 과정 동안 L67-CM을 처리하여 Oil red O 염색을 통해 지방 축적 변화를 비교하였다. L67-CM을 각각 분화 전 3T3-L1 지방전구세포(pre), 지방세포 분화유도시작점(D0), 분화유도 2일차(D2) 그리고 4일차(D4)에 48시간 간격으로 처리를 시작하여 3T3-L1 지방세포 분화 종료시점(D6)에 Oil red O 염색을 실행하였다. Fig. 1에서 나타난 바와 같이, L67-CM을 처리하지 않은 대조군 3T3-L1 지방세포(non)와 비교하여 pre, D0, D2 그리고 D4 시점에 L67-CM을 처리를 시작한 3T3-L1 지방세포에서는 처리시작점에 따라 지방 축적이 50%–75% 감소하였다. 또한 분화과정 중 L67-CM을 처리한 시점이 빠를수록 더 높은 지방 축적 감소 효과를 보이는 것으로 나타났다. 이러한 연구결과는 고지방식이에 의해 유도되는 비만에 대한 L67의 억제 효과는 기존 지방세포의 에너지대사 촉진뿐 아니라 비만환경에서 촉진되는 지방세포 분화에 따른 지방세포의 수 및 크기 증가 억제를 통해 지방조직 내 과도한 지질 축적을 억제할 가능성을 제시한다.
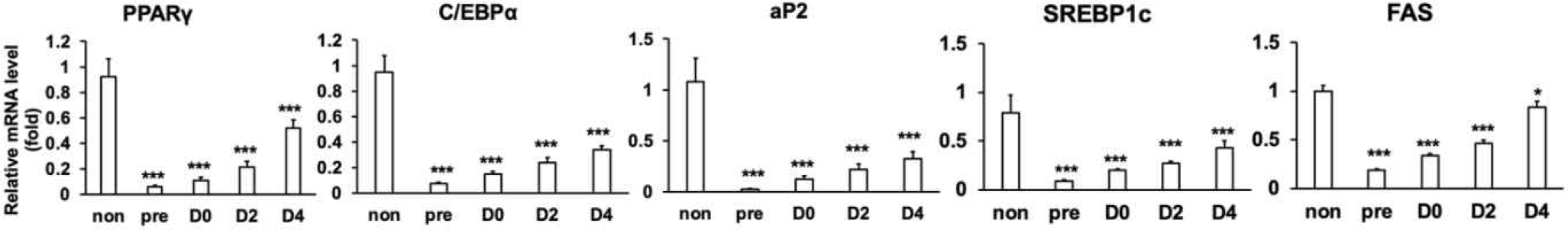
성숙한3T3-L1 지방세포에서 L67-CM의 처리는 L67 경구투여 쥐의 지방조직에서와 마찬가지로 지방합성의 주요 유전자를 억제하고 지방산산화, 지방분해 및 에너지대사의 주요 유전자 발현은 증가시키는 것으로 나타났다[7]. L67이 3T3-L1 지방전구세포의 분화과정에서 지방 축적을 억제하였으므로, 지방세포 분화과정 중 분화 및 지방 축적에 관련된 주요 조절자의 유전자 발현을 확인하기 위해 L67-CM을 각각 분화 전 3T3-L1 지방전구세포(pre), 지방세포 분화유도시작점(D0), 분화유도 2일차(D2) 그리고 4일차(D4)에 48시간 간격으로 처리를 시작하여 3T3-L1 지방세포 분화 종료시점(D6)에 RT-qPCR을 진행하였다. 지방세포 분화과정의 중기 및 후기를 조절하는 C/EBPα 와 PPARγ의 유전자 발현은 각 시점에서의 L67-CM 처리에 의해 대조군 3T3-L1 지방세포(non)와 비교하여 각각 65%–92%, 44%–94% 감소하였다(Fig. 2). 마찬가지로 지방세포 분화과정 후기에 PPARγ에 의해 유도되는 aP2의 유전자 발현은 L67-CM을 처리할 경우, 대조군 3T3-L1 지방세포(non)에 비해 70%–98% 감소됨을 확인하였다. 또한 지방세포 분화과정 동안 지질생합성의 핵심 조절자인 SREBP-1c와 FAS 유전자 발현의 경우, L67-CM 처리에 의해 대조군 3T3-L1 지방세포(non) 대비 각각 46%–89%, 17%–81% 감소하는 것으로 나타났다. L67에 의한 지방세포 분화 및 지질합성에 관련된 핵심 유전자들 발현에 대한 본 결과는 지방세포 분화과정 동안 L67처리에 의한 지방 축적 억제하는 것과 일치하는 결과로, L67은 C/EBPα, PPARγ 및 aP2와 같은 지방세포 분화 과정의 핵심 조절자의 발현 조절을 통해 지방세포 분화를 억제하고, SREBP-1c 및 FAS의 발현을 조절하여 지질생합성 및 지방적의 형성 및 축적을 저해할 가능성이 있는 것으로 확인되었다.
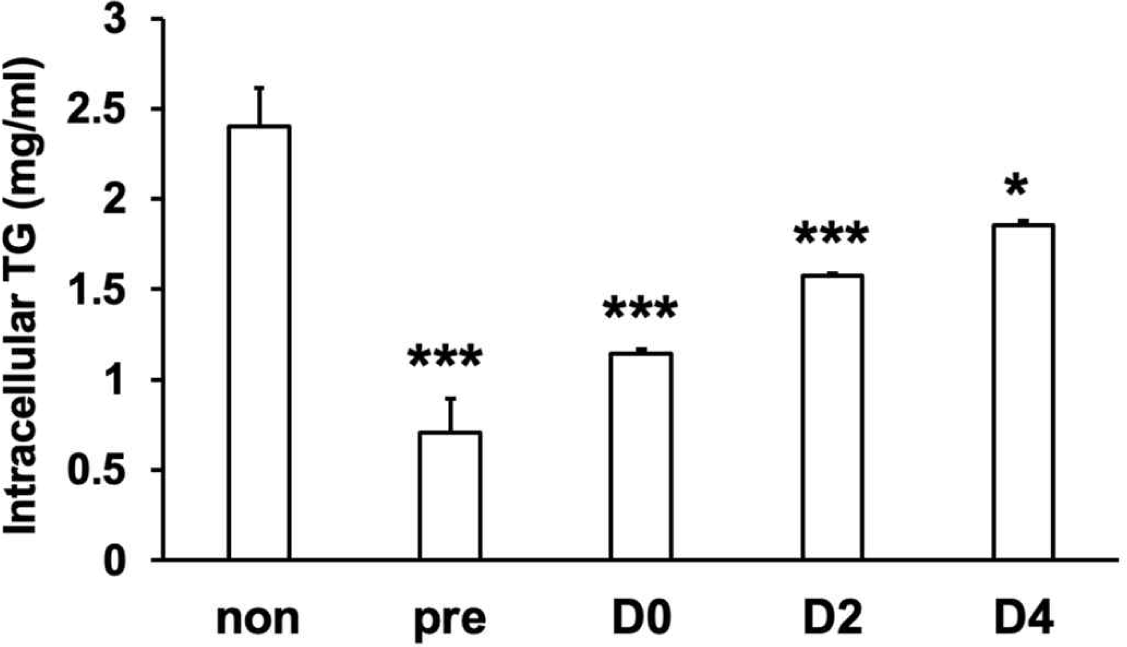
이전의 연구에서 L67의 경구투여는 고지방식이 마우스의 혈중 중성지방 함량 및 지방조직의 중성지방 함량을 낮추는 것으로 확인되었으며, 3T3-L1 지방세포에서 L67-CM에 의해 세포 내 중성지방 함량이 감소하는 것으로 나타났다[7]. 성숙한 지방세포는 분화 과정에서 합성되는 지방산에 의해 생성된 중성지방을 지방적 형태로 저장하는 역할을 하며, 3T3-L1 지방세포 분화 과정에 참여하는 주요 조절자의 유전자 발현 조절 및 분화과정 중 지방 축적에 대한 L67-CM의 억제 효과를 확인하였으므로, L67이 세포 내 중성지방 함량에 영향을 주는 지 알아보기 위하여 3T3-L1 지방세포 분화 과정 동안 L67-CM을 처리 후 중성지방 함량을 측정하였다. 실험 결과, L67-CM 처리 시점에 따라, 대조군 3T3-L1 지방세포(non)와 비교하여 세포 내 중성지방함량이 pre, D0, D2 및 D4 조건에서 각각 71%, 53%, 35%, 23% 감소하였다(Fig. 3). 이 결과는 Fig. 1의 Oil red O 염색 결과와 더불어, Fig. 2에서 보여진 L67-CM에 의한 각 유전자들의 발현 변화가 실질적인 중성지방 축적 저해로 이어졌음을 제시한다. L67-CM에 의해 발현 감소가 확인된 SREBP-1c의 경우 AMPK 또는 PKA에 의한 인산화로 활성이 억제되는 것이 알려져 있으며, PPARγ의 경우 AMPK-SIRT1에 의한 전사활성 조절이 알려져 있고, 특히 이전 우리의 연구에서 Lactobacillus sp.에 의해 고지방식이 마우스의 대사조직에서 AMPK-SIRT1 또는 PKA의 활성이 촉진되는 것이 밝혀졌으므로, 이러한 인산화 및 탈아세틸화 효소에 의해 L67의 지방세포 분화과정 억제 효과가 매개될 가능성이 있다[8,10,12–14]. 본 연구에서는 L67이 3T3-L1 지방세포에서 지방 축적, 주요 유전자 발현 및 세포 내 중성지방을 조절하여 지방세포 분화를 억제함을 in vitro 수준에서 검증하였다. 이러한 결과는 단일 세포주 기반의 실험으로, 향후 다양한 지방세포주 및 동물 모델에서의 검증이 필요하다. 또한 이전의 연구를 바탕으로, L67에 의한 지방세포 분화의 주요 유전자 발현 조절에 대한 전사 수준의 메커니즘과 이를 조절하는 신호 전달 경로에 대한 연구를 추가적으로 실시할 수 있다.
종합적으로, L67은 지방세포 분화 및 지질 생합성에 참여하는 각 전사 인자의 유전자 발현 뿐만 아니라 전사 활성 조절을 통해 하위 유전자 전사조절을 기반으로 지질분해, 지방산산화, 열생성 반응 등의 다양한 지질 대사를 조절할 가능성을 제시한다.
요 약
비만과 인슐린저항성과 같은 대사성질환은 지방조직의 기능이상과 밀접한 관련이 있다. 최근, 우리는 프로바이오틱스 균주 중 하나인 L67이 고지방식이 유도 비만 마우스에서 지방조직의 에너지소비를 자극하여 체중 중가, 인슐린 저항성을 완화함을 관찰하였다. 지방생리에 대한 L67의 역할에 대해 보다 자세히 알아보기 위해 3T3-L1 지방전구세포를 이용하여 L67이 지방 생성과 지질 축적에 미치는 영향을 조사하였다. 지방세포 분화기간 동안 3T3-L1 지방전구세포에 L67-CM를 처리할 경우, 처리기간에 따라 3T3-L1 지방세포의 오일 레드 O 염색을 최대 75%까지 유의하게 감소시켰다. 또한, 유전자발현 분석 결과, L67은 3T3-L1 지방세포에서 지방세포 분화에 관여하는 주요 전사인자(PPARγ 및 C/EBPα)와 주요 지방형성 유전자(SREBP-1c 및 FAS)의 발현을 뚜렷하게 억제하는 동시에 지방세포 분화의 특징인 aP2의 발현을 감소시키는 것으로 나타났다. 위의 결과와 일치하게 L67-CM 처리는 3T3-L1 지방세포의 세포내 중성지방 수치를 감소시켰다. 이러한 결과는 L67이 지방세포의 형성과정과 관련된 유전자의 발현을 억제함으로써 지방세포 분화 및 지질축적을 억제할 가능성을 시사하며, 이는 대사질환 치료를 위한 프로바이오틱스로서의 L67의 잠재력을 제시한다.
