서 론
대한민국은 2025년 현재 65세 이상 인구가 약 1051만 명(전체 인구의 약 20.3%)으로 초고령 사회에 진입하였다[1]. 2020년부터 2023년까지 노인의 만성질환별 유병률 현황에 따르면 노인성 질환 중 특히, 대표적인 뼈 건강 질환 중 하나인 골다공증의 유병률 증가가 확인되었다[2,3]. 최근 국민건강영양조사 통계에 따르면 우리나라 65세 이상 성인의 전체 칼슘 권장섭취량은 기준치(100%) 대비 64%로 노인 인구군에서 전반적인 칼슘 섭취 부족이 확인되었는데 이러한 칼슘 섭취량 부족 이슈는 골다공증과 같은 뼈 질환 예방 및 감소 측면에서 주요 관심사로 자리잡고 있다[4].
칼슘은 체내에서 합성되지 않아 식품 및 칼슘 보충제를 통해 섭취하여야 하며, 성인의 경우 칼슘 권장섭취량 대비 15%–20% 정도 흡수되고 나이가 들수록 노화에 따른 위산 분비 저하로 인해 칼슘 흡수율은 지속적으로 감소한다[5]. 일반적으로 널리 이용되는 칼슘 보충제 중 하나인 탄산칼슘 형태의 칼슘 보충제는 위산과 반응하여 흡수 가능한 용해된 이온화 칼슘으로 전환되어 장 내에서 흡수가 이루어진다[6]. 그러나 노화로 인한 위산 분비 감소는 섭취된 칼슘 보충제가 흡수 가능한 이온화 칼슘 형태로 전환되는 과정을 방해하여 결과적으로 칼슘 흡수율 감소에 기여하게 된다[6]. 따라서 칼슘 보충제의 낮은 용해도 문제점을 최소화하여 칼슘 흡수율을 향상시킬 필요성이 제기되고 있다.
본 연구에서는 칼슘 보충제 사용의 한계와 노화로 인한 칼슘 흡수율 저하 문제점을 해결하기 위해 나노 복합체(nanocomplex)를 개발하였다. 본 나노 복합체는 음전하를 지닌 카제인 포스포펩타이드(casein phosphopeptide, CPP)와 양전하를 지닌 키토 올리고당(chitosan oligosaccarie, CSO)을 이용하여 상호 간의 정전기적 인력을 이용하여 제조하였으며 기존 미세 전달시스템에 비해 크기가 200 nm 이하로 매우 작아 장 상피세포와 흡착 가능한 표면적이 증가하여 칼슘의 흡수율 측면에서 큰 장점을 지니고 있다[7-10].
CPP는 칼슘과 결합할 수 있는 펩타이드인 인산화세린 잔기 및 글루탐산 잔기(Ser(P)-Ser(P)- Ser(P)-Glu-Glu)로 구성된 acid motif를 지녀 칼슘과 효과적으로 결합가능하며[11], CPP와 결합된 칼슘(CPP-Ca)은 모의 장 소화 중 칼슘의 용해도 증진 및 장 내 칼슘 흡수를 방해하는 항영양소인 옥살산(oxalic acid), 피틴산(phytic acid)과의 상호작용으로 인한 칼슘의 침전물 형성을 억제한다고 알려져 있다[12]. 또한 CPP는 장 상피세포막에 존재하는 TRPV6와 L-type calcium channel을 통한 칼슘의 세포내 경로를 통한 흡수(transcellular uptake)를 향상시키는 것으로 알려져 있다[13]. CPP와 같이 나노 복합체에 활용되는 CSO는 장 상피세포 간 밀착 연접(tight junction)을 조절하여 칼슘과 같은 미네랄의 흡수를 증진시킬 수 있어 세포 간 경로(paracellular pathway)를 통한 칼슘의 흡수 강화제(absorption enhancer) 역할이 가능하다[14]. 따라서 본 연구의 목적은 카제인 포스포펩타이드-키토올리고당 나노 복합체를 제조하고 복합체 제조 공정(CPP 농도와 pH)에 따른 나노 복합체의 물리화학적 특성을 조사하고 나노 복합체 적용에 따른 장 내 칼슘 흡수 연구를 수행하는 것이다.
재료 및 방법
카제인 포스포펩티드(CPP)는 Friesland Campina(The Netherlands)에서, 키토올리고당(CSO)은 Amicogen(Korea)을 사용하였으며, DEME(Dulbecco's modified Eagle medium)와 FBS(fetal bovine serum)는 Hyclone(Logan, USA)의 제품을 사용하였다.
CPP-CSO 나노 복합체 제조는 modified ionic gelation 방법을 이용하였다[8]. CPP 용액은 0.1%, 0.3%, 0.5%(w/v)의 다양한 농도와, CSO는 0.003%(w/v) 농도로 준비하였으며, 농도별 CPP-COS 혼합용액을 제조하였다. CPP-CSO 나노 복합체는 제조된 CPP-CSO 혼합용액에 0.3 mM CaCl2 용액 첨가 이후, 0.2M HCl로 pH를 5.5와 6.5로 조정하여 나노 복합체를 개발하였다. 제조된 나노 복합체 용액은 식품의 적용성을 높이기 위해 -80℃ 온도에서 1일 이상 동결시킨 후, 동결건조기(FD-1000, Tokyo Rikakikai, Japan)를 통해 분말화 하였다.
CPP-CSO 나노 복합체의 형성 여부 및 물리화학적 특성은 입자 크기(particle size), 다분산 지수(polydispersity index, PDI), 및 표면전하(zeta-potential)를 평가하였으며, 입도분석기(particle size analyzer, Nano-ZS, UK)를 이용해 측정하였다.
배양 배지는 DMEM에 20% FBS와 1% penicillin-streptomycin(10,000 U/mL, Gibco, Scotland)을 첨가하여 준비하였으며, Caco-2 세포주는 해당 배지에서 37℃와 5% CO2 조건에서 계대배양 하였다. Caco-2 세포주의 passage number는 10-26 및 30-36를 이용하였으며 CPP-CSO 나노 복합체의 세포 내 독성(cytotoxicity) 및 칼슘 흡수 연구를 위해, Caco-2 세포를 96-well plate(Greiner Labortechnik, Germany)와 24-well cell culture insert(transwell, polycarbonate membrane, 0.4 μm pore size, SPL Life Science, Korea)에 1×105 cells/mL의 밀도로 각각 접종하였다. 이후 48시간 간격으로 배지를 교체하며 4-5주간 배양하여 세포가 증식하여 형성된 confluent 상태의 Caco-2 단층(monolayer)을 실험에 이용하였다.
CPP-CSO 나노 복합체의 세포독성 평가는 Yeh et al.에 제시된 WST-1 assay을 이용하여, 세포 생존율을 측정하였다[15]. Caco-2 세포를 1×105 cells/mL의 밀도로 96-well plate에 분주하였으며, 48시간 배양하였다. 배양 후 세포를 phosphate buffered saline(PBS)으로 2회 세척하고, 다양한 농도(0.01, 0.025, 0.05 μg/mL)의 나노 복합체가 함유된 100 μL의 무혈정 배지(serum-free DMEM)를 96-well plate에 첨가하였다. 세포독성 평가를 위해 각 well에 10 μL의 EZ-Cytox (Dogen, Korea)을 첨가하고 3시간 동안 반응시켰다. 반응 이후 microplate reader(Multiskan EX, Thermo Electron, USA)를 이용하여 450 nm에서 흡광도를 분석하였으며, 세포생존율은 Hu et al.에 제시된 수식에 따라 계산하였다[16].
CPP-CSO 나노 복합체의 장내 칼슘 흡수 능력은 Caco-2 세포 단층에서의 칼슘 흡수 분석을 통해 평가하였다. Caco-2 세포주를 24-well cell culture insert에 1×105 cells/mL 밀도로 접종한 후, 단층이 형성될 때까지 48시간마다 배지를 교체하며 배양하였다. Caco-2 세포 단층 형성 여부는 TEER(transepithelial electrical resistance) 값을 측정하여 확인하였으며, TEER 값이 330 Ω×cm2 이상 도달하였을 때 단층이 형성된 것으로 판단하였다[17]. TEER 값은 Chen et al.에 제시된 수식에 따라 계산하였다[18].
TEER 값이 330 Ω×cm2 이상인 Caco-2 세포 단층은 Hank’s balanced salt solution without calcium and magnesium으로 두 차례 세척한 뒤, 37℃, 5% CO2 조건의 배양기에서 30분간 평형화(equilibration)하였다. 이후 transwell 상단(apical side)에 칼슘 함유 CPP-CSO 나노 복합체 용액(300 μg/well)을 첨가한 다음 60분간 반응시킨 후 단층을 통과하여 하단(basolateral side)으로 이동한 칼슘 농도를 측정하였으며, 분석은 ICP(inductively coupled plasma; PerkinElmer, OPTIMA 4300DV, USA)를 이용하여 수행하였다.
결과 및 고찰
나노 복합체 제조시 공정요인인 CPP 농도가 카제인 포스포펩티드(CPP)-키토올리고당(CSO) 나노 복합체의 물리화학적 특성에 미치는 영향에 대해 평가하였다(Fig. 1). CPP-CSO 나노 복합체의 입자크기는 CPP 농도가 증가함에 따라 유의적 차이(p<0.05)를 보이며 증가하였다(Fig. 1 A). 이는 pH 6.5 조건에서 CPP의 등전위점이 약 3.1이고, CSO의 pKa가 약 6.3이기 때문에[19], 음전하를 띠는 CPP 농도가 증가함에 따라 양전하를 지닌 CSO와 정전기적 상호작용(electrostatic interaction)이 증가하고 CPP와 CSO 간의 분자 간 결합(intermolecular association)이 증대된다. 이러한 상호작용 증가로 인해 CPP-CSO 나노 복합체의 입자 크기가 증가하였다고 판단된다.
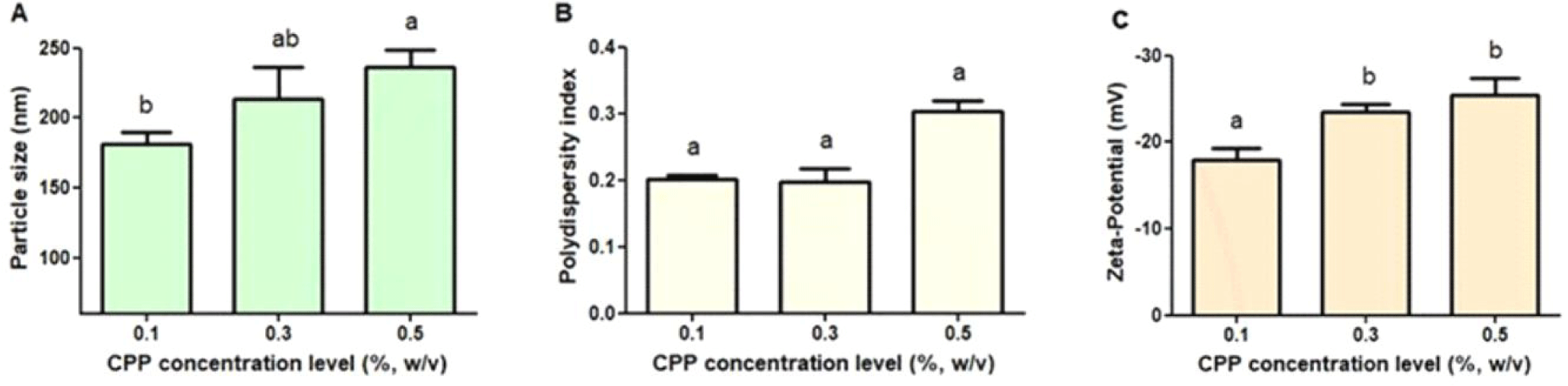
다분산지수(PDI)는 나노 복합체 제조공정 요인인 CPP 농도에 따른 유의적인 차이(p<0.05)를 보이지 않았으며, 모든 조건에서 0.3 이하로 나타났다(Fig. 1B). 이는 입자 크기가 단분산(monodispersed) 형태를 유지하고 있음을 의미하며, 제조된 CPP-CSO 나노 복합체가 균일한(homogeneous) 입자 크기 분포를 지님을 확인할 수 있었다[20,21].
제타 전위(zeta potential)는 CPP 농도의 증가에 따라 점차 감소하는 경향을 나타내었다(Fig. 1C). 이는 음전하를 지닌 CPP 농도 증가로 인해 나노 복합체 표면에 음전하를 띠는 CPP가 많이 존재하게 되어, 전체적인 음전하의 밀도 증가로 인해 제타전위가 감소한 것으로 판단된다.
나노 복합체 제조 시 공정요인인 pH가 CPP-CSO 나노 복합체의 물리화학적 특성에 미치는 영향에 대해 분석하였다(Fig. 2). 그 결과 CPP-CSO 나노 복합체의 입자 크기는 pH가 5.5에서 6.5로 증가함에 따라 유의(p<0.05)하게 감소하였다(Fig. 2A). 앞에서 서술하듯이 CPP의 등전위점이 약 3.1이고, CSO의 pKa가 약 6.3이기 때문에[19], pH가 6.5인 경우와 비교하여 pH가 5.5에서는 CSO가 상대적으로 양전하를 띠게 되고 음전하를 지닌 CPP와 정전기적 상호작용(electrostatic interaction) 증가로 인해 CPP-CSO 나노 복합체의 입자 크기가 증가하였다고 판단된다.
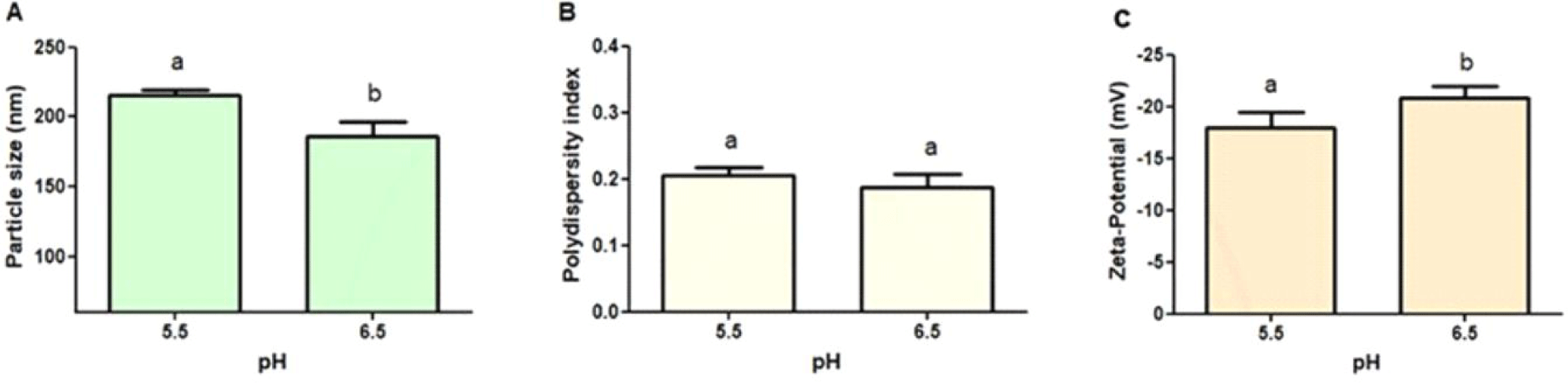
다분산 지수(PDI)는 pH 변화에 따라 유의적인 차이를 나타내지 않았으며 모든 조건에서 0.3 이하로 균일한 입자크기의 분포를 나타냄을 확인할 수 있었다(Fig. 2B). 반면, 제타 전위 결과에서는 pH가 증가함에 따라 유의적(p<0.05)으로 감소하였다(Fig. 2C). 따라서 pH가 증가함에 따라 CPP는 더 많은 음전하를 띠게 되고, 그 결과 CPP-CSO 나노복합체의 표면 전하가 감소하는 것으로 판단된다[22,23].
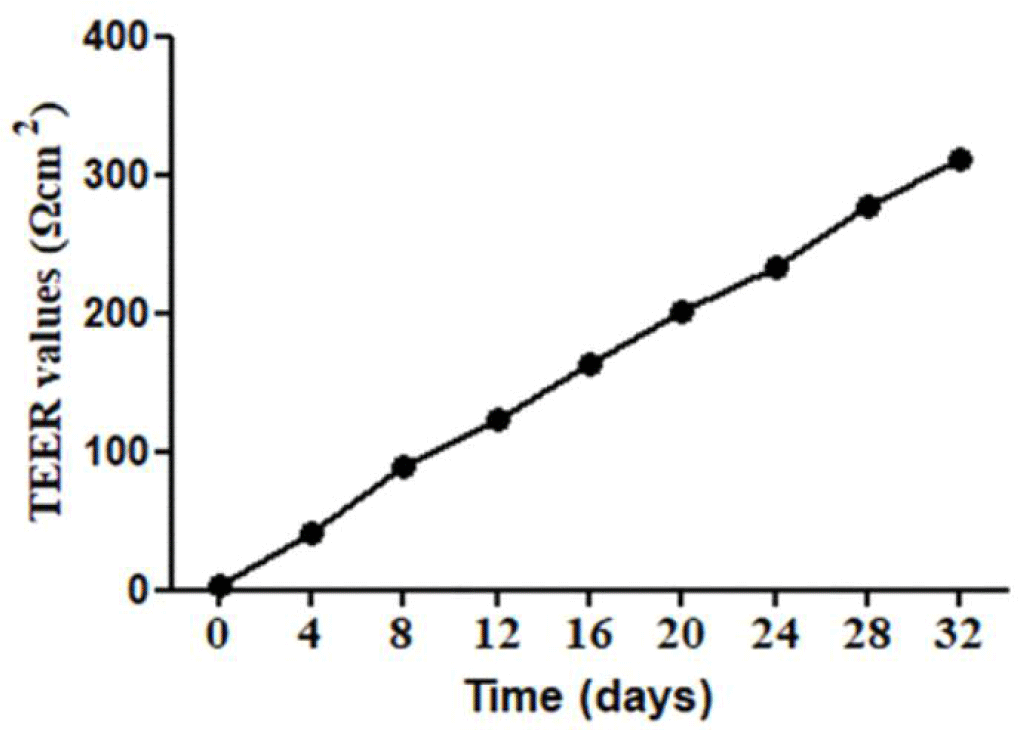
CPP-CSO 나노 복합체의 칼슘 흡수율을 평가하기 위한 Caco-2 모델 구축을 위해 Caco-2 세포주를 transwell에 confluent(융합성) 상태가 될 때까지 배양하였으며, 단층의 형성 유무는 TEER 값 평가를 통해 판단하였다(Fig. 3). 실험 결과 배양 시간이 증가함에 따라 TEER 값이 상승하였으며, 배양 32일째 TEER 값이 332 Ω/cm2 이상으로 측정되어 흡수 실험에 필요한 Caco-2 세포주의 단층이 형성되었음을 확인할 수 있었다[17,24].
나노 복합체는 기존의 미세(micro) 복합체에 비해 크기가 작아(<~200 nm) 장 상피세포와 같은 표적(target) 세포와 상호작용할 수 있는 표면적이 증가하여 생리활성물질의 흡수 효율을 향상시킬 수 있다[25,26]. 그러나 나노 복합체의 입자 크기가 작아질수록 세포막과의 상호작용이 증가하여, 세포막에 일시적인 천공(poration)을 유도하거나 세포 내부로 침투함으로써 세포독성이 발생할 가능성이 있다[27,28]. 따라서 나노 복합체의 세포 독성과 같은 안전성에 대한 연구가 증가하고 있다[29,30].
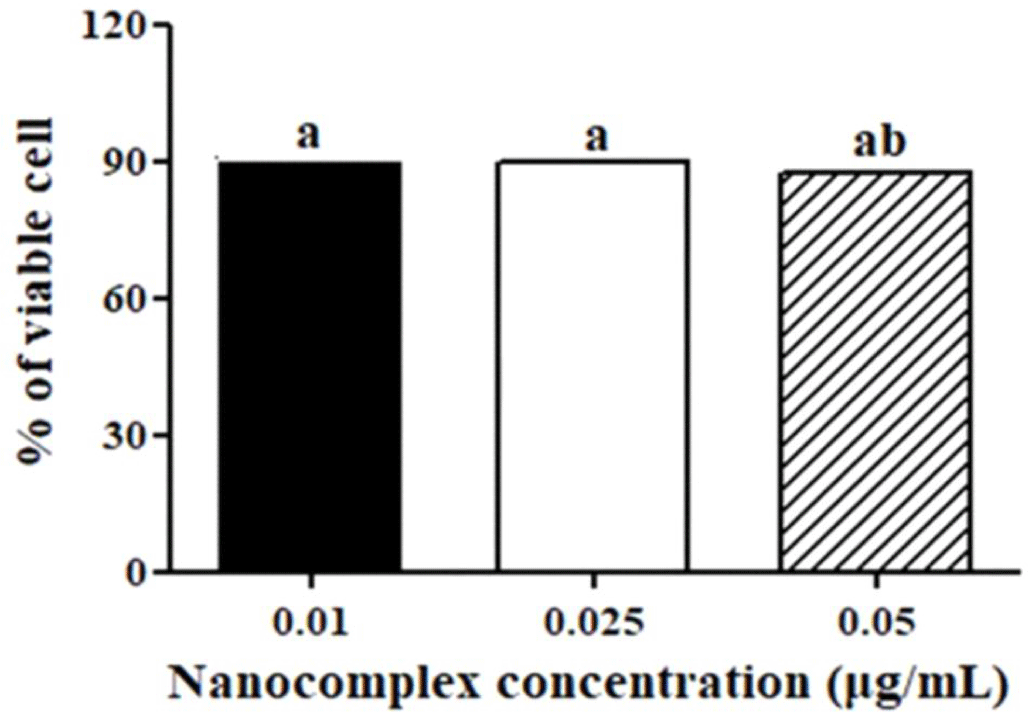
CPP-CSO 나노 복합체의 농도에 따른 세포 독성 측정 결과 나노 복합체 농도가 0.01에서 0.05 μg/mL으로 증가하더라도 세포 생존율에 유의한(p<0.05) 차이가 나타나지 않았으며, 90% 이상의 세포 생존율이 유지되었다(Fig. 4). 식품의약품안전처(식품의약품안전처고시 제2020-12호)에서 제시한 세포독성 판단기준(세포 생존율 70% 이상)에 따르면 CPP-CSO 나노 복합체는 Caco-2 세포주에 대해 세포 독성을 나타내지 않는 것으로 판단되었다[31].
본 연구에서는 소장 상피세포와 유사한 특성을 지닌 Caco-2 세포주를 선택하였고, 이를 이용해 CPP-CSO 나노 복합체의 칼슘 흡수를 평가하였다[32,33]. 그 결과, 나노 복합체의 제조공정 요인인 CPP 농도의 증가에 따라 Caco-2 세포 주 내 칼슘의 흡수는 유의적(p<0.05)으로 저하되었다(Fig. 5A). 이러한 결과는 낮은 CPP 농도에서 제조된 상대적으로 작은 입자 크기를 지닌 CCP-CSO 나노 복합체가 표적 세포인 장 상피세포와의 상호작용 및 체류 시간(retention time)이 증가하였기 때문에, 나노 복합체의 칼슘 흡수가 향상된 것으로 판단된다[8,26,34,35]. 또한 CPP를 사용한 복합체는 Caco-2 세포주 단층에서 칼슘과 같은 미네랄의 흡수를 향상시킨다고 보고되었다[36].
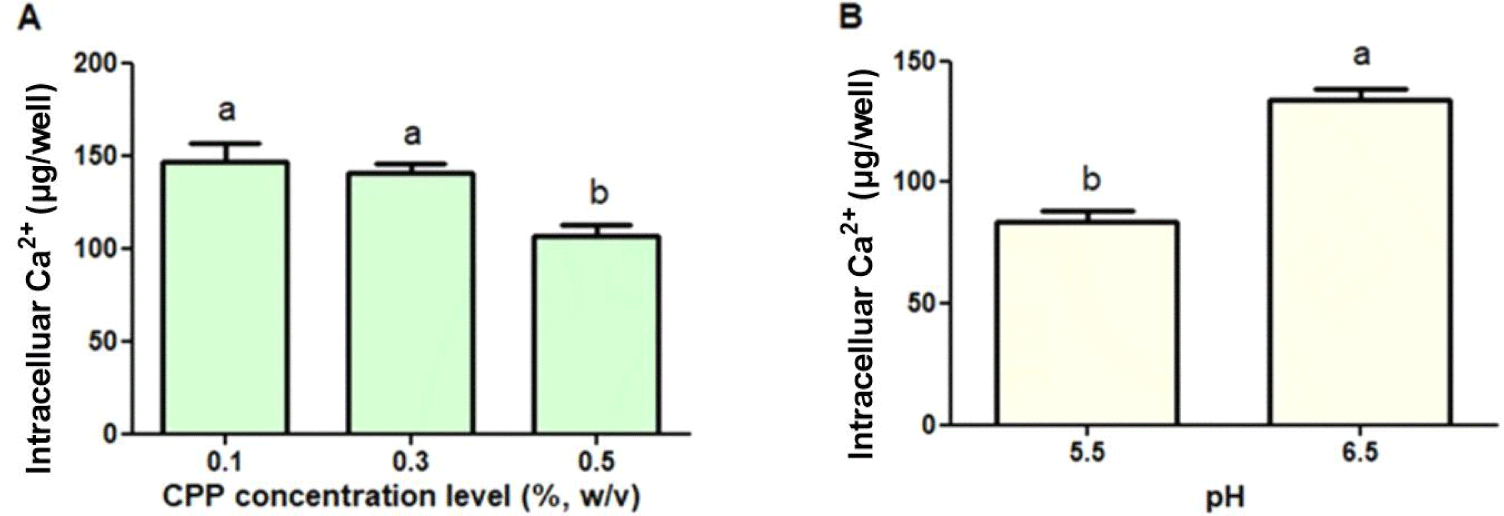
반면 나노 복합체 제조 공정 요인인 pH가 5.5에서 6.5로 증가함에 따라 Caco-2 내 칼슘의 흡수는 유의적(p<0.05)으로 증가하였다(Fig. 5B). 나노 복합체의 물리화학적 특성 실험 결과 pH가 5.5에서 6.5로 증가함에 따라 CPP-CSO 나노 복합체의 입자 크기는 유의(p<0.05)하게 감소하였는데(Fig. 2A), 매우 작은 입자 크기로 인한 부피 당 표면적 증가가 장 상피세포와의 상호 작용을 강화하여, 칼슘 흡수 증가에 기여하였다고 해석되었다[37,38]. 또한 CPP-CSO 나노 복합체의 물리화학적 특성(예를 들면, 입자크기, 다분산 지수, 제타 전위)과 장내 칼슘 흡수 간의 상관 관계를 분석한 결과 CPP-CSO 나노 복합체의 입자 크기와 장 내 칼슘 흡수는 유의한 음의 상관관계(r=–0.69 [p<0.001])를 나타냈다(Table 1). 결국 나노 복합체 입자크기가 작을수록 Caco-2 세포막에서의 나노 복합체의 세포흡수(uptake) 이후 체류 시간이 증가하는 것으로 알려져 있고[39], 입자 크기 감소로 인한 단위 부피당 표면적 증가가 나노 복합체와 Caco-2 세포 간의 상호작용 향상으로 인한 칼슘 흡수 증가에 기여하였다고 판단된다.
| Variables | Particle size | PDI | ZETA | Ca absorption |
|---|---|---|---|---|
| Particle size | 1 | |||
| PDI | 0.84** | 1 | ||
| ZETA | –0.68*** | –0.63 | 1 | |
| Ca Absorption | –0.69*** | –0.41 | 0.09 | 1 |
결론
본 연구에서는 나노 복합체 제조에 이용된 전달 소재(delivery material)로 CPP와 CSO을 결합하여 나노미터 크기의 균일한 분포를 지닌 CPP-CSO 나노 복합체를 성공적으로 제조하였다. 제조된 CPP-CSO 나노 복합체는 다양한 CPP 농도와 pH 조건에 따라 입자 크기, 다분산 지수, 표면 전하 같은 물리화학적 특성이 조절되었음을 확인하였다. 또한 CPP-CSO 나노 복합체를 Caco-2 세포주에 적용하였을 때 90% 이상의 세포 생존율로 세포 독성을 나타내지 않았다. CPP-CSO 나노 복합체의 물리화학적 특성과 칼슘 흡수 간에 상관관계 분석에서 입자크기와 칼슘 흡수 간의 유의한 음의 상관관계가 확인되어 입자 크기가 Caco-2 세포주 단층에서의 칼슘흡수에 영향을 미치는 요인임을 알 수 있었다. 본 연구에서 개발된 CPP-CSO 나노 복합체는 장내 칼슘 흡수를 증진시켜 생체 이용률을 향상시킬 수 있는 새로운 유단백질 기반 식품 소재로 활용이 가능하며, 분말화 공정을 통한 CPP-CSO 나노 복합체는 다양한 유제품(우유, 발효유 등)에 적용되어 새로운 노인용 칼슘 강화 기능성 유식품 개발에 기여할 것으로 기대된다.
