서 론
Allium 속 식물은 전 세계적으로 재배되고 있으며 약 500여 종이 알려져 있다[1]. Allium 속은 특유의 풍미가 있으며 구근과 잎을 모두 먹을 수 있는 특징을 가지고 있다[2]. Allium 속의 식물은 다양한 생물학적 활동이 부여된 2차 대사 산물의 풍부한 공급원으로 인식되어 왔다[3,4]. Allium 속 식물의 생리활성 작용으로는 항균작용[5], 항산화작용[6], 지질대사효과[7], 발암물질 활성감소[8], 항응집 혈소판활성[9], 항진균[10] 효과 등이 보고되어 있다.
Allium 속으로는 파(Allium fistulosum), 양파(Allium cepa), 마늘(Allium sativum), 달래(Allium monanthum), 그리고 부추(Allium tuberosum) 등이 있다[11,12]. Allium 속 중 쪽파(Allium wakegi)는 작은 정향과 구근이 모여 한해살이 풀로 재배되는 다년생 작물이며, 풍부한 향과 식욕을 돋우는 맛을 가지고 있다[13]. 국내에서 A. wakegi는 구성성분이 단백질, 당질, 아미노산, 미네랄, 비타민 등이 풍부하고, 이외에 플라보노이드, 사포닌, 효소 그리고 옥신 등이 포함되어 있기 때문에 식품학적 가치가 우수한 조미채소로 널리 알려져 있다[12–14]. Lee et al.[12]은 쪽파에 있어서 아미노산의 구성은 18종 중 17종이 분석되었으며, 이 중에서 glutamic acid의 함량이 가장 많았고, 뒤를 이어 aspartic acid, leucine, lysine, alanine 등의 순으로 함유되었다고 보고하였다. 또한 쪽파의 무기질의 함량은 K, Ca, P, mg, Na 등이 함유되어 있다고 하였다[12]. Kang et al.[11]은 쪽파의 에탄올 추출물이 과당 고혈압 백서의 신장 기능에 미치는 영향을 관찰한 결과, 과당-유도고혈압 백서의 사구체 여과율을 개선시킨다고 하였다.
유산균(lactic acid bacteria)은 그람 양성, 비포자 형성, 구균 또는 간상균, 카탈라아제 음성 및 까다로운 유기체로, 낮은 pH에 대한 내성이 높다[15–17]. 유산균은 식품의 발효뿐만 아니라 맛과 질감을 향상시키는 데 사용되는 가장 중요한 미생물 중 하나이다[15,18]. 그 중 식물 유산균은 야채나 과일, 콩, 쌀, 보리 등 식물소재에서 유래된 유산균을 말하며, 내산성이 강하다고 알려져 있다[19]. 다양한 과일과 채소에서, 유산균은 복잡한 구조로 되어 있어 쉽게 분해되지 않는 펙틴 성분을 대사 할 수 있으며, 과일 기반 식품에 흔히 있는 항영양소인 탄닌과 페놀 화합물도 분해하여 원료 식품의 영양가를 높일 수 있다[20]. 일부 유산균은 박테리오신으로 알려진 항균 펩타이드를 생성한다. 현재까지 Lactobacillus 속의 여러 유산균 분리주와 박테리오신이 식품 보존 및 인간 병원체 제어에 적용되었다[21]. 포도당과 박테리오신, 과산화수소, 디아실 등과 같은 성장 억제 물질로부터 주산물인 유산이 생성되어 식품 부패 박테리아 및 병원균의 증식을 방지하는 것이 특징이다[16,22]. 다양한 유산균이 발견되고 있는 가운데 항균 활성을 가진 새로운 유산균 균주를 특성화 및 식별하고, 프로바이오틱스로 활용할 수 있는 식물유래 유산균의 연구가 필요하다. 식물 유래 및 관련 종을 연구하여 이로운 기능을 가진 유산균 균주를 찾는 것은 유제품 산업 및 새로운 프로바이오틱스 가능성을 확장할 수 있다. 쪽파는 다른 Allium 속인 양파와 마늘에 비하여 연구가 미흡한 편이며 아직까지 쪽파로부터 유산균 분리 연구는 없다. 따라서 본 연구에서는 처음으로 쪽파로부터 유산균을 분리하였고, 유산균 배양액을 분리 회수하였다. 그리고 얻어진 배양액은 병원성균에 대한 항균활성을 측정하였다.
재료 및 방법
본 실험에서 사용된 30% acrylamide, Coomassie Brilliant Blue(CBB) R-250, 그리고 Urea는 TNT Research(Korea) 것을 사용하였고, Tris, Sodium dodecyl sulfate(SDS), Ammonium persulfate, Tetramethylethylenediamine(TEMED), Glycine, 그리고 Sodium chloride(NaCl)은 Amresco(USA) 것을 사용하였다. 2-Mercaptoethanol, Bromophenol Blue(BPB)는 Sigma-Aldrich(USA) 것이며, Glycerol, Acetic acid, 그리고 Methanol은 Daejung Chemicals & Metals(Korea) 것을 사용하였다. 1-Butanol은 (주)서울화성공업(Korea) 것을 사용하였다.
쪽파(A. wakegi)는 안성시 소재 농협하나로마트에서 신선한 것을 구입하였다. 쪽파로부터 유산균의 분리는 37℃ 부배양기에서 21일간 발효시켜 유산균을 분리하였다. 유산균의 분리는 0.01% Sodium azide(Sigma-Aldrich)을 첨가한 De Man Rogosa-Sharpe(Difco, USA) agar를 이용하였다. 콜로니 형성 후, 각각의 배양된 MRS agar에서 모양, 크기 및 색이 다른 콜로니를 선택하였다. 선택된 미생물은 수탁업체(Solgent, Korea)에 의뢰하여 동정하였다. 그리고 균주의 결정은 데이터베이스에 등록된 표준균주와 비교하여 가장 높은 상동성을 나타내는 것으로부터 결정하였다. 분리된 유산균은 –80℃에서 보관하면서 실험에 이용하였다. 병원성균인 Escherichia coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli KCCM 11600는 한국미생물보존센터에서 구입하였다. 또한 병원성균인 Salmonella Enteritidis NCCP 16947, Salmonella Thompson NCCP 11704, Salmonella Typhimurium NCCP 16960은 국가병원체 자원은행에서 구입하여 실험에 이용하였다. 유산균의 배양 배지는 MRS broth를 이용하여 37℃의 배양기에서 배양하였고, Escherichia와 Salmonella는 Luria-Bertani(LB) broth(Difco)를 이용하여 37℃의 배양기에서 배양하였다.
쪽파로부터 분리된 유산균을 MRS broth에 접종하여 37℃의 배양기에서 24시간 배양하였다. 유산균 배양액의 회수는 원심분리기를 이용하여 분리하였다. 즉 원심분리는 4℃, 4,000 rpm, 20 min의 조건으로 수행하였다. 얻어진 상징액의 pH를 측정한 후, Syringe filter(0.45 μm와 0.22 μm, Advantec, Japan)를 이용하여 멸균하였고, –20℃에 보관하면서 실험에 이용하였다.
쪽파 유래 유산균 배양액에 대하여 SDS-PAGE를 실행하였다. 분리 gel은 12% 농도로 수행하였다. 사용한 분자량마커(molecular weight markers)는 precision plus protein standards-dual xtra(Bio-Rad, USA). 전기영동이 끝난 gel은 CBB 염색(0.25% Coomassie Brilliant Blue R-250, 5% methanol, 7.5% acetic acid)과 은염색을 수행하였다. CBB 염색은 2시간 염색시키고, 탈색액(25% methanol, 7.5% acetic acid, 67.5% Milli Q water)으로 gel 배경의 색이 완전히 없어질 때까지 2시간 정도 탈색시켰다. 한편 은염색은 silver staining kit(GE Healthcare, USA)의 protocol에 따라서 수행하였다.
쪽파 유래 유산균으로부터 얻어진 상징액의 병원성균에 대한 항균활성은 Paper disc를 이용하여 확인하였다. 병원성균으로는 E. coli KCCM 11587, E. coli KCC M 11591, E. coli KCCM 11596, E. coli KCCM 11600, S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960를 이용하였다. 각각의 준비된 20 mL의 LB agar에 병원성균을 1%씩 접종하였다. 굳어진 각각의 병원성균에 쪽파로부터 얻어진 상징액을 40, 20, 10, 그리고 5 μL의 농도로 조정하여 멸균된 paper disc(Advantec, Japan)에 흡수시켜 37℃에 배양하면서 항균활성 환을 측정하였다.
쪽파유래 유산균 배양 상징액의 병원성균에 대한 농도별 항균활성은 96 well plate 법을 이용하여 측정하였다. 준비된 상징액은 20%, 10%, 5%, 2.5%의 농도로 첨가하였다. 각각의 병원성균은 예비 배양 후, 1%를 접종하였다. 병원성균의 성장은 37℃ 배양기에서 배양하면서 3시간 간격으로 microplate reader(Bio-Rad)를 이용하여 655 nm의 파장으로 흡광도(optical density)를 측정하였다.
쪽파유래 유산균으로부터 얻어진 배양 상징액의 pH와 열에 대한 안정성을 측정하였다. 첫째, pH변화에 대한 안정성 여부는 1N NaOH를 이용하여 배양 상징액에 pH를 조정하여 병원성 균주에 대한 항균활성을 측정하였다. 시험은 조정된 배양 상징액의 5% 첨가에 의해서 진행하였다. 둘째, 열안정성 시험은 배양 상징액을 65℃에서 30 min, 75℃에서 15 min, 85℃에서 10 min, 100℃에서 5 min의 조건으로 열처리한 후, 병원성 균주에 대한 항균활성을 측정하였다. 그리고 시험은 각각의 처리된 배양 상징액의 5% 첨가에 의해서 수행하였다. 각각의 병원성균의 성장은 37℃에서 24시간 동안 배양하면서 6시간 간격으로 흡광도를 측정하여 확인하였다.
결과 및 고찰
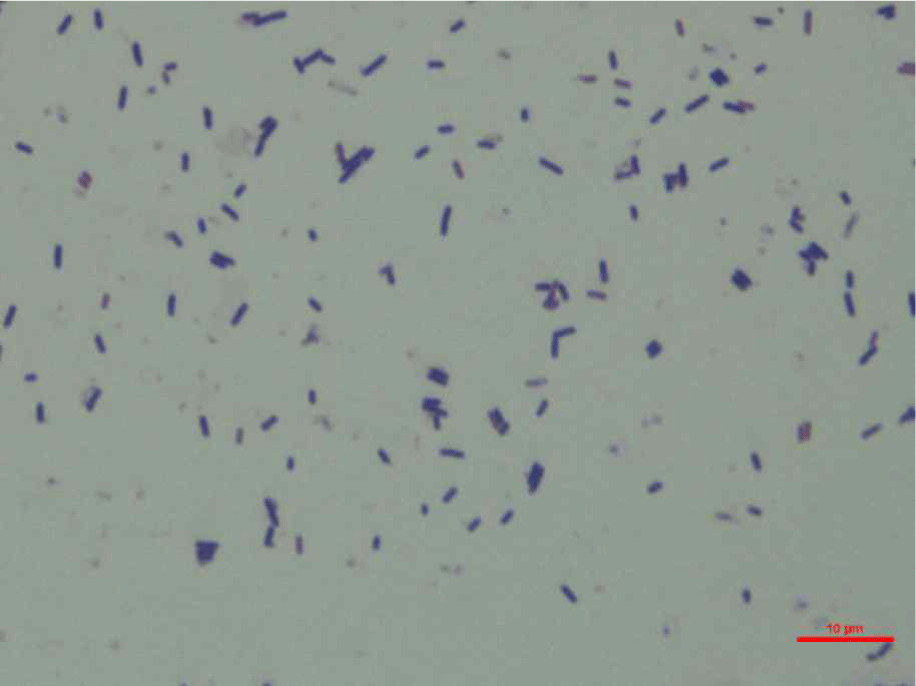
저장 쪽파(A. wakegi)를 분쇄기에 분쇄한 후, 얻어진 분쇄물로부터 백금이를 이용하여 MRS agar에 접종(streaking)하여 콜로니가 형성될 때까지 호기와 혐기 상태에서 배양하였다. 얻어진 콜로니로부터 그람염색법에 의한 콜로니의 형태를 확인한 결과, 간균의 그람 양성균을 확인하였다(Fig. 1). 따라서 형태학적으로 Lactobacillus 속으로 분류되는 것을 보여주었고, 유산균 동정결과 Lactiplantibacillus plantarum strain과 높은 상동성을 나타내었다. 한편, 얻어진 콜로니는 혐기와 호기 상태에서 모두 성장하는 것으로 확인되었다. 얻어진 콜로니는 10 mL MRS broth에 24시간 1차 배양하고, 1차 배양액으로부터 50 mL MRS broth에 1% 접종하여 24시간 2차 배양하였다. 배양 종료 후, 배양액은 원심분리기를 통하여 회수하였다. 이때 배양액의 pH는 3.71을 나타내었다. 한편, 쪽파유래 유산균 배양액의 분비 패턴을 알아보기 위하여 SDS-PAGE를 수행하였다. 전기영동이 끝난 gel의 은염색 결과는 Fig. 2에 나타내었다. 다양한 물질을 분비하는 것이 밴드를 통해서 확인되었다(Fig. 2).

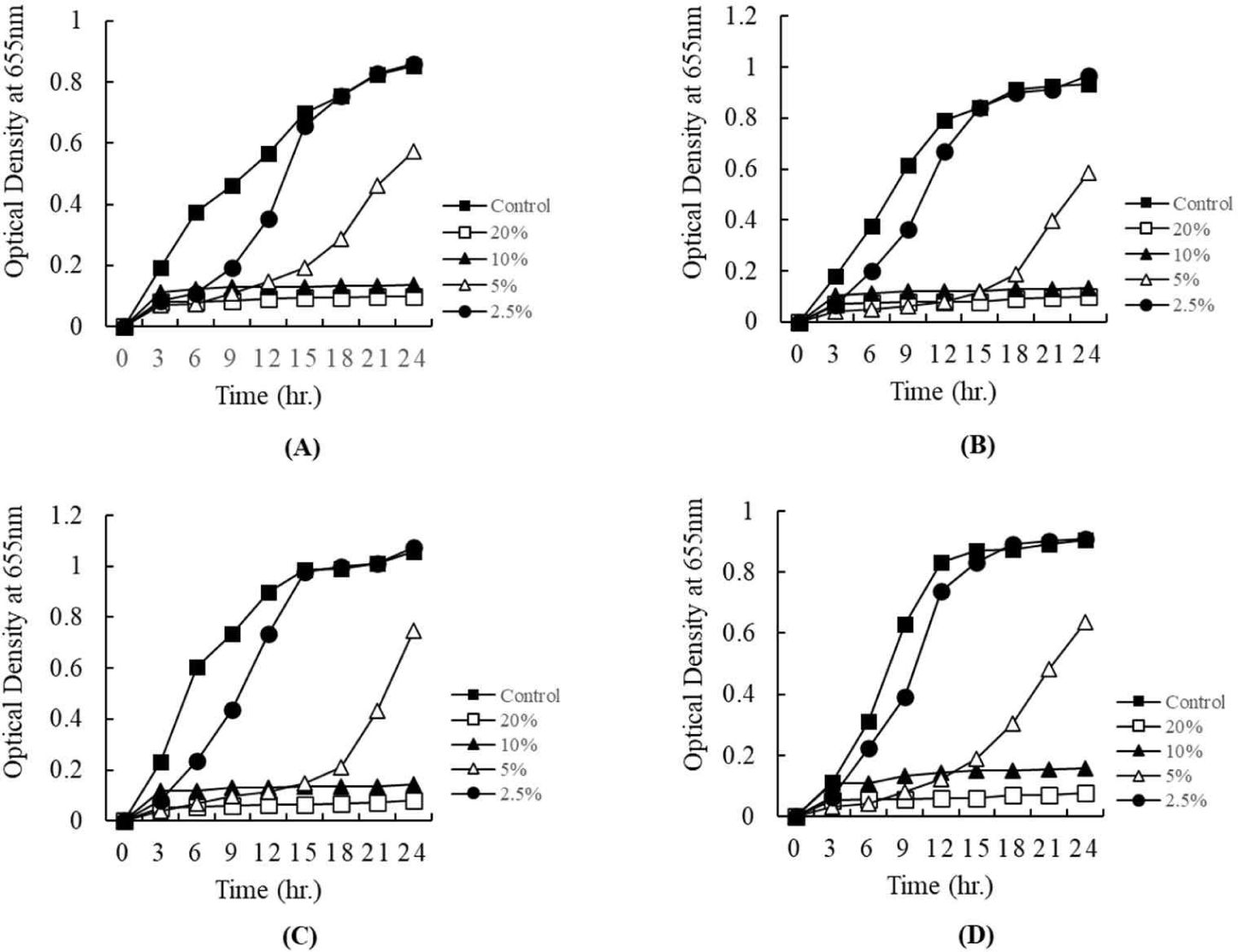
쪽파유래 유산균으로부터 얻어진 상징액의 농도를 조절하여 병원성균에 대한 항균활성 환을 측정한 결과는 Figs. 3 and 4에 나타내었다. Fig. 3은 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli 11600에 대하여 쪽파유래 유산균의 배양상징액에 대한 항균 환을 측정한 결과이다. 상징액의 농도가 높을수록 항균활성이 높은 것을 항균 환을 통하여 보여주었다(Fig. 3A). Fig. 4는 S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960에 대한 항균활성 환 측정 결과이다. 유산균으로부터 얻어진 상징액은 Salmonella ssp.에 대하여 항균활성을 나타내었다. Escherichia spp.와 같이 상징액의 농도가 높을수록 항균활성의 증가를 보여주었다(Fig. 4A). 따라서 쪽파유래 유산균으로부터 얻어진 상징액은 병원성균의 성장을 억제하는 효과가 있는 것으로 확인되었다.


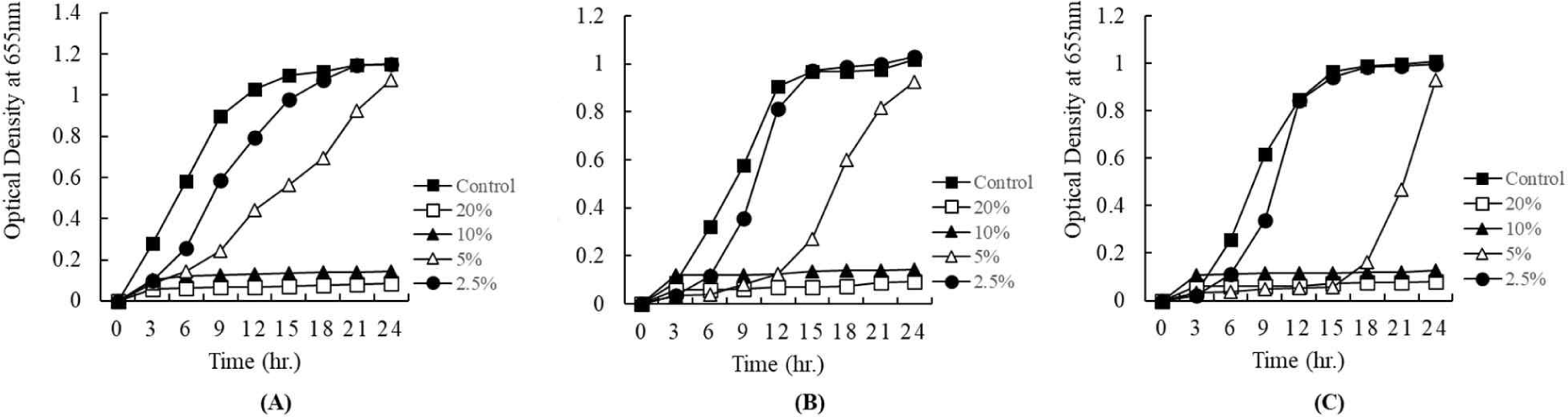
쪽파유래 유산균으로부터 얻어진 상징액이 병원성균에 대한 항균활성 여부는 paper disc법에 의해 확인되었다. 상징액의 항균활성 농도를 측정하기 위하여 96 well plate법으로 분석을 진행하였다. Figs. 5 and 6은 얻어진 상징액을 20%, 10%, 5%, 2.5% 농도로 첨가한 후, 24시간 동안 병원성균에 대한 항균활성을 측정한 결과이다. Fig. 5는 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli 11600에 대하여 쪽파유래 유산균의 배양상징액에 대한 항균활성을 측정한 결과이다. 상징액의 농도가 높을수록 항균활성이 높은 것을 보여주었다(Fig. 5). 특히 시험에 이용된 4종의 대장균은 모두 20%와 10%의 농도는 배양초기부터 배양 24시간까지 현저한 항균활성을 보여주었다. 5%의 농도에서는 배양 15시간까지 항균효과를 나타내다가 이후 서서히 성장하는 것을 보여주었다(Fig. 5). 그리고 2.5%의 농도에서는 배양 상징액을 첨가하지 않은 대조구에 비해 배양초기 12시간까지 억제효과를 나타내다가 이후 대조구와 비슷한 성장을 보여주었다(Fig. 5). 한편, Fig. 6은 S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960에 대한 쪽파유래 유산균의 배양 상징액의 항균활성을 나타내었다. 유산균으로부터 얻어진 상징액은 본 시험에 이용된 3종의 Salmonella에 대하여 현저한 항균활성을 보여주었다(Fig. 6). Escherichia와 같이 20%와 10%의 농도에서는 배양 초기부터 24시간까지 현저한 항균활성을 보여주었고, 5%의 농도에서는 배양 15시간까지 항균효과를 나타내다가 이후 서서히 성장하는 것을 보여주었다(Fig. 6). 이와 같은 결과는 2.5%의 농도에서도 같은 경향을 보여주었다.
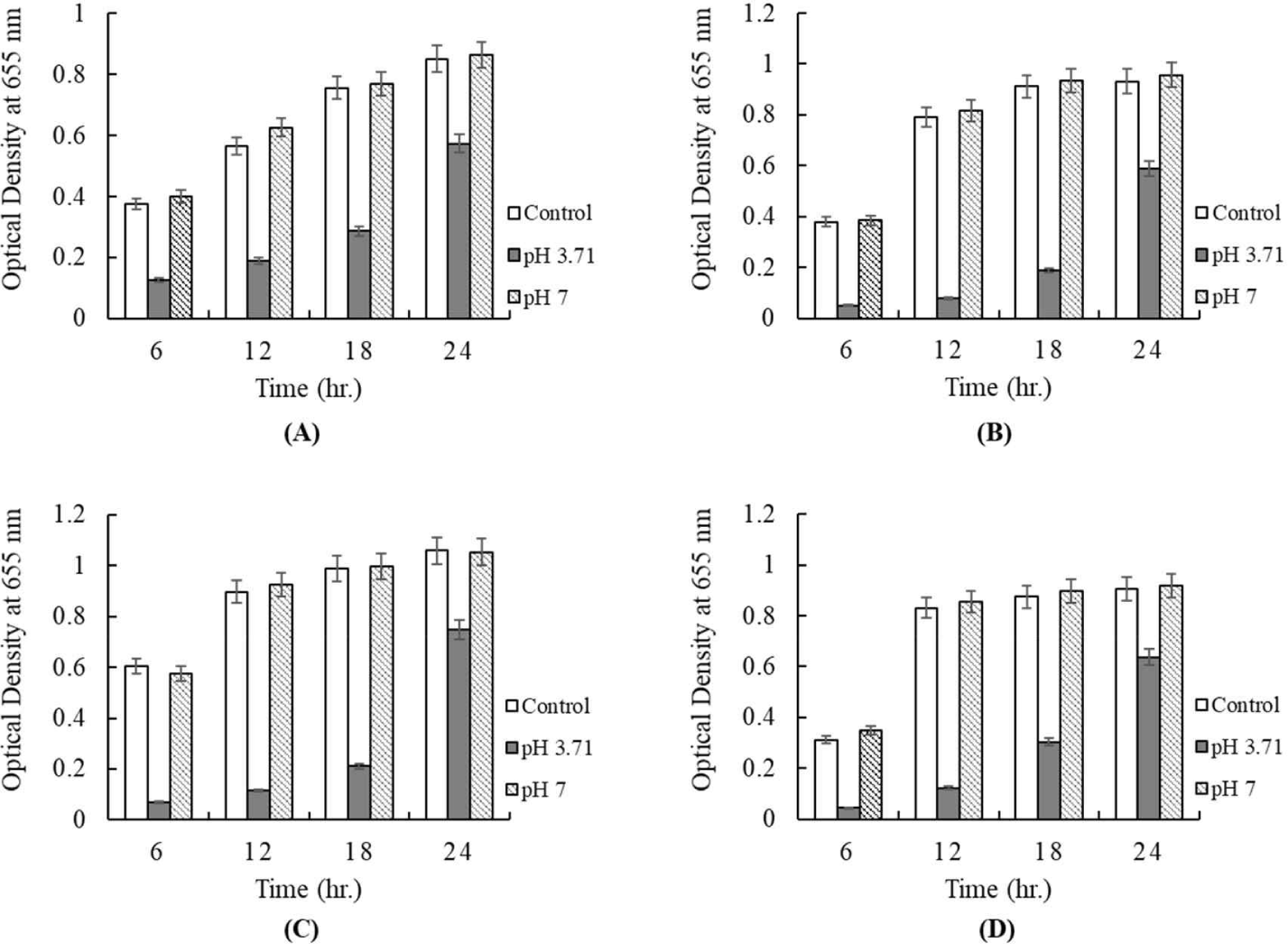
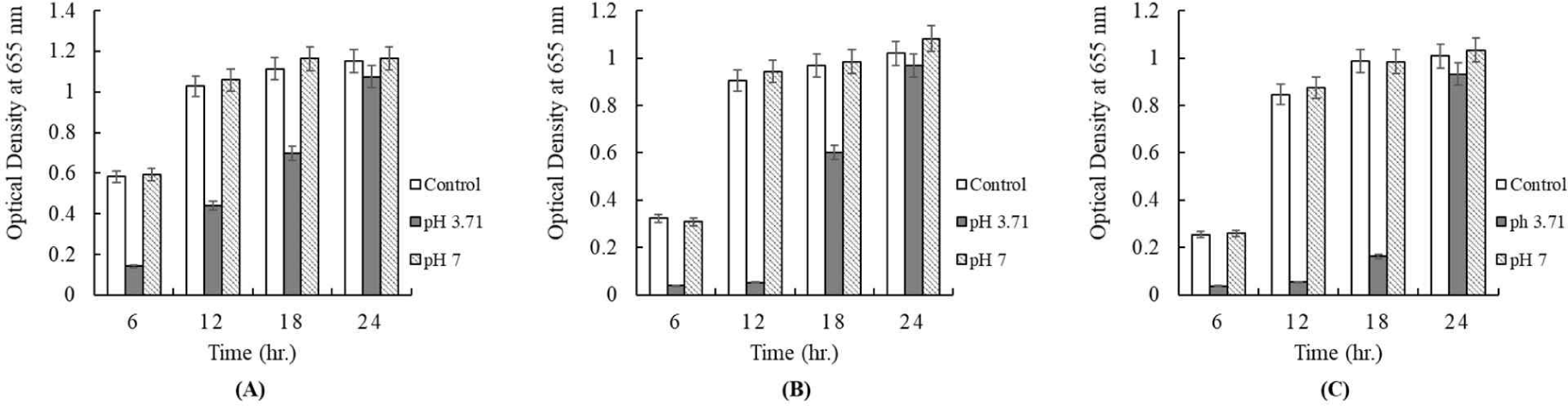
유산균이 생성한 organic acids, hydrogen peroxide, bacteriocin을 통해 항균활성을 나타낼 수 있다고 하였다[23]. 본 시험에 이용된 배양 상징액의 항균활성이 유기산에 의한 것인지, bacteriocin에 의한 것인지 알아보기 위해 유산균 배양액을 1N NaOH를 사용하여 pH 7.0으로 조정하고, 배지에 5%를 첨가하여 병원성균에 대한 항균활성을 확인하였다. 쪽파로부터 분리된 유산균의 배양 상징액의 pH는 3.71로 측정되었다. Fig. 7은 배양 상징액을 pH 7.0으로 조정하여 첨가 후, 96 well plate 법을 이용하여 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli KCCM 11600의 24시간 동안 성장을 측정한 결과이다. 모든 시험구에서 배양 상징액의 pH를 7.0으로 조정하였을 때, 항균활성은 나타나지 않았으며, 아무것도 첨가하지 않은 대조구와 같은 성장을 보여주었다(Fig. 7). 한편 pH를 조정하지 않은 시험구는 항균활성을 나타내 것으로 보아 배양 상징액의 대장균에 대한 항균 활성은 유기산으로 의한 효과라고 판단된다. Fig. 8은 배양 상징액을 pH 7.0으로 조정하여 첨가 후, S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960의 성장을 나타낸 결과이다. Escherichia와 같이 모든 시험구에서 배양 상징액의 pH를 7.0으로 조정하였을 때, 항균활성은 나타나지 않았으며, 아무것도 첨가하지 않은 대조구와 같은 성장을 보여주었다(Fig. 8).
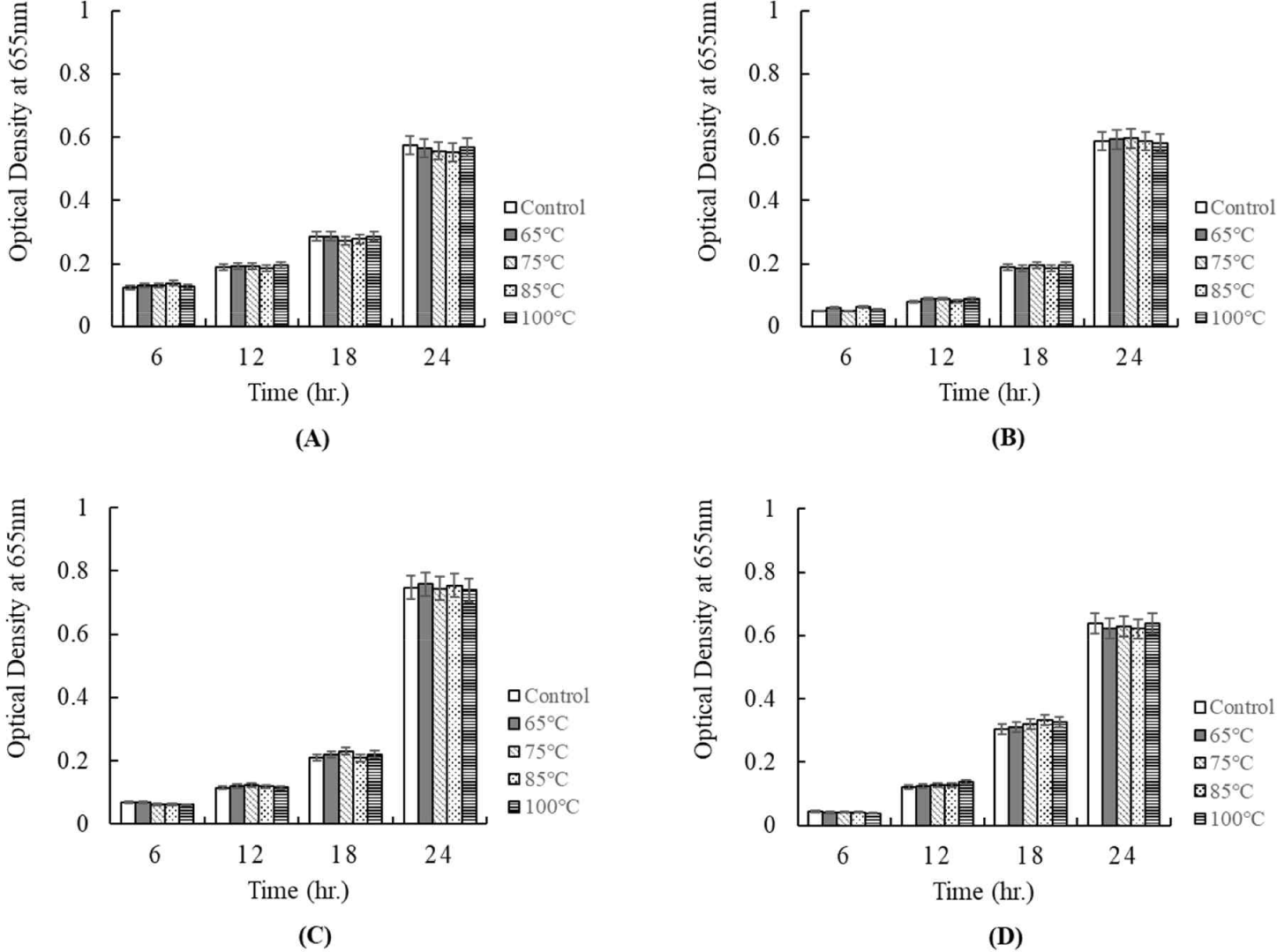
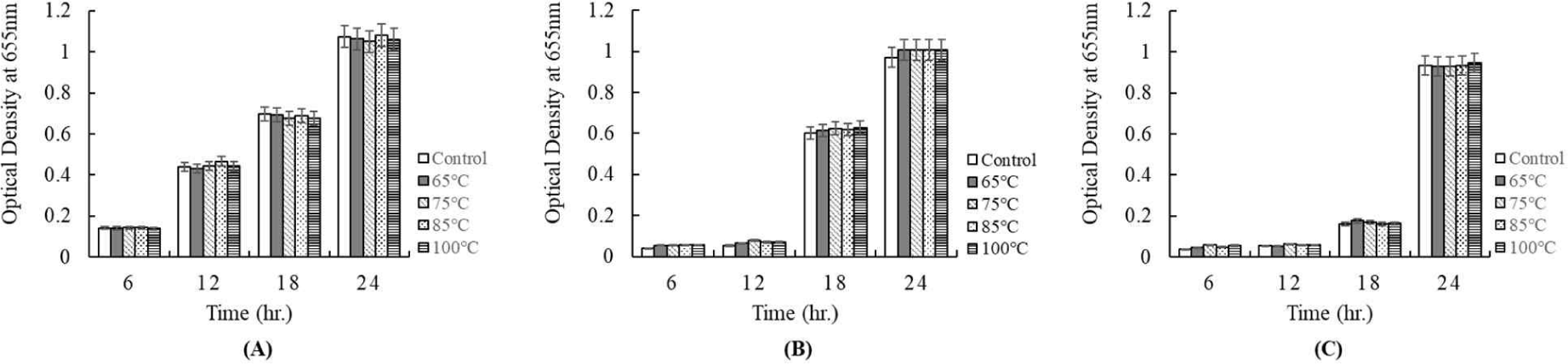
한편, 배양 상징액의 항균활성이 열에 대하여 안정성을 가지는지를 측정하였다. 65℃에서 30 min, 75℃에서 15 min, 85℃에서 10 min, 100℃에서 5 min의 조건으로 열처리하여 병원성균에 항균활성을 확인한 결과는 Figs. 9 and 10에 보여주었다. Fig. 9는 배양 상징액을 각각의 온도에서 열처리한 후, E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli KCCM 11600에 첨가하여 배양 24시간 동안 성장을 조사한 결과이다. 시험에 이용된 각각의 Escherichia는 모든 온도 처리구에서 온도 처리하지 않은 대조구와 같은 항균활성을 보여주었다(Fig. 9). 그리고 Fig. 10은 배양 상징액을 각각의 온도로 처리하여 첨가 후, S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960의 성장을 나타낸 결과이다. Escherichia와 같이 모든 온도 처리구에서 온도 처리하지 않은 대조구와 같은 항균활성을 보여주었다(Fig. 10). 따라서 배양 상징액은 열에 대해서 안정한 것이 확인되었다.
본 연구에서는 처음으로 쪽파(A. wakegi)로부터 유산균을 분리하였으며 병원성균에 대한 항균활성을 측정하였다. 쪽파유래 유산균의 배양액은 병원성균인 Escherichia와 Salmonella에 대하여 현저한 항균활성을 보여주었다. pH를 조정하였을 때 병원성균에 대한 항균활성은 나타나지 않았으나, 열처리는 열처리하지 않은 대조구와 유사한 항균활성을 나타내었다. 이는 Lactobacillus bulgaricus SP5의 항균활성 연구에서도 유사한 결과를 보였다[24]. 또한 Im et al.[25]은 Weissella koreensis와 Lactobacillus sakei의 배양 상징액이 E. coli KCCM 11234, S. Enteritidis KCCM 3313, S. Enteritidis KCCM 12021, S. Typhimurium KCCM 40253, 그리고 S. Typhimurium KCCM 15에 대하여 항균효과를 나타낸다고 보고하였다. 이들은 유산균의 배양 상징액의 병원성균에 대한 항균활성은 박테리오신 같은 단백질보다는 다양한 유기산의 작용에 의한 것이라고 하였다. 유산균의 병원성균에 대한 항균활성은 유산 및 유기산, 짧은 고리 지방산, hydrogen peroxide, bacteriocin 등을 생산함으로써 항미생물작용을 나타낸다고 하였다[26]. 따라서 본 연구에서도 병원성균에 대한 항균작용이 유기산에 의한 것인지 박테리오신의 작용인지 보다 더 연구할 필요성이 있다. 더욱이 식물유래 유산균은 야채나 과일, 콩, 쌀이나 보리 등 식물소재에서 유래된 유산균을 말하며, 기존의 동물 유산균과 비교시 내산성이 강해 살아서 장까지 간다고 알려져 있다[19]. 이는 쪽파유래 유산균의 동정과 프로바이오틱스로서의 활용, 유제품 적용과 같은 추가적인 연구를 수행할 필요성이 있다.
요 약
본 연구는 쪽파(A. wakegi)로부터 유산균을 분리하였고, 이 균으로부터 얻어진 배양 상징액이 병원성균에 대하여 항균활성을 나타내는지 조사하였다. 먼저 분리된 유산균으로부터 얻어진 배양 상징액에 대해서 병원성균인 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, E. coli KCCM 11600, S. Enteritidis NCCP 16947, S. Thompson NCCP 11704, 그리고 S. Typhimurium NCCP 16960의 항균활성을 측정하였다. 그 결과 얻어진 유산균 배양액은 병원성균에 대하여 현저한 항균활성을 보여주었다. 항균활성은 배양 상징액 첨가량이 증가함에 따라 현저한 효과를 나타내었다. 또한 병원성균에 대한 항균활성에 대하여 얻어진 배양 상징액의 pH 변화와 열의 변성에 의하여 같은 항균효과를 나타내는지를 조사하였다. 즉, 배양 상징액을 pH 7로 조정하여 병원성균에 대한 항균활성을 측정한 결과, 억제효과는 나타나지 않았다. 따라서 얻어진 배양 상징액의 병원성균에 대한 항균활성은 유기산에 의하여 영향을 받은 것으로 판단된다. 한편, 배양 상징액의 열에 대한 안정성을 측정한 결과는 열처리를 하지 않은 대조구와 같은 항균활성을 나타내었다. 따라서 얻어진 유산균 배양액은 열에 대하여 안정한 것으로 나타내었다.
