서 론
국내 연간 1인당 자연치즈 소비량은 2015년 2.1 kg에서 2021년 2.6 kg으로 증가하는 추세이다[1]. 자연치즈는 우유에 효소를 넣어 응고 및 숙성한 발효 식품이며, 특히 자연숙성치즈는 제조한 후 제품의 풍미를 증진하기 위해 저온에서 숙성시킨 치즈이다. 숙성치즈는 신선치즈를 제조한 후 수일에서 수년간 숙성 및 저장을 통해 제품의 가치를 향상시킨다[2]. 최근 자연숙성치즈의 미생물 균총에 대한 연구가 광범위하게 진행되고 있으며, 식품 중 부패를 유발하는 세균이나 질병을 유발하는 식중독균과 더불어 진균류인 곰팡이 등 다양한 균이 서로 연관성을 가지고 상호작용을 하는 것으로 보고되고 있다[3].
이 중 일부 곰팡이는 특정 품목의 치즈에 첨가되어 숙성 중 풍미를 제공하는 것으로 알려졌으나, 또 다른 오염 곰팡이는 자연치즈 등과 같이 장기간 숙성을 요하는 제품에서 독소를 생성을 통해 부패를 일으키기도 한다[4]. 자연치즈의 저온 숙성 과정 중 가장 빈번하게 발생하는 곰팡이는 Aspergillusspp.와 Penicilliumspp., Cladosporiumspp. 등으로 이들이 거의 90%를 차지하고 있는 것으로 알려져 있다[5]. 이 중 Penicillium commune은 치즈 등의 유제품에서 오염을 일으키는 대표적인 곰팡이이며[6,7], Aspergillus niger는 요거트 등에서 부패를 일으키기도 한다[8]. Cladosporium cladosporioides는 환경에 널리 존재하는 곰팡이종으로 공기 중에 오염되어 식품의 오염을 야기할 수 있고[9], 건조한 생선류의 주요 부패 곰팡이이기도 하다[10]. 이러한 곰팡이들은 aflatoxin과 patulin, mycophenolic acid, ochratoxin A, citrinin 등의 독소를 생성하는 것으로 알려져 있다[11]. 곰팡이 독소로 인한 급성 독성작용으로는 간 및 신장의 손상과 중추신경계 이상, 구토와 설사 등이 있으며, 장기적으로 노출되었을 경우에는 만성질환과 암, 돌연변이, 태아 기형 등을 유발할 수 있다[12].
이에 본 연구에서는 다양한 식중독균에 대해 항균활성을 보유하고 있고 항균표면(biofilm) 생성이 가능한 유산균인 Pediococcus pentosaseus를 치즈 숙성 과정 중 오염 곰팡이 제어에도 활용 가능한지 확인하기 위해 항곰팡이능과 환경 저항성 등 균주의 특성을 분석하고, 실제 치즈에 적용해 보고자 한다.
재료 및 방법
미생물 분석은 식품공전[13]에서 제시하는 방법에 따라 3반복으로 수행하였다. 치즈 숙성실 표면과 치즈 자체 표면의 오염도를 검사하기 위하여 Swab kit(3M Pipette swab Plus, 3M, Saint Paul, MN, USA)를 사용하여 각 시료 표면의 10 cm×10 cm 면적 범위를 채취하였으며, 채취한 시료는 일반세균과 곰팡이에 대한 분석을 수행하였다. 시료 각 1 mL를 취하여 0.85%의 멸균 Sodium Chloride Water 9 mL와 섞어 10배 단계씩 희석하였다. 그 후 각 단계별 희석액 1 mL를 취하여 표준한천평판배지(Plate Count Agar, MB-P1040, Kisanbio, Seoul, Korea)와 PDA 배지(Potato Dextrose Agar, MB-P1102, Kisanbio)에 도말 한 후 35℃로 설정한 항온기(incubator)에서 48±2시간 배양하였다. 이후 15–300개의 집락을 생성한 평판의 집락수를 계수하였다.
발효식품(김치, 젓갈, 장아찌, 장류)에서 분리한 유산균 245균주 중 식중독균(5종)에 대한 항균활성이 뛰어나고 항균표면 형성이 가능한 특성이 있는 P. pentosaseus M132-2를 선발하였다[14]. M132-2 균주는 된장에서 분리하였고, 항균활성 분석 대상 식중독균은 Escherichia coliO157:H7, Salmonella enterica, Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus였다[14]. 이후 분석을 위해서 MRS 액체배지(BD Difco, Fraklin Lakes, NJ, USA)에 접종한 후 37℃, 24시간 배양하여 사용하였다.
항곰팡이능 분석을 위해서 Aspergillus niger, Cladosporium cladosporioides, Penicillium commune를 대상으로 실험을 진행하였다. PDA 배지에서 25℃, 72시간 배양한 곰팡이의 포자를 긁어 0.75% PDA 연한천배지에 넣어 잘 섞고 PDA 배지에 부어주었다. 항균액은 배양된 P. pentosaseus M132-2를 원심분리(9,950×g, 4℃, 15 min)하여 회수한 상등액을 막 필터(0.45 μm pore size, Millipore, Burlington, VT, USA)로 제균하여 준비하였고, 항균활성은 agar well diffusion assay를 이용하였다.
내산성은 완충액의 pH를 HCl(10N)을 이용하여 2.5와 7.0으로 조절한 후 유산균 현탁액(1.0×108 CFU/mL)을 접종하고 0, 0.5, 1, 2, 3시간 동안 37℃에서 배양하면서 생균수를 측정하였다. 내담즙성은 MRS 액체배지에 0.3%(w/v) bile salts(Sigma-Aldrich, St. Louis, MO, USA)를 첨가하여 제조한 인공 담즙액(10 mL)을 37℃에서 배양하면서 1시간 간격으로 생균수를 측정하였다.
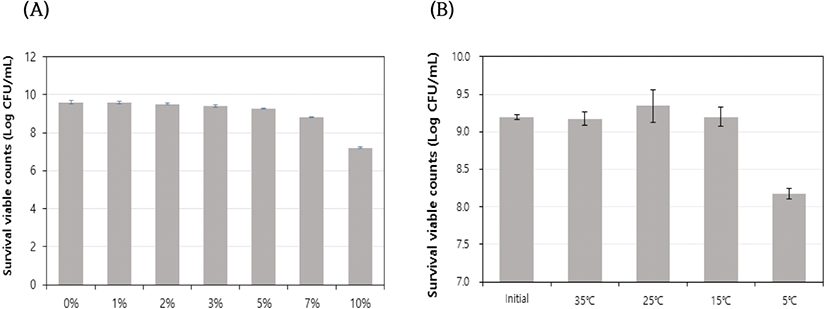
내염성 실험을 위해 M132-2 균주를 24시간 37℃에서 전배양한 후 9 Log CFU/mL로 조정하여 1%, 2%, 3%, 5%, 7%, 10%의 NaCl을 첨가한 MRS 액체배지에 전배양액을 1% 접종하여 37℃에서 24시간 배양하였다. 저온내성 실험을 위해 M132-2 균주를 24시간 37℃에서 전배양한 후 9 Log CFU/mL로 조정하여 5℃, 15℃에서 24시간 배양하고 35℃, 25℃에서 배양한 생균수와 비교하여 생존율을 계산하였다.
결과 및 고찰
치즈 숙성실 벽면과 숙성 중인 치즈 표면의 미생물 분포를 확인한 결과를 Table 1에 나타내었다. 숙성실 벽면과 치즈 모두에서 위생지표세균인 E. coli 및 coliform과 식중독균인 Salmonella spp., L. monocytogenes, S. aureus는 검출되지 않았다. 다만 치즈 숙성실에서 일반세균이 약 102 CFU/cm2 수준으로 검출되었다. Salmonella 선택배지에서도 미생물 집락(colony)이 5×102 CFU/cm2 수준으로 검출되었으나, 유전자 분석 결과, Serratia quinivorans인 것으로 판명되었다. 치즈의 경우, 일반세균이 약 105–106 CFU/cm2수준으로 검출되어 숙성실 내부에 비해 오염도가 높은 것을 확인할 수 있었다. 일부 식중독균 선택배지에서 미생물이 생장하였으나, 유전자 분석 결과, Staphylococcus equorume임을 확인하였다. 또한 치즈 숙성실과 치즈에서는 약 17–42 CFU/cm2수준의 곰팡이가 검출되었다. 전반적인 곰팡이 오염도는 낮은 수준이었으나, 치즈 숙성실과 치즈 자체 표면에서 비슷한 수준으로 검출되는 것으로 보아 숙성기간 중 치즈를 잘 닦아준다고 하더라도 환경에 의한 지속적인 오염이 가능하여 이를 예방할 수 있는 방법이 필요하다.
식중독균 5종(E. coliO157:H7, Salmonella enterica, L. monocytogenes, S. aureus, B. cereus)에 대해 항균활성을 보유하여 선발된 P. pentosaseus M132-2가 오염 곰팡이의 저감에도 효과가 있는지 확인하기 위해 곰팡이 3종(A. niger, C. cladosporioides, P. commune)을 대상으로 항균력을 분석하였다. 그 결과, P. pentosaseus M132-2가 상기 곰팡이 3종의 생장을 효과적으로 저해하는 것을 확인하였다(Fig. 1). P. pentosaseus는 유용한 유산균종으로 Shin 등[15]은 김치에서 분리한 균주에서 항균활성이 있음을 보고한 바 있고, Choi 등[16]은 이탈리안 라이그라스에서 분리한 균주에서 항진균활성을 분석한 결과를 보고한 바 있다. 본 연구에서 활용한 균주는 항균활성과 항진균활성을 모두 보유하여 치즈 숙성 중 오염 미생물을 효과적으로 저감할 수 있을 것으로 생각한다.

프로바이오틱스 특성을 평가하기 위해 내산성과 내담즙성을 분석한 결과를 Table 2에 나타내었다. 초기 접종균주와 비교하여 pH 2.5에서 3시간 배양하였을 때 89.57%의 생존율을 나타내었고, 담즙산에서 4시간 배양하였을 때 91.46%의 생존율을 보여 P. pentosaseus M132-2 균주의 약 90%가 산성 조건과 답즙산에서 생존 가능함을 확인하였다. 프로바이오틱스 균주로 잘 알려진 Lacticaseibacillus rhamnosus GG 표준균주와 비교하였을 때도 약간 높은 생존율을 보였다(Table 2).
환경 저항성 특성을 분석하기 위해 내염성과 저온 내성을 분석하였다(Fig. 2). 내염성 확인을 위해 염화나트륨(NaCl)을 첨가하지 않은 대조군의 생균수와 비교하여 생존율을 계산한 결과, 염화나트륨 농도 1%–7%까지는 90% 이상의 높은 생존율을 유지하였고, 염화나트륨을 10% 첨가한 배지에서는 약간 감소하여 75.1%의 생존율을 보였다(Fig. 2A). 특히 내염성 유산균으로 알려진 Leuconostoc mensenteroides ATCC 8293이 소금 농도 2%–4%에서 내염 특성을 보인 반면[17], P. pentosaseus M132-2 균주는 10%에서도 높은 생존율을 보여 고염에도 매우 높은 저항성을 가지고 있는 것을 확인하였다. 숙성 치즈의 염도가 2% 내외인 것을 고려한다면 치즈의 제조 조건은 P. pentosaceus M132-2 균주의 생장과 유지에 영향을 미치지 않을 것으로 사료된다. 또한 저온 내성을 확인한 결과, 35℃, 25℃와 마찬가지로 15℃에서도 생존율에 차이가 거의 없었으며, 5℃에서도 88.8%의 생존율을 나타내어 높은 저온 내성을 보이는 것을 확인하였다(Fig. 2B).
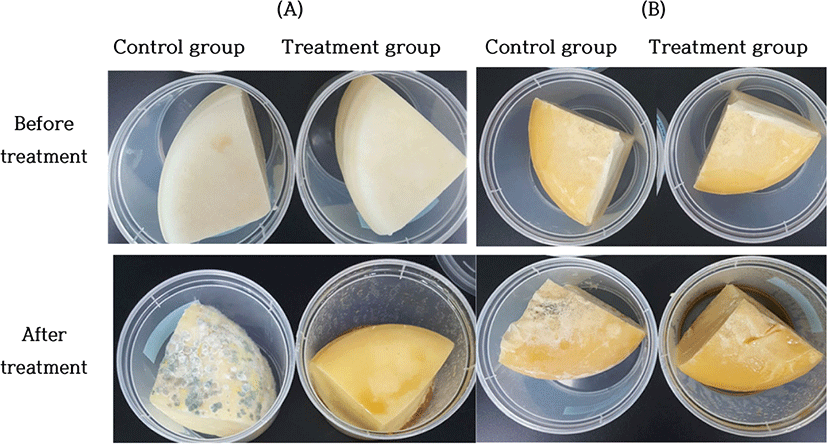
P. pentosaceus M132-2 균주의 항균효과가 실제 치즈에서도 발휘되는지를 확인하기 위해 제조한 고다 치즈를 사용하여 오염 곰팡이에 대한 저해 활성을 분석하였다. 고다 치즈는 하루 전 제조한 제품과 3개월 숙성한 제품을 대상으로 하였다. 그 결과 Fig. 3에서와 같이 M132-2 균주를 처리한 치즈는 무처리 대조군에 비해 곰팡이의 성장이 현저히 저해되는 것을 확인할 수 있었다. 본 연구의 결과를 종합적으로 볼 때, P. pentosaceus M132-2 균주의 처리는 수개월 이상 숙성과정을 거치는 치즈에서 오염 곰팡이를 저해하기 위한 유용한 수단이 될 수 있다.
요 약
항균활성을 가진 유산균은 생균제 등의 형태로 식품 중 부패나 식중독을 유발하는 유해균을 저해하는데 효과적으로 활용할 수 있다. 이에 본 연구에서는 된장에서 분리한 유산균인 P. pentosaceus M132-2 균주를 주요 오염 곰팡이 3종을 대상으로 분석한 결과, 이들의 생장을 모두 저해하여 항곰팡이능을 보유한 것을 확인하였다. 또한 M132-2 균주는 우수한 내염성과 저온내성을 가지고 있어 치즈의 염도와 저온의 숙성온도에서도 생존이 가능할 것으로 판단된다. 마지막으로 M132-2 상등액을 실제 고다 치즈에 적용한 결과, 오염 곰팡이 생장이 현저하게 저해되는 것을 확인하였다. 결과적으로 P. pentosaceus M132-2 균주는 치즈를 비롯한 다양한 식품의 부패 방지에 활용할 수 있는 유용한 수단이 될 수 있다.
