서 론
프로바이오틱스는 장내균총의 안정화, 변비 억제를 포함하여 항암, 항콜레스트롤, 항당뇨 등의 임상적 효능이 알려지면서 이에 대한 연구가 활발히 이루어지고 있다. 새로운 균주가 프로바이오틱스로 계속해서 개발되고 있지만, 균주에 따라 새로운 안전성 문제가 보고되기도 하므로 프로바이오틱스 균주 특성을 반영할 수 있는 안전성 검사 절차가 필요하다. 국외에서는 프로바이오틱스 허가만을 위한 가이드라인을 별도로 제공하여 관리하고 있으나, 국내의 경우 건강기능식품 기능성 원료 인정을 위한 전반적인 자료 제출 가이드라인을 제공하고 있고, 프로바이오틱스 원료에 대한 구체성과 특이성은 부족한 실정이다. 이에 프로바이오틱스의 특성을 고려한 안전성 평가 절차 개선의 필요성이 있다고 판단되었으며, 따라서, 본 논고를 통해 국내·외 프로바이오틱스 안전성 평가 현황을 분석하고, 안전성 평가 절차 확립을 위한 방안을 제시하였다.
본 론
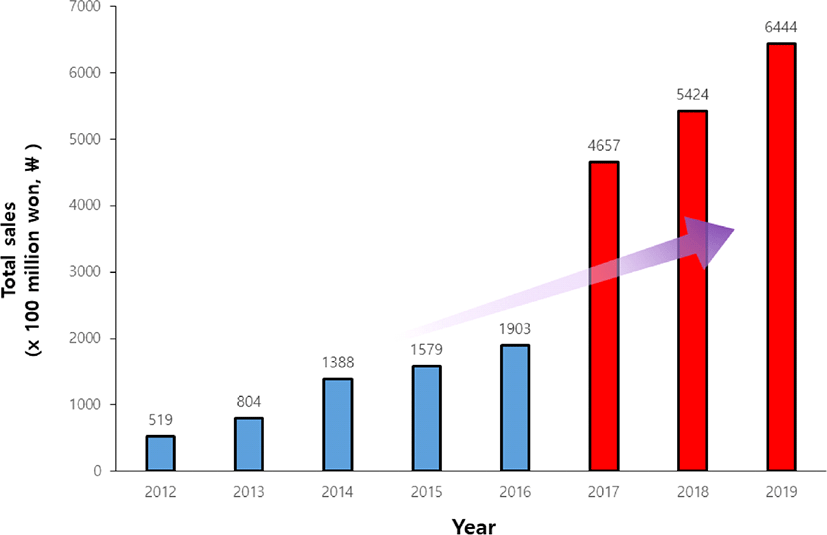
프로바이오틱스는 ‘적절한 양으로 투여될 때 숙주에게 건강상의 이익을 부여하는 살아있는 미생물’로 정의된다[1]. 프로바이오틱스는 장내균총의 안정화, 변비 억제, 유해세균의 정착 억제에 따른 부패산물 생성 감소와 질병예방의 기능을 한다고 알려져 있으며, 이 밖에 면역활성화 작용, 항암, 항콜레스트롤, 항당뇨, 항알러지, 유당불내증의 경감 등의 임상적 효능에 대한 연구가 활발히 이루어지고 있다[2,3]. 최근, 건강에 대한 관심의 증가와 함께 건강 기능성을 갖는 프로바이오틱스 시장이 빠르게 성장하고 있으며, 국내 프로바이오틱스 시장은 2012년 519억 원에서 2016년 1,903억 원으로 규모가 5년 만에 4배 이상 빠르게 성장하고 있다(Fig. 1)[4,5]. 한국건강식품협회가 추정하는 시장은 이보다 더 확대되고 있는데, 이는 생산량 기준으로 예측한 것이 아니고 판매량기준으로 예측한 것으로 실제 시장과 차이가 있지만, 지속적으로 성장하고 있는 것은 분명하다. 전 세계적으로도 프로바이오틱스 시장은 지속적으로 성장하여 그 규모가 대략 49.4억 달러로 추산되었고, 매년 7% 성장률로 증대될 것이라고 예상되었다[6]. 하지만 이렇게 프로바이오틱스 시장이 지속적으로 성장하고 있는 한편, 이에 대한 안정성 문제도 함께 대두되고 있어 프로바이오틱스 안전성 검사의 강화에 대한 필요성이 제기되고 있다.
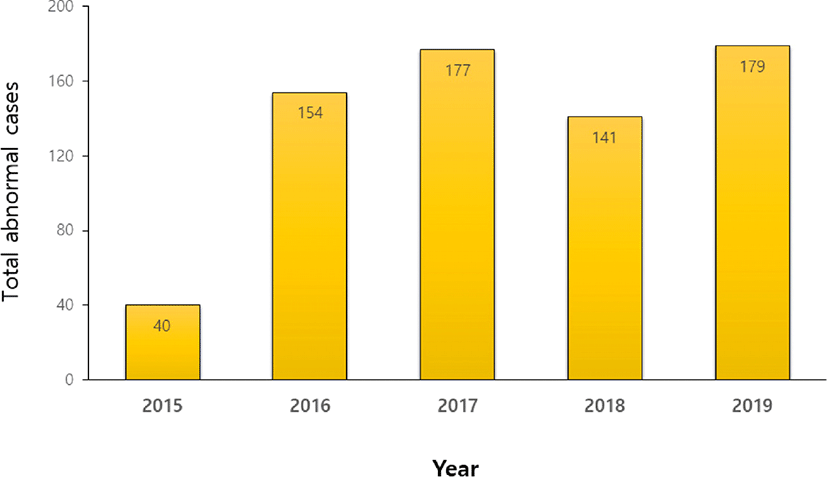
식품안전정보원[7]에서 조사한 국내 건강기능식품 이상사례 중 프로바이오틱스 제품 고발 건 수는 2019년까지 총 1,066건으로, 매년 신고사례는 증가하고 있는 추세이며(Fig. 2), 이러한 신고 사례를 바탕으로 식품의약품안전처에서는 기존에 허가된 프로바이오틱스에 대한 안정성 및 기능성 재평가를 실시하고 있으며, 지속적으로 재평가를 예고한 바 있다[8,9].
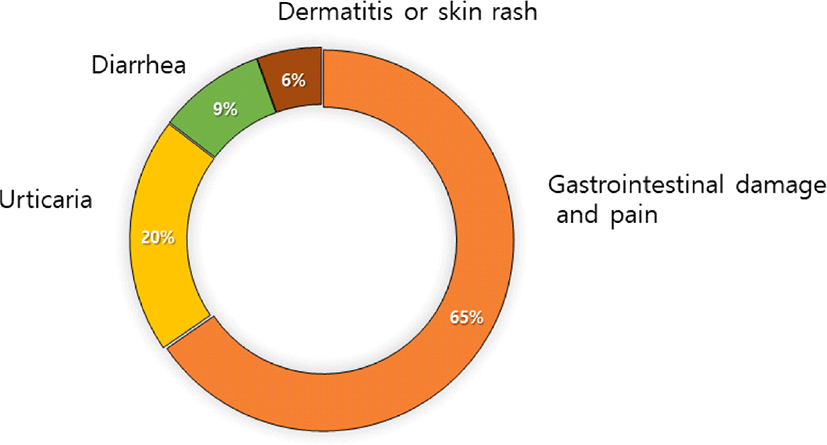
프로바이오틱스의 주된 부작용으로는 프로바이오틱스 과다 복용으로 인한 장 속 가스 발생 및 설사, 복통과 피부 홍반, 소양증(피부가 가려운 증상) 등을 유발하는 알레르기 발생 등이 보고되고 있다[10]. 2016년 한국보건의료연구원에서 발표한 바에 따르면, 2015년까지 식품의약품안전처에 보고된 총 408건의 이상사례 중 80여 건이 프로바이오틱스와 관련된 부작용으로 두통, 복부통증, 설사 등이었으며, 한국소비자원 2013–2015년 신고사례 중 53.7%는 소화기계통 장기손상 및 통증, 16.4%가 두드러기, 이 외에는 설사, 피부증상이 해당되었다(Fig. 3)[11]. 특히 면역억제 환자 및 조산아 등의 경우 패혈증, 균혈증 등의 위해사례가 보고되어 해당 위험군은 전문의의 상담 또는 처방을 통해 프로바이오틱스를 복용하는 것이 필요하다고 권고하였다. 또한, 프로바이오틱스 제품의 이상사례에는 제품 섭취로 인한 부작용 사례뿐만 아니라, 미생물 동정이 잘못되어 있거나 제품 내에 표기되어 있지 않은 균주의 오염, 특히 최소 균주 함유량에 미달하는 사례 등도 포함되어 프로바이오틱스 제품의 안전성 및 품질 관리에 대한 요구가 높아지고 있다[12]. 특히, Enterococcus 속은 사람, 동물의 장내에 존재하며, 프로바이오틱스 고시형에 속하는 종류로는 Ent. faecalis와 Ent. faecium뿐이다. 이들 균주들은 과거에 Streptococcus faecalis와 Str. faecium으로 분류되었었다. 미생물학자인 Robecca Lacefield에 의해 개발된 분류법인 Lancefield 분류는 Streptococcaceae(Lactococcus, Streptococcus 등)를 탄수화물 항원에 따라 A–O 항원으로 구별하는데, Enterococcus는 Lancefield 그룹 D Streptococcus에 속한다(Group A, 인체병원성; Group B, 기회주의적 병원성; Group C, 동물 병원성; Group D, Enteric 또는 non enteric). 일부 Ent. faecium은 강력한 항생제로 알려진 반코마이신에 내성을 가지고 있는데, 이를 반코마이신내성장구균(Vancomycin resistant Enterocccus faecium, VRE)이라 부르며, 사용에 주의를 기울여야 한다. 따라서 식품의약품안전처에서는 Enterocccus 균주들에 대해 프로바이오틱스 재평가를 실시한 후 2019년부터는 항생제 내성 유전자의 유무를 확인할 것을 의무화하고 있다.
프로바이오틱스로 사용되는 균주는 임상적 효능이 균주 특이적(strain specific)이고, 농도에 따라서도 그 효과가 상이하게 나타나므로 얻고자 하는 기능성에 따라 유효한 균주를 선택하여 사용하여야 한다[13]. 따라서, 프로바이오틱스 균주에 따라 안전성과 기능성에 대한 평가도 달라져야 할 것이다. 또한, 현재까지의 미생물 종의 분류가 달라질 가능성도 있기 때문에 균주의 전장 유전체, 비교유전체와 같은 유전체 분석 기술을 이용한 더 명확한 균주 분류를 해야 한다. L. acidophilus가 L. casei로 재분류되었다가 L. rhamnosus로 재 명명된 사례가 있었으며, Salvettti 등[14]은 Lactobacillus 속을 포함한 종 그룹이 10개의 문(phylogroup) 및 23개의 속(genus)으로 재분류될 수 있다고 발표한 바 있다[12,14].
현재, 식품의약품안전처 고시 ‘건강기능식품의 기준 및 규격’상의 기능성원료-프로바이오틱스에 해당하는 균주는 Lactobacillus 속과 Bifidobacterium 속 등에 포함되는 총 19종이다(Table 1). 고시형 프로바이오틱스 균주에 대해서는 별도의 안전성 평가를 요구하지 않지만, 이 중 Enterococcus 속은 항생제 내성을 일으킬 수 있다는 연구결과가 발표됨에 따라 Enterococcus 속을 프로바이오틱스로 이용하고자 할 경우에는 항생제 내성 유전자 및 독성 유전자검사를 실시하도록 고시되어 있다. 고시된 균주 외의 미생물을 프로바이오틱스로 사용하고자 할 경우에는 별도의 유효성과 안전성에 대한 심사 과정을 거쳐 개별 인정형 제품으로 허가를 받아야 하며[15], 2008년부터 현재까지 10여 종의 균주가 개별 인정형 프로바이오틱스로 허가받아 사용되고 있다[16]. 이처럼 프로바이오틱스의 안전성 문제와 함께 새로운 균주가 프로바이오틱스로 계속해서 개발되고 있으며, 균주에 따라 새로운 안전성 문제가 보고되기도 한다. 이에 따라, 프로바이오틱스에 대한 안전성 검사의 필요성은 점차 높아지고 있으며, 국내 프로바이오틱스 균주 인정을 위한 안전성 평가 체계 마련이 요구되고 있다.
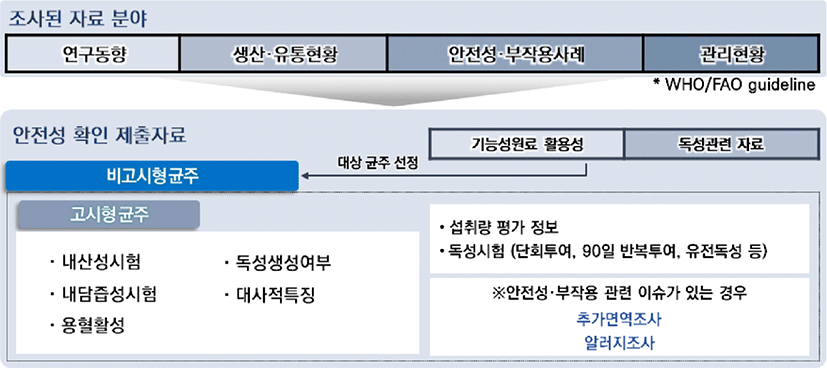
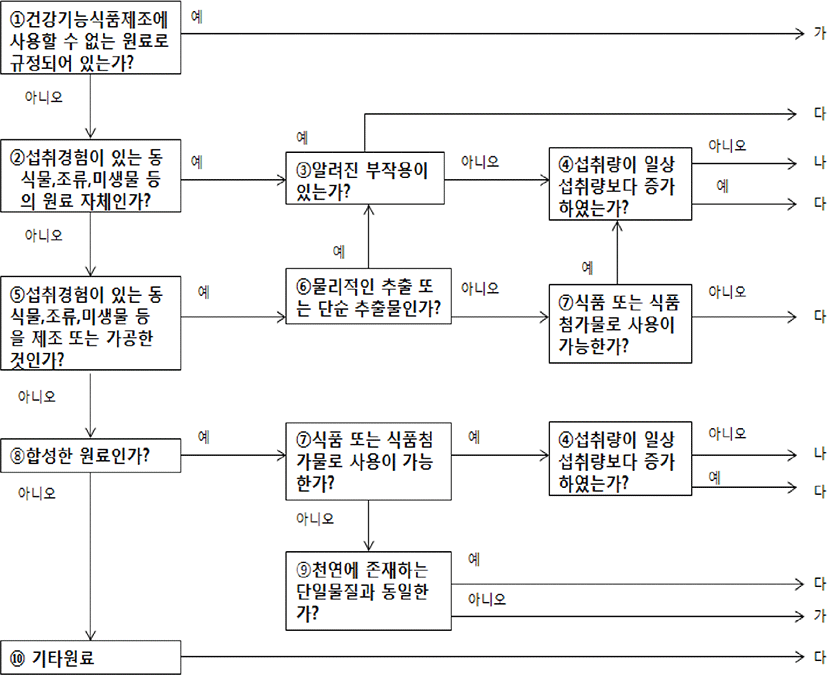
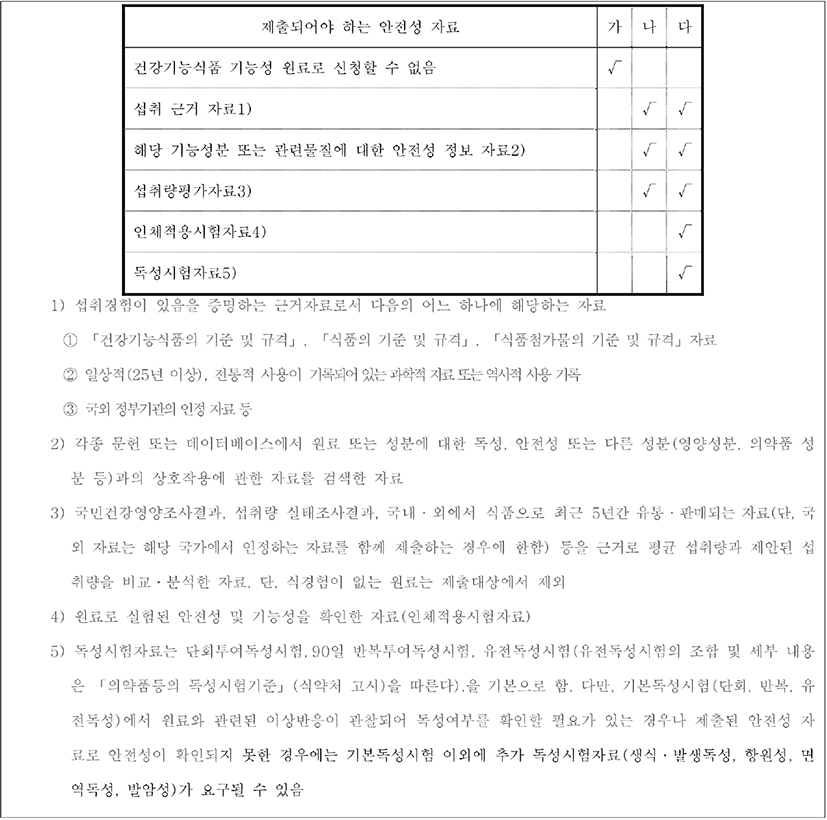
국내 프로바이오틱스 균주 인정을 받기 위해서는 식품의약품안전처 ‘건강기능식품 기능성 원료 및 기준·규격 인정에 관한 규정’의 제14조 제7호 나목 관련한 ‘건강기능식품 기능성 원료의 안전성 평가를 위한 의사결정도’에 따라 안전성에 관한 과학적 평가 자료를 제출하도록 하고 있다(Fig. 4)[15]. 이 의사결정도는 건강기능식품의 제조 원료, 부작용 여부, 섭취량 등에 따라 제출되어야 하는 안전성 자료를 결정하며, 프로바이오틱스의 경우 섭취 근거 자료, 해당 기능성분 또는 관련물질에 대한 안전성 정보 자료, 섭취량평가자료 등을 제출하도록 되어 있다(Fig. 5). 따라서 고시형의 경우, 의사결정도 ‘나’에 해당이 되며, 고시형이지만 strain을 표기해서 사용하는 경우(예: xx회사에서 자체 분리하여 이름 붙인 L. plantarum XX 균주)에는 의사결정도 ‘다’를 적용하는 것이 안전성확보 차원에서 적절한 것으로 파악되고 있다.
식품의약품안전평가원에서는 ‘건강기능식품 기능성 원료 인정을 위한 제출자료 작성 가이드’를 통해 프로바이오틱스(생균) 원료의 안전성 평가 가이드를 제공하고 있다[17]. 신청 균주 확인을 위해서 전장유전체 자료를 제출하여야 하며, 고시형 균주의 경우 FAO/WHO 가이드라인에 따른 안전성자료(항생제내성, 내산성시험, 용혈활성 등)를 제출하여야 한다[18]. 비고시형균주는 이외에도 독성시험자료(단회투여독성시험, 유전독성시험 등)를 추가적으로 제출을 하도록 제시하고 있다[17].
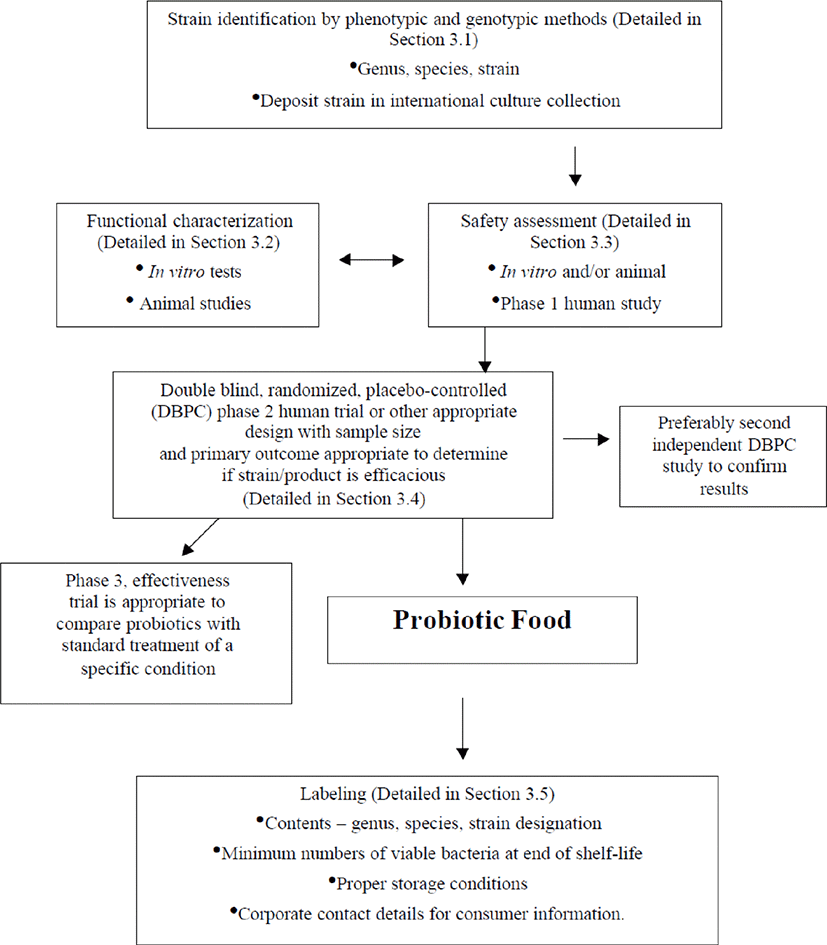
FAO/WHO는 2002년 식품 영역에서의 프로바이오틱스 평가 가이드라인을 개발하였다. 가이드라인에 따라 프로바이오틱스 균주 동정에서부터 기능성 및 안전성 평가 방법과 인정 후 표시사항까지 프로바이오틱스 평가 전반에 대한 흐름과 실시 방법을 제시하고 있다(Fig. 6). 특히 안전성 평가의 경우, 최근 프로바이오틱스 균주의 안전성과 부작용에 관한 연구결과를 제시하며, 항생제내성, 내산성시험, 용혈활성 등의 최소한의 안전성 평가를 실시하도록 권장하고 있다.
캐나다 보건부(Health Canada)의 ‘Guidance document-the use of probiotic microorganisms in food’에서는 프로바이오틱스를 이용한 식품에서 식품 라벨 및 광고에 있어 프로바이오틱스로서 허용되는 건강강조표시(health claims)를 명확히 하도록 하고, 안전성 및 안정성(stability)에 대한 기준을 제시하고 있다[11,19]. 또한 캐나다 보건부에서는 치료목적의 프로바이오틱스를 천연건강기능 제품(Natural Health Product, NHP)으로 분류하는데, NHP 프로바이오틱스에 대한 라이센스 신청이나 라벨에 관한 사항은 각각 ‘Product licence applications for natural health products containing probiotics’[20]와 ‘Natural health product probiotics’[21]을 통해서 제시하고 있다.
European Food Safety Authority(EFSA)에서는 식품이나 사료에 사용될 미생물은 QPS(The Qualified Presumption of Safety) 시스템을 도입하여 전문가가 해당 미생물의 안전성을 평가한 후 사용하도록 하고 있다. 2005년 EFSA에서 제시한 절차에 따라, QPS 획득을 위한 안전성 평가는 분류(taxonomy), 해당 미생물에 대한 안전성 관련 정보의 양(body of knowledge), 병원성(pathogenicity), 용도(end use) 등을 근거로 진행한다[22,23]. 하지만, EFSA에서는 프로바이오틱스에 대한 정의는 내리지 않고 있으며, 프로바이오틱스의 임상적 효능에 대해서도 거의 인정하지 않는다[24]. 즉, 사용된 균주에 대한 프로바이오틱스 효능을 식품에 표시할 수 없다. 프로바이오틱스는 건강기능식품 보충제로서만 인정하고 있는데, 이와 관련된 신청 절차는 EFSA의 식품보충제 규정(food supplement directive, FSD)이나 세부그룹별 식품관련 규정(regulation on food for specific groups, FSG regulation)에 따른다.
미국은 프로바이오틱스를 용도에 따라 식품보조제, 식품 성분 또는 의약품으로 규제한다[25]. 식품첨가물로 미생물을 사용하기 위해서는 Food and Drug Administration(FDA)의 사전승인을 받아야 하지만 Generally Recognized as Safe(GRAS)를 통해 안전하다고 인정된 원료는 식품에 첨가가 가능하며, 프로바이오틱스로 사용되는 균주가 GRAS로 인정된 사례가 있다[26]. 하지만 대부분의 프로바이오틱스는 식이보조제로 판매가 되는데, 이 경우에는 FDA 승인 없이 신체 구조나 기능에 어떤 영향을 미치는지에 대한 표시가 가능하다. 임상적 효능의 프로바이오틱스를 의약품으로 판매하고자 할 경우에는 품질자료, 비임상, 임상시험자료 등을 제출하여 FDA 승인 후 판매가 가능하다[25].
국외에서는 프로바이오틱스의 특성에 따라 프로바이오틱스만을 위한 가이드라인을 별도로 제공하여 관리하고 있다. 국내의 경우, 건강기능식품 전반적으로 기능성 원료 인정을 위한 자료 제출 가이드라인을 제공하고 있기는 하지만, 프로바이오틱스 원료에 대한 구체성과 특이성은 부족하다. 이에, 프로바이오틱스의 특성을 고려한 안전성 평가 가이드 라인을 별도로 마련할 필요성이 있다고 판단된다.
프로바이오틱스 특성을 고려한 안전성 평가 가이드라인을 위해서는 현재 마련된 건강기능식품에 대한 가이드라인을 바탕으로 프로바이오틱스 안전성에 대한 최신 연구결과와 국외 가이드라인을 종합하여 가이드라인이 마련되야 한다. 또한, 가이드라인에 프로바이오틱스에 대한 안전성 자료 제출범위(섭취근거 및 섭취량 평가, 안전성 DB 검색 결과, 인체적용시험 평가, 독성시험 평가 등)를 명확히 하고, 안전성 자료 제출을 위한 시험 방법과 설계안이 제시될 필요가 있다(Fig. 7).

현재 고시형 균주에 대해서는 기초적인 안전성 평가(내산성시험, 내담즙성시험, 용혈활성 등)만 하도록 제시되어 있으나, Enterococcus와 같이 안전성에 대한 문제(항생제 내성, 병원성 등)가 새롭게 제기된 균주들이나 소비자에 의한 부작용사례가 신고된 균주에 대해서는 추가적인 면역조사나 알러지 조사 결과를 제출하도록 하고[18], 비고시형균주에 대해서는 기초적인 안전성 평가결과뿐만 아니라, 추가적인 독성시험 결과와 독성관련 자료들을 제출하도록 해야 한다(Fig. 8).
안전성 평가는 프로바이오틱스 건강기능성 원료 인정을 위해 필요한 균주 동정이나 기능성 평가와도 유기적으로 연결될 수 있다. 따라서, 전체적인 프로바이오틱스 건강기능성 원료 인정 프로세스 안에서 안전성 평가에 대한 세부사항(인체적용시험, 항생제 내성, 독소 생성시험 등)이 결정되도록 프로바이오틱스 원료 인정 절차가 제시되어야 한다.
섭취근거는 신청 프로바이오틱스 원료의 국내외 인정현황에 대한 자료를 제출하도록 한다. 기존에 식품이나 환경에 병원성 없이 존재하는 미생물이었는지, 국내 프로바이오틱스로 고시된 균주인지 여부를 제시할 수 있으며, 국외의 경우 미국의 GRAS, 캐나다의 NHP, 유럽의 QPS 등에서 인정한 자료(인정 균주, 용도, 섭취량 등)를 제시할 수 있다. 섭취량 평가는 신청원료의 일일섭취량이 국내외 유통제품의 통상 섭취량 이내인지 관련자료(제품명, 제조사, 표시사항, 섭취 주의사항 등)를 제출하도록 한다.
신청하는 프로바이오틱스 원료 섭취로 인한 안전성 관련 자료(이상반응, 독성, 부작용 사례, 섭취시 주의사항 등)에 대한 학술지 논문, 국내·외 정부보고서, 국제기구 보고서 등의 데이터베이스 검색결과를 제출하도록 제시한다. 검색결과는 검색 데이터베이스와 검색어, 결과에 대한 서술 및 출처를 포함하도록 한다.
인체적용시험 과정에서 관찰된 이상반응이나, 안전성 지표 변화에 대한 관찰 결과를 제출하도록 한다. 인체적용시험의 정보(대상자, 시험물질, 섭취량 및 섭취기간, 안전성 지표 종류 및 결과)를 정리하여 기술하도록 한다.
독성시험 자료 중 유전독성시험 조합은 ‘의약품등의 독성시험기준’-식약처 고시 제2017-71호의 유전독성시험 표준조합 1 또는 2를 참고하여 제시될 수 있으며, 또한 기존 ‘건강기능식품 기능성 원료 인정을 위한 제출자료 작성가이드-식품의약품안전평가원(2019)’의 독성시험자료 제출 가이드를 참고 가능하다.
기본독성시험(단회투여독성시험, 90일 반복투여독성시험, 유전독성시험) 외에 추가 독성 시험(생식·발생독성, 항원성, 면역독성, 발암성)은 기능성 평가 중 부작용 관찰이나 취약군에서의 과도한 면역 증강 여부 사례를 바탕으로 결정하고, 독성시험 방법은 경제협력개발기구(Organization for Economic Cooporation and Development, OECD)에서 정하는 독성시험 방법 등을 따라 분석하여 제시토록 한다. 독성시험 결과 이상반응 및 독성 여부와 최소치사량, 무독성량 등을 결과 자료로 제시한다.
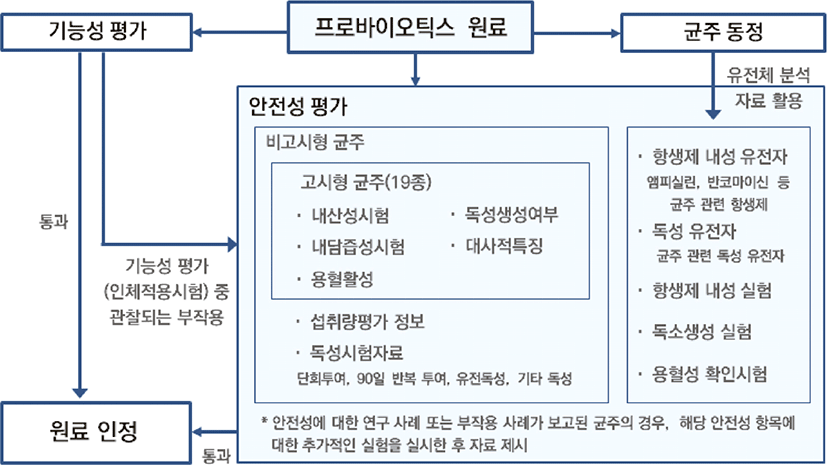
이상의 결과를 종합하여, Fig. 9와 같이 프로바이오틱스 기능성원료에 대한 안전성 평가 절차를 구성할 수 있다. 프로바이오틱스 원료가 기능성원료로 인정받기 위해서는 균주 동정과 기능성 평가 및 안전성 평가 과정을 거쳐야 한다. 현재 프로바이오틱스 기능성원료로 인정 받기 위해서는 사용되는 균주의 종과 특성이 명확히 밝혀져야 하기 때문에 전체 유전자 서열 분석을 통한 균주 동정이 이루어지도록 권고하고 있다. 이 유전체 분석 자료는 균주 계열에 대한 정보뿐만 아니라, 항생제 내성 유전자, 독성 유전자의 유무에 대한 정보도 함께 제공하므로 이를 안전성 평가에 활용할 수 있다. 유전체 분석 결과, 프로바이오틱스 균주가 항생제 내성 유전자나 독성 유전자를 가지고 있다면 항생제 내성 실험과 독소 생성 실험 등을 통해서 그 안전성을 확인하도록 한다. 또한, 기능성 평가 중 인체적용시험이나 동물시험이 진행되므로 프로바이오틱스 원료의 기능성 평가 시험 도중 관찰되는 부작용(이상 반응 발현, 섭취 전후 지표 변화 등)의 유무에 따라 안전성 평가가 이루어질 수 있도록 절차를 제시하였다. 기능성 평가 중 부작용이 관찰되었다면, 추가적인 알러지 반응 시험이나 부작용 시험이 시행되어야 하고, 이에 대한 평가가 이루어져야 한다. 이는 국내 건강기능성 원료 인정 절차와 WHO의 가이드라인에도 제시되어 있는 사항이다. 이처럼 안전성 평가가 기능성 평가 결과와 균주동정에서의 유전체 분석 결과를 활용하여 이루어지도록 하고, 현재의 가이드라인을 바탕으로 고시형 균주와 비고시형 균주에 대한 안전성 평가 시험항목을 각각 제시한다. 최신 연구 동향을 반영하기 위하여 안전성에 대한 연구 사례 또는 부작용 사례가 보고된 균주의 경우, 해당 안전성 항목에 대한 추가적인 실험(알러지 확인 실험, 항생제 내성 및 독소 생성 실험 등)을 실시하고 자료를 제시해야 한다.
결 론
현재 프로바이오틱스 원료 인정을 위한 기능성평가, 안전성 평가에 대한 사항은 건강기능식품 전반적으로 기능성 원료 인정을 위한 자료 제출 가이드라인으로 제공하고 있기는 하지만, 프로바이오틱스 원료에 대한 구체성과 특이성에 대한 고려는 다소 부족하다고 판단되었다. 본 원고에서는 프로바이오틱스 특성을 고려한 안전성 평가 가이드라인을 위해서, 프로바이오틱스에 대한 안전성 자료 제출범위(섭취근거 및 섭취량 평가, 안전성 DB 검색 결과, 인체적용시험 평가, 독성시험 평가)를 명확히 하도록 자료 제출 범위를 일부 제시하였다. 또한, 안전성 평가가 프로바이오틱스 건강기능성 원료 인정을 위해 필요한 균주 동정이나 기능성 평가와도 유기적으로 연결될 수 있도록 프로바이오틱스 원료 인정의 전체적인 절차를 고려한 안전성 평가 절차를 구성하여 제시하였다. 이러한 국내 프로바이오틱스 안전성 평가 절차에 대한 개선안을 통해서 기능성 원료로써 프로바이오틱스의 안전성을 확보하고, 이를 통해 기능성 원료로써의 프로바이오틱스 활용을 높이는 데에 기여할 수 있을 것으로 사료된다.