서 론
인슐린은 췌장의 베타세포에서 분비되어 탄수화물과 지방 대사를 조절하는 호르몬으로서 표적세포(간, 근육 및 지방세포 등)를 자극하여 혈류로부터 포도당을 유입하고, 또한 저장하는 역할을 한다. 당뇨병은 혈중 포도당이 세포 내로의 이동 저하, 여러 조직에서의 포도당 대사 저하 및 간에서의 포도당 신생 증가 등으로 인해 혈중 포도당의 과다 생성되어 나타나는 결과이다. 정상인에서는 혈장 포도당 농도가 120 mg/dL 이상 상승하는 경우가 드물지만, 인슐린 결핍 당뇨병에서는 이보다 훨씬 높은 혈중 포도당 농도를 유지한다[1].
α-글루코시다아제는 소장의 브러쉬 경계막(brush-border membrane)에 존재하는 소화 효소로, 이당류나 다당류가 탄수화물이 소화 흡수되기 위한 상태인 단당류로 가수분해하는 역할을 한다. 소장 내 α-글루코시다아제에 의한 탄수화물의 흡수는 대개 소장 상부에서 신속하게 이루어지게 되어 식후 혈당치의 급격한 상승을 초래한다. 따라서 α-glucosidase와 α-amylase의 억제는 탄수화물 식이 후 식후 혈당 증가를 감소케 하여 제2형 당뇨병 환자와 경계 환자의 식후 혈당 관리에 중요하다[2].
또한, butyrate, acetate와 propionate는 단쇄지방산으로 식이섬유로부터 장내균에 의해 발효되는데 에너지 대사에 중요한 역할을 한다[3]. 동물실험에서 propionate는 간에서 지방생성 및 포도당신생성에 영향을 미치며, acetate는 말초적으로 콜레스테롤 합성의 기질로 작용한다[4]. 장내에서 단쇄지방산은 장내 pH, 세포 증식 및 분화, 유전자 발현 조절 역할 이외에도 장 상피세포의 영양소로 작용한다[5]. 기전적으로, 단쇄지방산 생성은 장내 pH를 산성화시키고, 이러한 산성조건에서 생육이 저해되는 유해균의 생균수를 감소시키며, 담즙산의 용해도 감소, 무기질 흡수 증진, 암모니아 흡수 감소 등을 유발한다[6]. 이러한 영향으로 단쇄지방산은 과민성 대장 증후군, 염증성 장질환 발병을 낮추고, 암, 심혈관질환, 비만의 위험을 감소시킨다. 특히 단쇄지방산은 손상된 대장의 재생을 촉진하고, 대장벽을 보호하여 대장 기능을 증진한다[7].
최근 인슐린 저항성이 있는 대사증후군 남성 환자에게 마른 공여자의 분변을 이식하는 이중맹검 무작위 대조 연구를 시행한 결과, 마른 공여자로부터 이식을 받은 군에서 이로운 대사적 영향이 관찰됐고, 말초(근육) 인슐린 민감성이 유의하게 향상됐다. 또한, 장 미생물 다양성이 유의하게 증가했을 뿐 아니라, 분변 내 Roseburia와 소장 내 Eubacterium halii 와 같은 butyrate 생산 세균의 수가 눈에 띄게 증가했다. 개별적으로 제2형 당뇨병 환자의 장 미생물총에서 건강한 사람 대비 Roseburia와 Faecalibacterium prauznitzii로 불리는 butyrate 생산균이 감소했음을 발견했다. 이에 따라 단쇄지방산은 항당뇨에 중요한 역할을 하는 것으로 보고되고 있다[8, 9].
Probiotics는 숙주동물의 건강에 매우 유익한 효과를 주는 살아있는 유익한 미생물로, 유익한 효과를 발휘하기 위해서는 여러 주요적인 특성을 지녀야 한다. Probiotic은 장내의 낮은 pH와 담즙산에 대한 내성을 지녀야 하고, 안정성이 확보된 generally recognized as safe(GRAS) 미생물이어야 한다. 또한, 숙주동물의 장 표피에 부착이 가능해야 하며, 병원균에 대한 항균성이 있고, 가공 및 저장 중 강한 생존능력을 유지할 수 있어야 한다[10-12].
본 연구는 김치로부터 분리·선발된 Lactobacillus plantarum KI69가 기능성 식품으로 적용할 수 있는지 알아보기 위해 L. plantarum KI69의 항당뇨 효과와 생리적인 특성을 조사하였다.
재료 및 방법
각각 지역과 종류가 다른 김치 40종을 수거하여, 브롬크레졸 퍼플(bromcresol purple)과 소듐아자이드(sodium azide)를 첨가한 변형 MRS 배지[13]에 0.1 mL씩 평면도말법으로 접종한 후 37°C에서 48시간 배양하고, 균락을 변형 MRS 배지에서 순수 분리한 다음 노란색으로 변한 균락을 잠정적 젖산균으로 선발하였다. 선발된 균주는 변형 MRS 배지에 도말한 후, 호기 배양하여 순수분리하였다. 순수 분리 후 Lactobacilli MRS broth(Difco, USA)에서 37°C, 18시간 배양한 다음 tryptic soy agar(Difco, USA) slant에 37°C에서 18시간 배양하여 보관하였다.
α-Amylase 활성 저해능 측정은 Xiao et al.[14]의 방법을 변형시켜 본 실험에 이용하였다. α-Amylase를 0.1 g/10 mL 농도로 증류수를 이용해 희석시키고, 기질인 가용성 전분은 증류수로 0.5%로 제조한 후 시료와 혼합하여 25°C에서 10분간 반응시켰다. 0.1N HCl 용액으로 반응을 정지시킨 후, iodine 용액을 이용하여 30분간 발색하여 660 nm로 흡광도를 측정하였다. 결과는 α-amylase만을 처리하였을 때와 시료를 혼합하여 처리하였을 때의 흡광도를 비교하여 나타내었다.
α-Glucosidase 활성억제 효과 측정은 p-NPG(p-nitrophenyl α-glucopyranoside)을 기질로 사용하는 Si et al.[15]의 방법을 이용하였다. 시료 50 μL를 0.75 unit/mL α-glucosidase 효소액 50 μL, 200 mM potassium phosphate buffer(pH 6.5) 50 μL와 혼합하여 37°C에서 10분간 preincubation한 후 0.1 M phosphate buffer(pH 7.0)에 녹인 3 mM p-NPG 100 μL를 가하여 37°C에서 10분간 반응시켰다. 0.1 M Na2CO3 750 μL로 반응을 정지시키고, 405 nm에서 흡광도를 측정하였다.
KI69 균주를 MRS broth와 3% 난소화성 다당류(maltodextrin)가 첨가된 MRS broth에 1% 접종하여 37°C, 18시간 배양 후 상층액을 분리하여 단쇄지방산인 propionic acid, acetic acid 및 butyric acid의 함량을 측정하였다.
Acetic acid는 약 5 mL의 시료액을 실험직전 끓여서 식힌 증류수로 시료액의 색이 경미하게 보일 때까지 희석한 다음 1% 페놀프탈레인 용액 몇 방울 가한 후, 엷은 분홍색이 30초간 지속될 때까지 0.1 N 수산화나트륨 용액으로 적정하고, 다음 식에 따라 총산을 구하였다.
시료 4 g에 ACN을 40 mL가 되도록 첨가한 후 sonicator를 이용하여 30분 동안 추출하였다. 추출한 용액을 1,770 g, 10분 동안 원심 분리하여 상층액을 분리하였다. 분리된 상층액은 0.22 μM membrane filter로 여과하여 질소농축기를 이용하여 농축 후 gas chromatograph/mass spectrometer(GC-MS) 분석을 실시하였다. GC-MS 분석 조건은 Table 1과 같다.
시료의 butyric acid를 추출하기 위해 chloroform-methanol 추출법을 이용하였다. Chloroformmethanol을 이용하여 추출한 시료를 evaporator를 이용하여 농축시킨 후, 지방산 메틸 에스테르 유도체화 시켰다. 지방산 메틸 에스테르 유도체는 다음과 같은 방법으로 실시하였다. 튜브에 지방질 20 mg을 취하여 0.5N NaOH/Methanol 2 mL를 넣어 마개를 막고 heating block(100°C)에서 약 5분간 가수분해시켰다. 냉각 후 14% BF3/Methanol 2 mL을 넣고 5분간 반응시킨 다음 이소옥탄 2 mL를 넣고 진탕하였다. 반응이 끝나면 시료가 든 튜브에 포화식염수 2 mL를 넣었다. 마개를 막고 5초간 가볍게 흔들어준 후 이소옥탄층을 뽑아 무수황산나트륨을 이용하여 탈수시켰다. 탈수된 지방산 메틸 에스테르 시험액을 받아 gas chromatograph(HP-6890GC FID, Agilent Technologies, Santa Clara, CA, USA)에 주입하여 분석하였다. Gas chromatograph 분석 조건은 Table 2와 같다.
분리·선정된 KI69 균주는 MRS 액체배지에서 2회 이상 계대 배양하여 활성을 높인 후 실험에 사용하였다. 젖산균의 동정은 Hammes et al.[16]의 방법에 의하여 실시하였다. 순수 분리된 균주는 Gram 염색, 포자생성, 호기적 및 혐기적 생장, Catalase 생성, 15°C 및 45°C에서의 생장, glucose로부터 가스 생성, arginine으로부터 ammonia 생성을 측정하였으며, 현미경 관찰과 API 50 CHL kit(API bioMerieux, France)를 이용한 당 발효 실험을 실시하였다. 젖산균의 DNA sequence 분석에는 universal primer 27F(5'-AGA GTT TGA TCC TGG CTC AG-3')와 1492R(5'-GGT TAC CTT GTT ACG ACT T-3')를 사용하였으며, solgent EF-Taq을 사용하여 PCR을 실시하였다. 증폭과정은 95°C, 15분을 한 후 95°C, 20초; 50°C, 40초; 72°C, 1분 30초를 30회 시행하였으며, 72°C, 5분으로 마무리하였다. 서열 분석은 PCR product를 solgent PCR purification kit(SolGent, Korea)로 purify한 후 ABI 3730XL DNA sequencer(Applied Biosystems, USA)로 자동 분석하였다.
항생제 내성 시험은 MRS 액체배지에 L. plantarum KI69 균주를 접종하고 37°C에서 18시간 배양한 후 0.1% peptone 용액에 적정농도로 희석하였다. 각 항생제가 각 농도별로 포함된 tryptic soy 액체배지에 105–106 CFU/mL 수준으로 접종하고 37°C에서 48시간 배양한 후 육안으로 관찰하여 생장 여부를 결정하였다. 항생제 내성 측정은 2배 희석방법을 사용하였으며, 억제된 가장 낮은 농도를 MIC(Minimal inhibitory concentration) 값으로 결정하였다. 항생제는 Sigma(USA)로부터 구매하여 사용하였다. 항생제는 Amikacin, Gentamicin, Kanamycin, Streptomycin, Ampicillin, Penicillin-G, Oxacillin, Bacitracin, Polymyxin B, Ciprofloxacin, Tetracycline, Clindamycin, Erythromycin, Rifampicin, Vancomycin 및 Chloramphenicol을 시험에 사용하였다.
MRS 액체배지에서 37°C, 18시간 동안 배양한 L. plantarum K69 균주를 생리식염수로 희석하여 105–106 CFU/mL 수준의 시료를 조제한 후, API ZYM kit(API bioMerieux, Lyon, France)를 이용하여 37°C에서 5시간 배양한 다음 효소반응 시켰다. 효소활성은 표준색상표를 비교하여 0–5의 수치로 표시하였으며, 대조구 이외의 alkaline phosphatase, eterase(C4), esterase lipase(C8), lipase(C14), leucine arylamidase, valine arylamidase, cystine arylamidase, trypsin, chymotrypsin, acid phosphatase, naphthol-AS-BI-phosphohydrolase, α-galactosidase, β-galactosidase, β-glucuronidase, α-glucosidase, β-glucosidase, N-acetyl-β-glucosaminidase, α-mannosidase, β-fucosidase 효소의 활성을 측정하였다.
Gilliland & Walker[17]의 방법에 따라 MRS 액체배지에서 37°C, 18시간 배양된 L. plantarum K69 균주를 0.05% cysteine이 함유된 MRS 액체배지에 0.3% oxgall을 첨가한 배지와 대조구로서 oxgall을 첨가하지 않은 배지에 각각 1% 접종하였다. 37°C의 incubator에서 7시간까지 혐기배양하면서 시간별로 BCP plate count agar 평판에서 부어 굳힌 후 37°C에서 48시간 혐기배양하여 계수하였다.
Clark et al.[18]의 방법에 따라 37% HCl을 증류수에 섞어 pH 2, 3, 4 용액과 대조구로서 pH 6.4 용액을 제조하였고, 제조된 pH 용액 10 mL에 0.05% cysteine이 함유된 MRS 액체배지에서 37°C, 24시간 배양된 L. plantarum K6 균주(약 109 CFU/mL)를 1 mL씩 섞은 후 37°C에서 혐기 배양하면서 0, 1, 2, 3시간 후의 생균수를 BCP plate count agar 평판에서 부어 굳힌 후 37°C에서 48시간 혐기 배양한 다음 계수하였다.
Gilliland & Speck[19]의 방법에 따라 항균력 측정에 사용한 지시균인 Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes 및 Staphylococcus aureus 는 한국식품연구원으로부터 분양 받았으며, 지시균의 증식배지로서 Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes,Staphyloccous aureus는 nutriunt 액체배지에서 호기적으로 37°C, 24시간 배양하였다. 혼합배양 및 대조군에 사용된 배지는 MRS 액체배지로서 젖산균과 지시균을 각각 접종하여 37°C에서 24시간 배양하였다. 선택배지로서 Escherichia coli 는 EMB agar, Salmonella Typhimurium은 Bismuth sulfite agar, Listeria monocytogenes 는 Supplement (X123)가 함유된 Listeria Isolation Agar, Staphyloccous aureus는 Baird parker agar를 사용하여 37°C에서 6시간 배양하였다. 젖산균에 의한 지시균의 억제율은 다음의 식으로 구하였다.
실험에 사용한 HT-29 세포는 한국세포주은행(seoul, Korea)을 통하여 구입하였고, Kim et al.[20]의 방법에 따라 10% fetal bovine serum(FBS; Gibco, USA)과 1% penicillin-streptomycin(P/S; Gibco, USA)이 첨가된 RPMI 배지를 이용하여 37°C, 5% CO2/95% air가 공급되는 조건의 항온기(incubator)에서 배양하였다. HT-29 세포를 배양하기 위하여 세포를 12 well plate의 각 well에 106 cells/well로 분주하고, 2일에 한번씩 배지를 교체해 주며, 실험 전날 95%까지 세포가 찼을 때 serum free medium으로 교체하여 cell이 더이상 차는 것을 막아주었다. 균주의 장내 부착능을 실험하기 위해 2차 계대배양한 균주 1 mL를 취해 16,000 g에서 3분간 원심분리하고 serum free medium을 이용해 두 번 세척하였다. 세척한 균주를 RPMI 배지로 희석하여 O.D600nm이 0.5가 나오도록 맞춘 후 0.1% peptone 용액으로 희석한 다음 BCP plate count agar에 pouring 하여 초기 균수를 측정하였다. OD값을 맞춘 균체 100 mL를 well에 분주한 후 37°C, 5% CO2에서 2시간 배양한 뒤 PBS를 이용해 붙지 않은 균을 5번 세척해준다. Trypsin-EDTA 1 mL를 첨가하여 cellbacteria를 떼어낸 후 0.1% peptone 용액으로 희석한 다음 BCP plate count agar에 pouring하여 균수를 측정하였다.
결과 및 고찰
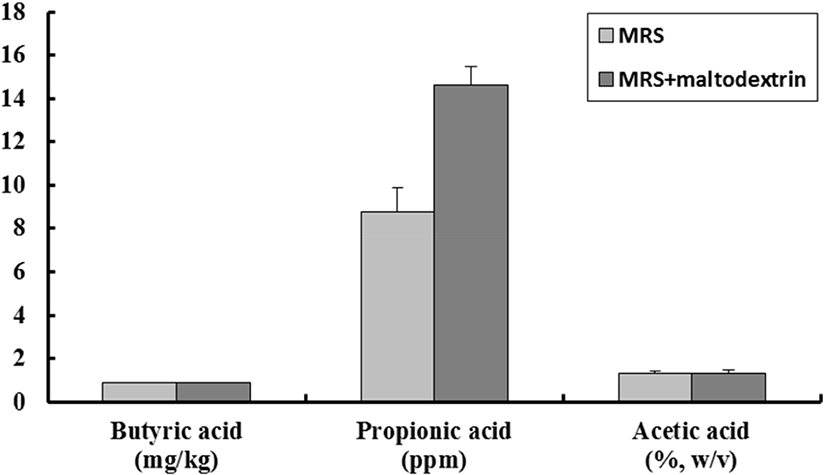
분리된 젖산균을 대상으로 α-amylase 억제활성과 α-glucosidase 억제활성을 측정한 결과, KI69 균주가 각각 91.17±2.23%와 98.71±4.23%로서 높은 억제 활성을 나타내었다(Table 3). 또한, 단쇄지방산은 각각 propionic acid 8.78±1.12 ppm, acetic acid 1.34±0.07%(w/v), butyric acid 0.876±0.003 g/kg을 나타내었으며, dextrin을 첨가한 MRS 배지에서는 propionic acid 14.62±0.85 ppm, acetic acid 1.31±0.14%(w/v), butyric acid 0.863±0.051 g/kg으로 나타났다(Fig. 1).
| Strain | α-Amylase inhibition (%) | α-Glucosidase inhibition (%) |
|---|---|---|
| KI69 | 91.17±2.23 | 98.71±4.23 |
선발된 KI69균주의 genus와 species를 결정하기 위하여 생리적, 생화학적 시험을 하였다. 선발된 KI69균주는 Gram 양성을 나타내었고, 현미경으로 관찰 시 rod 형태의 homo균이며, 산소 유무와 상관없이 잘 생장하였고, catalase와 운동성은 음성으로 나타났다. 45°C와 15°C에서는 생장하지 않 았으며, glucose와 arginine으로부터 각각 gas와 암모니아를 생성하지 않아 genus Lactobacillus에 속하였다(Table 4). Species를 정하기 위하여 API 50 CHL kit(BioMereux, France)를 이용하여 49종의 당 발효 시험을 실시한 결과(Table 5), KI69균주는 L-arabinose 등 23종으로부터 산을 생성하였다. 그 결과를 ATB identification system에 입력한 결과, Lactobacillus plantarum(ID 97.9%)으로 판명되었으며, 16S rRNA 유전자 부분을 universal primer를 이용한 PCR로 증폭하여 서열 분석하였다. 분석된 염기서열을 그대로 이용하여 BLAST search한 결과, L. plantarum(I.D. 99%)으로 동정되었고, L. plantarum KI69로 명명하였다.
치료 목적으로 섭취된 항생제나 식품에 존재하는 항생물질에 의해서 probiotics 균주가 사멸될 경우에 생체 내에서의 기능성이 낮아지게 되는데, 이러한 측면에서 항생제에 대한 내성은 매우 중요한 요소로 인식되고 있는 실정이다[21]. 따라서 시중에서 이용되고 있는 총 16가지의 항생제에 대해 L. plantarum KI69 균주가 내성이 있는지를 Table 6에 나타내었다. 그 결과, vancomycin에 대한 항생제 내성의 MIC 농도가 4,096 μg/mL 이상으로서 가장 내성이 높은 반면, penicillin-G와 rifampicin에 대한 MIC 농도는 0.125 μg/mL로서 가장 감수성이 높은 것으로 나타났다. Mathur & Singh[22]에 따르면 균주의 항생제 내성은 균주마다 다양하게 나타난다고 보고하였다.
효소활성 또한 probiotics로 이용하기 전에 고려되어야 하는 주요 요소 중 하나이다. Probiotics는 우선 β-glucuronidase를 생성하지 않아야 하는데, 이는 Benzopyrene을 발암성 물질로 전환시키는 발암효소이기 때문이다[23]. 반면, β-galactosidase와 같은 효소는 유당을 분해하여 유당을 소화시켜주는 잇점을 가지고 있다[24]. L. plantarum KI69의 효소활성 결과는 Table 7에서 보는 바와 같다. β-Galactosidase는 5을 나타내어 유당불내증 해소에 도움이 될 것이라고 보여지며, β-glucosidase와 N-acetyl-β-glucosaminidase 역시 효소활성이 5를 나타내었다. 반면, 발암효소인 β-glucuronidase는 효소활성이 0으로 나타나, 안전성이 있는 것으로 나타났다.
A value ranging from 0 to 2 is assigned to the standard color: zero represents a negative; 5 represents a reaction of maximum intensity. Values 1 through 4 represent intermediate reactions depending on the level of intensity. The approximate activity may be estimated from the color strength: 1 corresponds to the liberation of 5 nanomoles, 2 to 10 nanomoles, 3 to 20 nanomoles, 4 to 30 nanomoles, and 5 to 40 nanomoles or more.
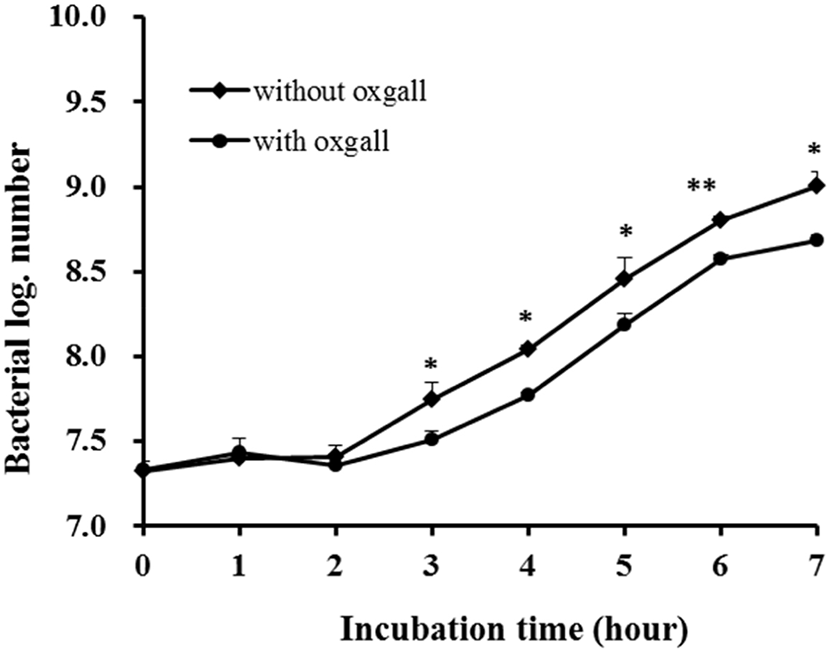
담즙 내성은 소장에서 살아남기 위해 꼭 지녀야 하는 특징 중 하나이다. 답즙산은 십이지장에서 분비되는 물질로 세균의 세포막을 파괴하여 성장을 억제하기 때문에 probiotics로의 기능을 하기 위해서는 담즙에 대한 내성을 지니고 있어야 한다[19, 25]. 또한, 적어도 0.3% 농도의 담즙산에서 생존해야지만, 인간의 위 장간에서도 생존할 수 있다고 보고 있다[26]. L. plantarum KI69균주의 담즙 내성 결과는 Fig. 2에서 보는 바와 같이 7시간 동안 배양 후 생균수를 비교해 보았을 때, 0.3% oxgall을 첨가하지 않았을 때의 생균수는 9.01 log CFU/mL, 0.3% oxgall을 첨가하였을 때의 생균수는 8.68 log CFU/mL로서 생존율은 96.42%로 나타났다.
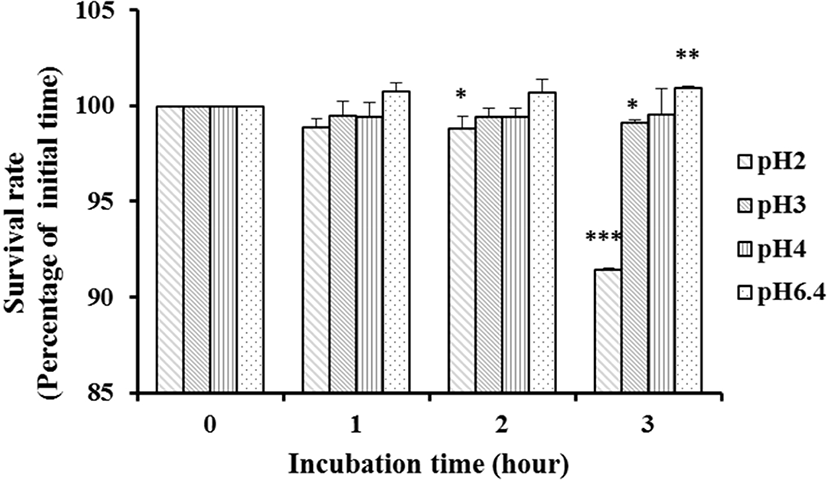
좋은 probiotics가 되기 위해서는 적어도 pH 3보다 낮은 pH에서 생존하여 위 장관을 통과하고, 소장 내로 도달하여야만 한다[27, 28]. 위액의 pH는 pH 0.9이지만, 음식을 섭취하였을 경우 위의 pH는 pH 3까지 올라가기 때문이다[29]. 산에 대한 L. plantarum KI69의 내성 결과는 Fig. 3에서 보는 바와 같다. 대조구인 pH 6.4에서의 균수와 비교한 결과, L. plantarum KI69균주는 pH 3과 pH 4에서 생존율 감소를 보이지 않았고, pH 2에서 2시간까지는 생존율이 100%이던 것이 3시간 이후에도 91.45%로 약간 감소하였다. Pennacchia et al.[30]의 실험에서 젖산균을 pH 2.5의 PBS 에 3시간 동안 37°C에서 배양한 결과, 60%–80%의 생존율을 보인 결과와 비교해 보았을 때, L. plantarum KI69균주는 내산성 실험에서 우수한 결과를 보였다.
L. plantarum KI69이 식중독균에 대해 어느 정도 억제하는지를 측정하기 위해 혼합배양을 실시한 결과는 Table 8과 같다. L. plantarum KI69는Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes, Staphyloccous aureus에 대해 각각 15.44%, 50.79%, 58.62%, 37.85%로서 Listeria monocytogenes에 대해 가장 억제 효과가 있는 것으로 나타났다. 배양 후 pH의 변화를 보았을 때, 대조구인 식중독균은 pH 5.24–6.24이며, 혼합배양액은 pH 5.03–5.64로서 pH가 약간 감소하였지만 pH의 저하가 식중독균의 억제에 큰 영향은 미치지 않은 것으로 보인다. 균주의 항균력은 같은 종의 균주라 하더라도 병원균에 따라 각기 다른 정도를 보인다[31, 32]. Daeschel[33]과 Havinaar et al.[34]은 pH 강하, 산화 환원 전위의 감소, 유해균과의 경쟁적 영양성분 소비, 과산화수소의 생성, 젖산균이 생산하는 유기산과 박테리오신의 살균작용과 강한 항균활성물질 분비에 의해 젖산균의 항균효과가 나타낸다고 보고하였다. 본 실험에서 L. plantarum KI69에 의한 Escherichia coli 와 Salmonella Typhimurium, Listeria monocytogenes, Staphyloccous aureus의 생육 억제는 이러한 억제 요소들의 작용에 기인하는 것으로 사료된다.
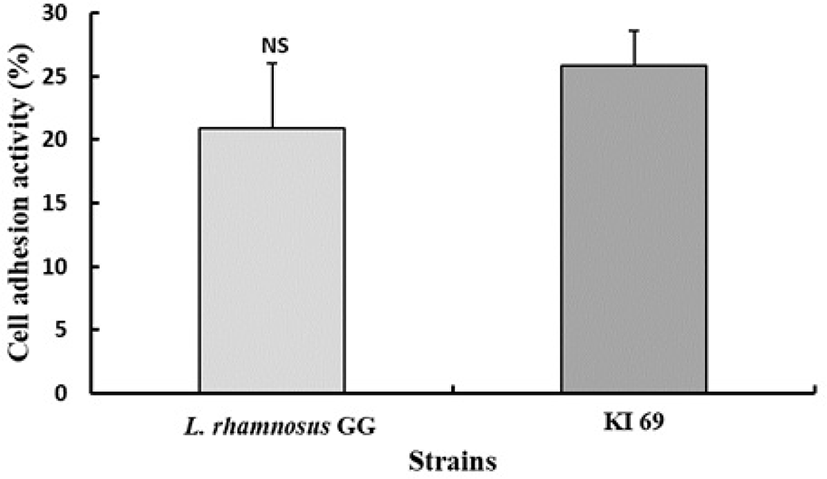
숙주의 장 상피세포 부착능은 프로바이오틱 균주 선발의 주요 기준 중 하나이다. 프로바이오틱스의 점막 부착시간 연장은 위장 면역계와 숙주의 균총에 영향을 끼칠 수 있다. 따라서 장 표면의 부착능은 프로바이오틱 균주의 효율성과 일치하는 것으로 사료된다[35]. Fig. 4에서 보는 바와 같이 L. plantarum KI69는 25.85%가 HT-29 cell에 부착된 반면 양성 대조구로 사용된 L. rhamnosus GG 균주는 20.87%가 부착되었다. 많은 일련의 연구에서 L. rhamnosus GG는 상피세포에 부착능력이 우수한 것으로 알려지고 있다[36]. 따라서 L. plantarum KI69 균주는 상피세포 표면에 부착능이 우수한 것으로 나타났다.
요 약
본 연구는 김치로부터 비만 억제능력이 있는 젖산균을 분리 및 동정하고, 이 균주의 생리적 특성을 규명하여 상업적으로의 이용가능성을 검토하고자 실시하였다. 이를 위해 Modified MRS 분별배지를 사용하여 노란색 집락을 형성하는 균주를 대상으로 각각 α-amylase inhibitory activity, α-glucosidase inhibitory activity와 단쇄지방산 생산이 우수한 균주를 선발한 결과, KI69 균주가 최종 선발되었다. KI69 균주는 α-amylase억제활성 91.17±2.23%, α-glucosidase 억제활성 98.71±4.23%, 단쇄지방산인 프로피온산, 에세트산, 브티르산이 MRS broth에서 각각 8.78±1.12 ppm, 1.34±0.07%(w/v), 0.876±0.003 g/kg이 나타났으며, 동정결과 L. plantarum으로 판명되었고, L. plantarum KI69로 명명하였다. L. plantarum KI69는 답즙산과 산성의 pH에서 모두 우수한 생존력을 나타내었고, 효소활성은 β-galactosidase, β-glucosidase와 N-acetyl-β-glucosaminidase에 대해 높은 효소 활성을 나타내었다. 항생제 내성 실험 결과 vancomycin에 내성이 있는 반면 penicillin-G와rifampicin에 감수성을 나타냈으며, Escherichia coli, Salmonella Typhimurium, Listeria monocytogenes와 Staphyloccous aureus에 대해 각각 15.44%, 50.79%, 58.62%와 37.85%의 억제 효과를 지니고 있는 것으로 나타났다. 장 부착성은 대조구인 L. rhamnosus GG보다 우수하였다.
