ARTICLE
동결건조한 Lactobacillus fermentum SK152 균주의 생존율에 미치는 동결보호제의 효과
김상훈
1
, 계하은
1
, 오주경
1
, 황인찬
1
, 강대경
1,*
Protective Effect of Cryoprotectants on the Viability of Freeze-Dried Lactobacillus fermentum SK152
Sang Hoon Kim
1
, Haeun Gye
1
, Ju Kyoung Oh
1
, In-Chan Hwang
1
, Dae-Kyung Kang
1,*
1Dept. of Animal Resource Science, Dankook University, Cheonan, Korea
*Corresponding author : Dae-Kyung Kang, Dept. of Animal Resource Science, Dankook University, Cheonan, Korea, Tel : +82-41-550-3655, Fax : +82-41-550-6220, E-mail :
dkkang@dankook.ac.kr
© Copyright 2019, Korean Society of Milk Science and Biotechnology. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Sep 27, 2019 ; Revised: Sep 30, 2019 ; Accepted: Sep 30, 2019
Published Online: Sep 30, 2019
Abstract
This study was conducted to investigate the effect of cryoprotectants on the storage stability of Lactobacillus fermentum SK152, which was isolated as a probiotic candidate. Solutions of 10% glucose, trehalose, dextrin, and skim milk powder were used as cryoprotectants. The survival rates of L. fermentum SK152 after freeze-drying were 5.6% (dextrin), 2.2% (skim milk powder), 1.7% (glucose), and 1.5% (trehalose), suggesting that dextrin was most effective at minimizing the cell death of L. fermentum SK152 by lyophilization. The survival rates of L. fermentum SK152 stored at 4°C ranged from 37% (dextrin)–90% (skim milk powder) after 8 weeks, while those at 20°C ranged from 4% (dextrin)–12% (skim milk powder) after 7 weeks, indicating that skim milk powder was the best at minimizing the cell death of L. fermentum SK152 during storage, irrespective of storage temperature, among the cryoprotectants used.
Keywords: lactic acid bacteria; Lactobacillus fermentum; freezing-drying; cryoprotectant
서 론
유산균은 사람이나 동물이 적정량을 섭취하였을 때 건강에 도움을 주는 것으로 알려져 있다[1]. 그 중에서도 락토바실러스 속의 일부 유산균은 장관에 도달하여 유해균 증식을 억제하고 장내균총을 조절하는 역할을 하기도 한다[2,3]. 뿐만 아니라, 혈중 콜레스테롤 저하, 숙주의 면역 조절, 영양소 공급 등 다양한 방법으로 사람과 동물의 건강에 기여하는 것으로 알려져 있다[4,5]. 이와 같이 프로바이오틱 특성을 가진 유산균을 그 자체로 또는 발효유제품 등과 같이 다양한 형태로 섭취하게 된다. 일반적으로, 바실러스와 같은 포자 형성균에 비해 유산균의 저장 안정성이 상대적으로 낮은 단점을 가지고 있기 때문에[6], 유산균의 저장안정성을 높이는 것은 식품산업, 의약산업 및 동물약품산업 등 산업적 응용을 위해 매우 중요한 기술이다. 유산균의 저장 안정성을 향상시키기 위한 연구는 오래전부터 진행되어 왔으며, 그 중에서 동결건조 및 적절한 동결보호제의 첨가가 유산균의 저장안정성을 증가시키는 여러 수단 중의 하나로 제시되고 있다[7]. 동결건조를 통해 세균 내부의 수분을 제거하게 되면 세포막과 단백질의 기능 및 구조에 비가역적 변화를 일으키기 된다[8]. 따라서 탈수과정 동안의 생존률을 향상시키기 위해 탄수화물, 단백질, 폴리머 등과 같이 다양한 보호제를 첨가하게 되는데, 이러한 물질들은 세포막을 안정화시켜 줄 뿐만 아니라, 수분과 결합하여 세포의 결정화를 억제시킴으로써 저장안정성을 높여주기도 하지만[9], 그 효과는 균주의 종류 및 처리방법에 따라 다를 수 있는 것으로 알려져 있다[10]. 김치에서 분리한 L. fermentum SK152는 병원성 세균에 대한 항균력을 가지고 있을 뿐만 아니라, 다양한 스트레스에 대한 저항성 유전자를 보유하고 있기 때문에[11], 산업적 응용가치가 높다고 할 수 있다. 따라서, 본 연구에서는 동결보호제의 첨가가 L. fermentum SK152의 동결건조 과정 및 저장기간 동안에 생존률에 미치는 영향을 조사하고자 하였다.
재료 및 방법
1. 시약
Skim milk powder(BD, USA), glucose(Duksan, Korea), trehalose(대정화금, Korea), dextrin hydrate(대정화금, Korea) 등을 동결보호제 실험에 사용하였다. 유산균의 배양을 위해 Lactobacilli MRS broth(BD, USA)와 BactoTM Agar(BD, USA)를 사용하였다.
2. 사용균주 및 배양조건
김치에서 분리한 Lactobacillus fermentum SK152(NCBI Accession No.: PRJNA318540)를 37°C에서 3회 계대배양한 후에 본 실험에 사용하였다. 이후 활성이 유지된 균주를 MRS 액체배지에 0.1%(v/v) 접종하고 24시간 동안 배양하였으며, 5,000 g, 4°C에서 10분 동안 원심분리하여 균체를 회수하였다. 회수된 균체를 0.85%(w/v) 생리식염수에 현탁하여 세척한 후에 실험에 사용하였다.
3. 동결건조
원심분리하여 회수한 SK152 균체를 skimmed milk powder, sucrose, trehalose, dextrin hydrate 10%(w/v) 용액에 각각 첨가하고 골고루 현탁하였다. —60°C에서 24시간 동안 동결한 후에 동결건조기(EYELA Co., Japan)를 사용하여 0.05 torr 조건에서 48시간 동안 건조하였다. 동결건조한 후에 시료를 골고루 분쇄하여 분말화하였으며, 저온(4°C) 및 상온(20°C)에 보관하면서 저장기간에 따른 생존률(%)을 측정하였다.
4. 생균수 측정
시료를 0.85%(w/v) 생리식염수에 현탁한 후에, 십진희석법을 사용하여 희석한 시료를 MRS 고체배지에 도말하였으며, 37°C에서 24–48시간 배양한 후에 형성된 colony 수를 측정하여 CFU(colony forming unit)로 표시하였다. 시료의 동결 전/후의 생존률은 다음과 같이 계산하였다[10].
결과 및 고찰
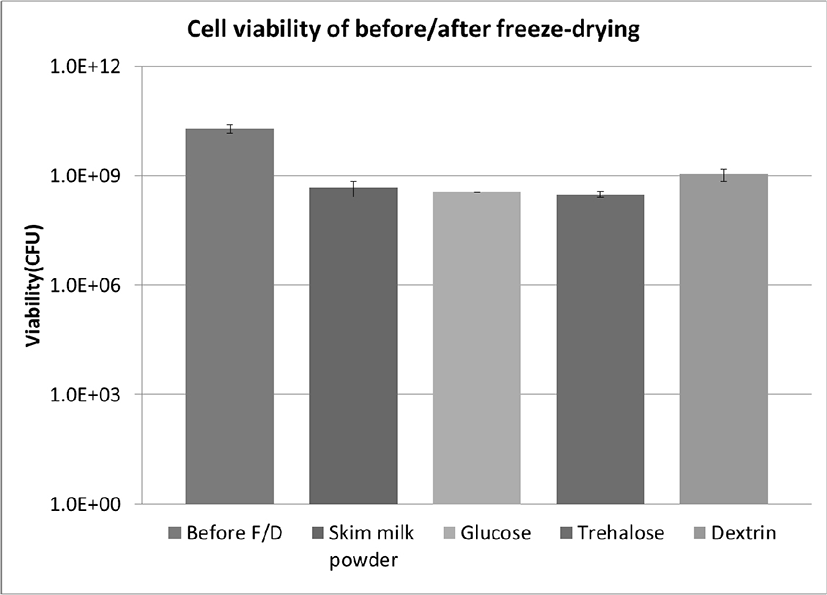
1. 동결건조 전후의 생균수 변화
L. fermentum SK152의 동결건조에 의한 생균수 감소에 동결보호제가 미치는 영향을 조사하기 위해 단당류(glucose), 이당류(trehalose), 다당류(dextrin hydrate) 및 skim milk powder 10% 용액과 SK152 균체를 각각 현탁한 후에 동결건조하였다. 동결건조한 후의 생존률을 비교한 결과, 각각 5.6%(dextrin), 2.2%(skim milk powder), 1.7%(glucose), 1.5%(trehalose) 로서, dextrin을 첨가한 경우의 생존률이 가장 높게 나타났다(Table 1, Fig. 1). Kang 등[10]에 의하면, L. fermentum MG901 균주를 동결건조할 경우의 생존률은 22%이었으며, skim milk powder 첨가에 의해 생존률 이 2배 이상 증가하였다. Lactobacillus salivarius W13의 경우, 동결보호제의 유무 및 종류에 따른 생존률이 0.01%에서 59.5%에 이르기까지 매우 큰 차이를 나타내었으며, skim milk powder와 sucrose 및 sodium glutamate의 조합이 가장 높은 생존률을 나타내었다[12]. Semyonov 등[13]은 Lactobacillus paracasei를 동결건조할 경우에 trehalose 농도와 maltodextrin 분자량이 생존률을 높히는데 중요하다고 보고하였다. 한편, Rathnayaka[14]는 Lactobacillus 속 유산균을 동결건조할 때 trehalose와 sucrose의 첨가가 효과적이었으나, 서로 간에 유의적인 차이가 없었다고 보고한 바 있다. 이 외에도, skim milk powder와 sucrose가 유산균의 세포막을 안정화시킴으로써 세포손상을 방지할 수 있다고 보고된 바 있으며[15], trehalose가 유산균의 동결건조에 효과적인 보호제로 보고된 바 있다[16,17]. 이상과 같이 기존의 연구사례에 비추어볼 때, 같은 Lactobacillus 속이나 종에 속하더라도 strain에 따라 저장안정성에 미치는 동결보호제의 효과가 서로 다를 수 있을 것으로 추정되었다.
Table 1.
Effects of cryoprotectants on the cell viability of freeze-dried L. fermentum SK152
|
|
Before F/D (CFU) |
After F/D (CFU) |
Survival rate (%) |
|
Dextrin |
2.0×1010
|
1.1×109
|
5.6 |
|
Skim milk |
2.0×1010
|
4.7×108
|
2.2 |
|
Glucose |
2.0×1010
|
3.5×108
|
1.7 |
|
Trehalose |
2.0×1010
|
3.0×108
|
1.5 |
Download Excel Table
Fig. 1.
Cell viability of L. fermentum SK152 after freeze-drying. F/D, freeze-drying; CFU, colony-forming unit.
Download Original Figure
2. 저장온도별 생존률의 변화
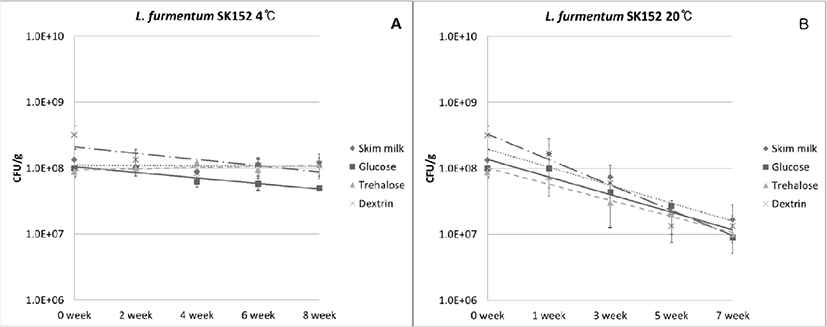
동결건조한 L. fermentum SK152를 냉장(4°C) 및 상온(20°C)에 7–8주간 저장하면서 동결보호제의 종류에 따른 생존률을 조사하였다. 4°C 보관 시, 동결보호제의 종류에 상관없이 저장기간이 길어져도 생존률이 서서히 감소하는 경향을 나타내었다. 저장 8주 후의 생존률은 37%(dextrin)–90%(skim milk powder)에 이르렀으며, skim milk powder 첨가시에 가장 높은 생존률을 나타내었다(Table 2, Fig. 2). 한편, 20°C 보관 시에는 동결보호제의 종류에 상관없이 저장기간에 길어질수록 4°C에 비하여 생존률이 급격히 감소하는 경향을 나타내었다. 저장 7주 후의 생존률은 4%(dextrin)–12%(skim milk powder)에 이르렀으며, 이중 가장 높은 생존률을 나타낸 동결보호제는 skim milk powder이었다(Table 3, Fig. 2).
Table 2.
Effects of cryoprotectants on the cell viability (CFU/g) of freeze-dried L. fermentum SK152 during storage at 4°C
|
Week |
0 |
2 |
4 |
6 |
8 |
Survival rate after 8 weeks (%) |
|
Skim milk |
1.3×108
|
1.0×108
|
8.7×107
|
1.1×108
|
1.2×108
|
90.0 |
|
Trehalose |
8.7×107
|
1.0×108
|
1.2×108
|
9.3×107
|
1.1×108
|
84.6 |
|
Glucose |
1.0×108
|
1.0×108
|
6.2×107
|
5.8×107
|
5.0×107
|
50.0 |
|
Dextrin |
3.2×108
|
1.3×108
|
8.3×107
|
1.1×108
|
1.1×108
|
37.0 |
Download Excel Table
Fig. 2.
Changes in the cell viability of freeze-dried L. fermentum SK152 during storage at 4°C (A) and 20°C (B), respectively.
Download Original Figure
Table 3.
Effects of cryoprotectants on the cell viability (CFU/g) of freeze-dried L. fermentum SK152 during storage at 20°C
|
week |
0 |
1 |
3 |
5 |
7 |
Survival rate after 7 weeks (%) |
|
Skim milk |
1.3×108
|
1.7×108
|
7.3×107
|
2.0×107
|
1.7×107
|
12.5 |
|
Trehalose |
8.7×107
|
7.3×107
|
3.0×107
|
2.0×107
|
1.0×107
|
11.5 |
|
Glucose |
1.0×108
|
1.0×108
|
4.3×107
|
2.7×107
|
9.0×106
|
9.0 |
|
Dextrin |
3.2×108
|
1.7×108
|
6.0×107
|
1.3×107
|
1.3×107
|
4.2 |
Download Excel Table
Kang 등[10]에 의하면, skim milk powder를 첨가하고 동결건조한 L. fermentum MG901을 40°C에서 4주간 보관하였을 경우의 생존률은 1.1%에 불과하였으나, 호박분말 첨가에 의해 5.1% 수준으로 증가하였다. 한편, L. acidophilus ATCC 4962를 동결건조하여 5°C 또는 28°C에 저장하였을 때에는 생균수 감소가 미미하였으나, 40°C에 저장하였을 경우에는 8주 후 생존률이 1% 이하까지 감소하였다[18]. Reddy 등[19]은 세 종류의 유산균을 동결건조한 후에 저장안정성을 비교하였는데, 균주에 따라 차이는 있었지만 maltodextrin이 생존률을 높이는데 가장 효과적이었다고 하였다. Lactobacillus salivarius subsp. salivarius UCC 500의 경우, 동결건조하여 —85°C에서 49일간 보관했을 때의 생존률은 trehalose 34%, skim milk powder 22.4%, sucrose 13%로서, trehalose가 가장 우수하였다[20]. Lactobacillus rhamnosus 및 Lactobacillus casei 균주는 skim milk powder와 trehalose를 첨가하였을 때에 가장 우수한 안정성을 나타내었다[21]. 이외에, 상업적으로 널리 사용되는 Lactobacillus rhamnosus GG 균주의 경우에는 이당류 중에서 trehalose가 저장안정성 유지에 가장 우수한 결과를 나타내었다[22].
동결건조에 의한 생균수 감소는 동결과정에서의 ice crystal의 형성에 의해 세포막 및 세포벽, DNA가 손상될 뿐만 아니라, 세포막 지질성분의 산화, 고분자물질의 변성 등에 기인한 것이라고 알려지고 있으며[23,24], 동결건조에 대한 저항성과 저장기간 동안의 생존률은 세포막 지방산의 조성과 밀접한 관계가 있다고 하였다[25].
이상과 같이 이전의 연구사례에 비추어 볼 때, Latobacillus 속의 저장안정성에는 대체적으로 skim milk powder와 trehalose가 우수한 경향을 나타내었으며, 본 연구결과에서도 유사한 결과를 나타내었다. 그러나, 동결건조 후의 생존률은 균주 특이적인데다가 동결보호제의 종류에 따라 달라지기 때문에[11,18,26], 사용하는 균주에 따라 최적의 동결건조 조건 및 동결보호제를 선택하는 것이 바람직할 것으로 사료되었다.
요 약
L. fermentum SK152의 동결건조에 의한 생균수 감소에 동결보호제가 미치는 영향을 조사하기 위해, 균체를 dextrin, skim milk powder, glucose, trehalose 10% 용액에 각각 현탁한 후에 동결건조하였다. 동결건조 후의 생존율은 각각 5.6%(dextrin), 2.2%(skim milk powder), 1.7%(glucose), 1.5%(trehalose)로서, dextrin을 첨가한 경우에 생존률이 가장 높게 나타났다. 동결건조한 L. fermentum SK152를 냉장(4°C) 및 상온(20°C)에 7–8주간 저장하면서 동결보호제의 종류에 따른 생존률을 조사한 결과, 4°C 보관 시에는 동결보호제의 종류에 상관없이 저장기간이 길어져도 생존률이 서서히 감소하는 경향을 나타내었다. 저장 8주 후의 생존률은 37%(dextrin)–90%(skim milk powder)에 이르렀으며, skim milk powder 첨가시에 가장 높은 생존률을 나타내었다. 한편, 20°C 보관 시에는 동결보호제의 종류에 상관없이 저장기간에 길어질수록 4°C에 비하여 생존률이 급격히 감소하는 경향을 나타내었다. 저장 7주 후의 생존률은 4%(dextrin)–12%(skim milk powder)에 이르렀으며, 이중 가장 높은 생존률을 나타낸 동결보호제는 skim milk powder이었다.
감사의 글
본 결과물은 농림축산식품부의 재원으로 농림수산식품기술기획평가원의 미생물유전체전략연구사업의 지원을 받아 연구되었음(No. 918001-04-2-WT011).
References
Jung MY, Park YH, Kim HS, Poo H, Chang YH. Probiotic property of
Lactobacillus pentosus Miny-148 isolated from human feces. Korean J Microbiol. 2009;45:177-184.

Seo YE, Yoon YH, Kim SJ. Functionality and safety of probiotics. J Milk Sci Biotechnol. 2019;37:94-101. .


Seo JG, Lee GS, Kim JE, Chung MJ. Development of probiotic products and challenges. Korean Soc Biotechnol Bioeng J. 2010;25:303-310.

Picot A, Lacroix C. Encapsulation of bifidobacteria in whey protein-based microcapsules and survival in simulated gastrointestinal conditions and in yoghurt. Int Dairy J. 2004;14:505-515. .


Chacon M, Molpeceres J, Berges L, Guzman M, Aberturas MR. Stability and freeze-drying of cyclosporine loaded poly (D,L lactide-glycolide) carriers. Eur J Pharm Sci. 1999;8:99-107. .


Kang CH, Kim YG, Han SH, Kim JS, Jeong Y, Paek NS. Effect of pumpkin powder as cryoprotectant to improve the viability of freeze dried lactic acid bacteria. Korean Soc Biotechnol Bioeng J. 2017;32:251-255. .


Yoo DA, Bagon BB, Valeriano VDV, Oh JK, Kim H, Cho SA, et al. Complete genome analysis of
Lactobacillus fermentum SK152 from kimchi reveals genes associated with its antimicrobial activity. FEMS Microbiol Lett. 2017;364:fnx185. .


Yeo S, Shin HS, Lee HW, Hong D, Park H, Holzapfel W, et al. Determination of optimized growth medium and cryoprotective additives to enhance the growth and survival of
Lactobacillus salivarius. J Microbiol Biotechnol. 2018;28:718-731. .



Semyonov D, Ramon O, Kaplun Z, Levin-Brener L, Gurevich N. Shimoni E. Microencapsulation of
Lactobacillus paracasei by spray freeze drying. Food Res Int. 2010;43:193-202. .


Rathnayaka RMUSK. Effect of freeze-drying on viability and probiotic properties of a mixture of probiotic bacteria. ARPN J Sci Technol. 2013;3:1074-1078.

Saarela M, Virkajarvi I, Alakomi HL, Sigvart-Mattila P, Matto J. Stability and functionality of freeze-dried probiotic
Bifidobacterium cells during storage in juice and milk. Int Dairy J. 2006;16:1477-1482. .


Conrad PB, Miller DP, Cielenski PR, de Pablo JJ. Stabilization and preservation of
Lactobacillus acidophilus in saccharide matrices. Cryobiology. 2000;41:17-24. .



Pyar H, Peh KK. Enteric coating of granules containing the probiotic
Lactobacillus acidophilus. Acta Pharm. 2014;64:247-256. .



Reddy KBPK, Awasthi SP, Madhu AN, Prapulla SG. Role of cryoprotectants on the viability and functional properties of probiotic lactic acid bacteria during freeze drying. Food Biotechnol. 2009;23:243-265. .


Zayed G, Roos YH. Influence of trehalose and moisture content on survival of
Lactobacillus salivarius subjected to freeze-drying and Storage. Process Biochem. 2004;39:1081-1086. .


Jofre A, Aymerich T, Garriga M. Impact of different cryoprotectants on the survival of freeze-dried
Lactobacillus rhamnosus and
Lactobacillus casei/paracasei during long-term storage. Benef Microbes. 2015;6:381-386. .



Miao S, Mills S, Stanton C, Fitzgerald GF, Roos Y, Ross RP. Effect of disaccharides on survival during storage of freeze dried probiotics. Dairy Sci Technol. 2008;88: 19-30. .


Castro HP, Teixeira PM, Kirby R. Evidence of membrane damage in
Lactobacillus bulgaricus following freeze drying. J Appl Microbiol. 1997;82:87-94. .


Thammavongs B, Corroler D, Panoff JM, Auffray Y, Boutibonnes P. Physiological response of
Enterococcus faecalis JH2‐2 to cold shock: growth at low temperatures and freezing/thawing challenge. Lett Appl Microbiol. 1996;23:398-402. .