서 론
우유는 인체의 성장과 유지에 필수적인 많은 영양분을 함유하고 있기에 영양가가 높은 식품으로 알려져 있다. 사람들이 섭취하는 음식과 그 음식들이 생산하는 물질에 의해서 사람들의 건강상태를 일반적으로 반영한다(Iqbal et al., 2015). 또한, 식품 규격의 시행으로 이용 가능한 식품의 양과 질에 직접적으로 영향을 준다. 따라서 개발도상국의 예를 들면, 특히 시골 지역의 소비자들은 현지 생산 식품에 의존하기 때문에 식품 안전과 관련된 문제에 직면하게 된다(Marroquín-Cardona et al., 2014; Iqbal et al., 2015). 이런 이유에서 우유와 유제품에 Aflatoxin M1 의 존재는 개발도상국에 있어서 매우 중요한 문제이다(Prandini et al., 2009). 왜냐하면 우유 및 유제품은 주요 영양성분인 단백질, 칼슘, 비타민을 공급하는 대표적인 식품인 동시에 섭취시 Aflatoxin에 노출되는 주요 원인 식품이 될 수도 있기 때문이다(Galvano et al., 1998; Ahmad et al., 2018). 특히, Aflatoxin M1은 성인보다 더 민감하게 반응하는 어린이와 유아에게 있어서 매우 중요한 문제이다(Iqbal et al., 2015). 따라서 본 총설의 목적은 우유 및 유제품과 관련된 Aflatoxin M1 중심으로 발생현황 등을 정리하고, Aflatoxin M1 를 신속하게 검출할 수 있는 새로운 검출방법 등을 소개하는데 있다. 또한 본 총설논문의 모든 자료들은 이미 발표된 다양한 문헌 등을 재정리하여 서술하였다.
Aflatoxin M1의 특징
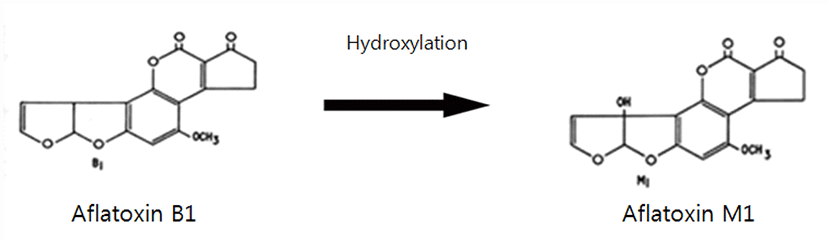
Aflatoxin M1은 Aspergillus flavus, Aspergillus parasiticus, 그리고 Aspergillus nomius가 포함된 Aspergillus 종에서 생산되는 mycotoxins의 주요한 종류이다(Creppy, 2002; Iqbal et al., 2015). Aflatoxin B1, Aflatoxin B2, Aflatoxin G1, Aflatoxin G2는 Aflatoxin의 주요 종류이다 (Sweeney and Dobson, 1998; Ahmad et al., 2018). 장기간의 가뭄, 고온, 기질 조성, 저장 기간 및 저장 조건과 같은 요인들은 곰팡이 발생과 AF 합성에 중요한 역할을 한다(Stack and Carlson, 2003). Aflatoxin B1은 Aflatoxin중에서 가장 독성이 강하고 발암성뿐만 아니고, 기형적으로 돌연변이를 유발하기에 IARC(International Agency for Research on Cancer, 국제암연구소)에 의해서 1급(Group 1) 발암물질로 분류되어져 있다(IARC, 2004; Iqbal et al., 2010; Iqbal et al., 2014)(Fig. 1). Aflatoxin 발견 직후, 오염된 사료를 섭취한 동물로부터 다른 동물 제품들뿐만 아니라, 우유에서도 잔류할 수 있다는 의견이 지속적으로 제기되었다(Van Egmond, 1993).
Aflatoxin M1의 독성
Aflatoxin M1은 Aflatoxin B1의 히드록신 대사물로, 인간과 수유 동물 모두의 유방샘에서 우유로 배출된다(Asi et al., 2012)(Fig. 2). Aflatoxin B1의 대략 0.3∼6.2%는 대사된 Aflatoxin M1으로 변환되어 우유로 배출된다(Fallah et al., 2009). 이것은 동물의 유전, 계절적 변화, 착유 과정 및 환경 조건과 같은 요인에 많은 영향을 받는다(Unusan, 2006). 국제암연구소(IARC)는 Aflatoxin B1을 1 그룹(group 1) 발암물질로 지정하였고, Aflatoxin M1은 Aflatoxin B1보다 독성은 낮으나 간독성 및 발암성을 나타내며, IARC에서는 Group 2B로 분류하고 있다(IARC, 2002; Park et al., 2012). 많은 국가에서 모든 연령 집단이 정기적으로 우유와 우유 제품을 섭취하기 때문에 우유와 유제품에 Aflatoxin M1의 잔류는 건강상 문제를 야기할 수 있다는 연구가 진행되었다(Fallah et al., 2009; 2010). 또한, Aflatoxin M1은 치즈, 요구르트 같은 다양한 낙농 유제품들을 오염시킬 수 있기에 결국 소비자들에게 건강에 대한 많은 관심을 불러 일으켰다(Iqbal et al., 2015; Ahmad et al., 2018).
가장 독성이 강한 아형으로서의 Aflatoxin B1은 독성 및 발생 측면을 고려하였을 때 가장 관심 있는 부분은 Aflatoxin M1의 대사물에 집중되었다(Van Egmond, 1993)(Fig. 2). Aflatoxin B1을 Aflatoxin M1으로 변환하는 것은 일반적으로 해독 과정으로 간주된다(Iqbal et al., 2015). 왜냐하면 Aflatoxin M1의 체내 발암성은 Aflatoxin B1의 약 10%에 불과하기 때문이다(Wogan and Paglialunga, 1974). 또한, 체외(in vitro) 대사 활성화를 이용하여, Aflatoxin M1은 Aflatoxin B1의 돌연변이 유발성의 10%만 가지고 있다. Aflatoxin B1과 Aflatoxin M1의 상대 발암성은 상대적 대사 활성화 속도와 상관관계가 있는 것이 쥐 간장 마이크로솜(rat hepatic microsomes)을 사용해 체외에서 관찰되었다(Neal and Colley, 1979). 그러나 새끼 오리와 쥐에 있어서 두 독소의 급성 독성은 양적으로나 질적으로 매우 유사하였다.
포유류에서 일반적으로 관찰되는 급성 Aflatoxin 중독의 증상은 무기력함, 식욕 부족, 거칠어지고 옅은 회색 머리, 운동실조(ataxia), 확대된 지방 간으로 나타난다(Iqbal et al., 2015). 한편, 만성 Aflatoxin 노출의 증상으로는 황달, 수유효율과 우유생산 감소, 식욕부진 등이 있다(Diekman and Green, 1992). Aflatoxin은 질병에 대한 내성을 낮추고 백신에 의한 면역성을 방해할 수 있다. 게다가, 700 μg/kg의 Aflatoxin를 함유한 체중 증가와 섭취는 소고기에 영향을 미친다. 그러나 간 무게 증가를 독성 기준으로 삼는다면, 100 μg/kg은 소고기에 독성이 있는 것으로 간주된다. 젖소의 건강과 생산성은 100 μg/kg이 넘는 식이요법 Aflatoxin 수준에서 영향을 받을 수 있으며, 이는 불법 우유 잔류물을 생산하는 양보다 훨씬 많다(Patterson and Anderson, 1982). Guthrie(1979) 는 농장 상황에서 젖소를 젖으로 기르는 경우, 120 μg/kg의 Aflatoxin를 함유한 식단을 섭취했을 때에는 생식 효율성이 떨어졌지만, 반대로 Aflatoxin에 오염되지 않은 사료를 이 젖소들이 먹었을 때에는 우유 생산량은 25% 증가하였다고 보고하였다. 우유 생산은 균에 의해 생산된 Aflatoxin를 섭취한 젖소에서 감소되었지만, 그러나 순수한 AF가 섭취되었다면, 그 생산은 눈에 띄게 영향을 받지 않았을 것이다(Applebaum et al., 1982).
우유 및 유제품에서 Aflatoxin M1의 안정성
Aflatoxin M1은 고온에서 매우 안정적이다. 여러 연구에서 우유에서 유제품으로의 Aflatoxin M1의 분포 및 안정성을 조사하였다. Oruc 등(2006)은 Aflatoxin M1이 60일 이상 카샤(Kashar) 치즈에서 안정적이고, 전통적으로 소금에 절인 흰색 치즈(white pickled cheese)에서도 90일 이상 안정적이라는 것을 발견하였다. 그들의 결과는 치즈 저장과 숙성 동안 독소가 안정적이라는 것을 보여주었다. 또 다른 연구에서, Goveraris 등(2002)은 4℃에서 4주 동안 그리고 pH 값이 4.0과 4.6에서 보관하는 동안 0.050 μg/L과 0.100 μg/L의 농도로 인위적으로 오염된 요구르트의 Aflatoxin M1의 안정성을 연구하였다. 그 결과, pH 4.6에서 Aflatoxin M1 수준은 유의하게 변하지 않았지만(p>0.01), 그러나 pH 4.0의 요구르트에서 Aflatoxin M1은 두 농도 모두에서 3주 및 4주 저장 후 상당히 감소하였다(p<0.01). 따라서, Aflatoxin M1의 이러한 감소는 낮은 pH에 의한 것으로 사료된다. 이와 유사한 연구에서 요구르트를 발효하는 동안 Aflatoxin M1 수준은 우유에 존재하는 초기 수준보다 유의하게 감소하였다(p<0.01). 이러한 Aflatoxin M1 수준의 감소는 낮은 pH, 유기산 또는 다른 발효 부산물의 형성, 그리고 심지어 Lactobacillus spp.의 존재와 같은 다양한 요인들에 영향을 받는다고 보고하였다(Govaris et al., 2002). Bakirci(2001) 는 요구르트 샘플에서 벌크 탱크 우유 샘플에 비해 13% 높은 Aflatoxin M1 수준을 발견하였지만, 그러나 Aflatoxin M1 수준의 차이는 통계적으로 유의하지 않았다. Cattano 등(2013) 은 다양한 기술로 처리된 유청과 단백제거 유청에서 Aflatoxin M1를 오염시킨 후 안정성을 조사하였다. 리코타(Ricotta) 치즈를 생산하는 동안, 대부분의 Aflatoxin M1(평균 94%)는 유청으로 그리고 단지 6%만이 커드에 남아 있었다. 그리고 나서 한외여과 그 후, 리코타(Ricotta) 치즈 생산에서 폐기된 유청 또는 단백질제거 유청에 남아있는 독소의 90% 이상을 한외여과와 diafiltration의 사용하여 제거할 수 있었다. 분무건조는 유청의 Aflatoxin M1 오염을 줄이는 데 효과적이었다. 유청에서는 독소 보유량이 약 60%이었지만, 단백질제거 유청에서는 Aflatoxin M1 보유량은 약 39%이었다(Iqbal et al., 2015).
우유와 액체유제품의 가공중, 일반적으로 135∼150℃ 범위의 초고처리(UHT)를 사용하여 우유 및 액체유제품의 상업적으로 멸균된다(FAO and WHO, 2009). Purchase(1967) 그리고 Kabak (2012) 은 열처리 중 Aflatoxin M1에서 최대 32%의 감소를 나타냈다고 보고하였지만, 반면 Galvano 등(1996)은 Aflatoxin M1이 열 안정적이라는 보고하였다. 우유를 가열하는데 사용되는 조건에 따라 우유에 포함된 Aflatoxin M1 함량이 대략 12∼35% 정도 감소한다고 보고하였다. 그러나 일반적으로 Aflatoxin은 열처리시 안정적이다(Prandini et al., 2009). 우유나 유제품의 Aflatoxin M1 수준을 낮추려는 다양한 연구가 진행되었다. Carraro 등(2014)은 우유의 Aflatoxin M1 오염을 제거하거나 감소시키기 위해서 점토을 사용하였다. 이 연구에서 벤토나이트(bentonites, 화산재의 풍화로 된 점토의 일종)가 매우 효율적인 것으로 나타났다. 즉, 오염된 우유(대략 80 ng/L 이상)는 안전한 수준(대략 50 ng/L for adults 그리고 25 ng/L for lactants)으로 정제되었으며, 단지 우유의 영양적인 성질이 약간 변화되었을 뿐이었다. Elsanhoty 등(2014)은 Aflatoxin M1 수치를 줄이기 위해 요구르트에 다양한 종류의 유산균를 이용하였다. 50%의 요구르트 배양균(Streptococus thermophilus and Lactobacillus bulgaricus)과 50% Lactobaillus plantrium에 의해 발효된 요구르트는 저장 기간이 끝날 때 Aflatoxin M1 함량이 가장 많이 감소되었다. 또 다른 연구에서, Serrano-Nino 등(2013)은 체외(in vitro) 소화 모델에서 우유의 Aflatoxin M1을 줄이기 위해서 5종의 probiotic 박테리아를 사용하였다. 평가된 5개의 균주들은 PBS에서 Aflatoxin 결합 비율은 19.95∼25.43%까지 다양하게 나타났다. 더 나아가 체외(in vitro) 소화 모델에서 Aflatoxin M1의 생물학적 접근성은 평가된 probiotic 균주에 따라 최소 23%에서 최대 45%까지 감소를 보였다.
그러므로 이러한 치명적인 독소를 완전히 파괴하기 위해서는 Aflatoxin M1의 해독에 관한 더 많은 연구가 필요하다. 또한, 이러한 독소와 관련된 건강 위험을 최소화하기 위해서 대부분의 국가는 규정을 시행하고 있다(Iqbal et al., 2013).
다양한 나라의 우유 및 유제품에 있어서 Aflatoxin M1 발생현황
유럽의 우유 및 유제품에 있어서 Aflatoxin M1의 발생은 터키, 프랑스, 이탈리아, 스페인, 크로아티아 및 그리스에서 보고되었다(Tsakiris et al., 2013). Ardic 등(2009)은 흰색침지(white brined) 치즈에서 평균 0.284 μg/kg의 Aflatoxin M1 농도를 검출하였으며, 농도 범위는 0.052∼0.860 μg/kg이었다. 또, 다른 보고서에서 Tekinsen과 Eken(2008)은 100개의 우유와 132개의 치즈 샘플을 분석하여 우유와 치즈 샘플 중 각각 67%와 83%가 Aflatoxin M1에 오염되었다고 보고하였다. 우유와 치즈의 Aflatoxin M1 수준은 각각 0.010∼0.630 μg/L, 0.05∼0.690 μg/kg이었다. 터키의 Aflatoxin M1 수준 범위는 다른 나라들에 비해 상당히 높았으며, 그 다음으로는 크로아티아였다. 일반적으로 유럽의 우유 및 유제품에서 Aflatoxin M1의 수준과 발생률은 남아시아 국가보다 낮으며, 이는 공급 및 유제품의 이러한 mycotoxins에 대한 엄격한 규제의 결과일 수 있으며, 좋은 저장 습관을 채택한 결과일 수 있다(Iqbal et al., 2015). 따라서, 우유 및 유제품에서 Aflatoxin M1의 발생은 엄격한 규제를 적용하고 최첨단 분석 기법을 사용함으로써 최소화할 수 있다. 시간이 흐르면서, 지속적으로 개발되는 분석 기술들은 식품 분석에 있어서 많은 영향을 주게 된다.
Park 등(2012)은 한국에서 생산되는 우유 중 Aflatoxin M1 오염도 조사연구를 하였다. 원유 및 시유 중의 Aflatoxin M1에 대한 평균 검출농도는 각각 25.1 ng/kg과 29.8 ng/kg 수준을 보였다 (Park et al., 2012). 조사된 우유의 Aflatoxin M1 평균값은 2001 JECFA 보고서에 보고된 세계 지역별 평균값 - 극동아시아 360 ng/kg, 유럽 23 ng/kg, 남미 22 ng/kg, 중앙아시아 5 ng/kg, 아프리카 1.8 ng/kg - 보다 낮거나 유사한 수준이었으며, 특히 극동아시아지역과 비교하였을 때는 무려 12배 정도 낮은 수준이었다(JECFA, 2001; Park et al., 2012). 또한, 이것은 현행 식품공전에서 정한 허용기준치(Aflatoxin M1으로서 500 ng/kg) 보다 매우 낮은 안전한 수준을 보였다. 또한, Kang 등(2013)은 한국에서 생산되는 분유 중 Aflatoxin M1 분석 및 위해평가 연구를 보고하였다. 분유 중 Aflatoxin M1을 면역친화성칼럼을 이용하여 정제하고 HPLC로 분리하였으며, 형광검출기로 정량 분석하는 시험법을 확립한 후 총 439건의 분유 샘플에서 Aflatoxin M1을 분석하였다(Kang et al., 2013). Aflatoxin M1 검출농도의 평균은 2.6 ng/kg이었으며, Aflatoxin M1이 전혀 검출되지 않은 비율은 64%이었다. 오염도 자료를 근거하여 분유 중 Aflatoxin M1의 노출량 및 위해 수준을 분석하였는데, 연령별로 비교하였을 때 신생아에게서 가장 높게 나타났지만 초과간암발생률은 1년에 1,000,000 중 0.02명 정도로서 위해수준은 매우 낮은 것으로 평가되었다(Kang et al., 2013). 하지만 식품의 안전성 확보차원에서 Aflatoxin M1에 대한 오염도 조사는 지속적으로 수행되어져야 할 것이다.
인도네시아, 일본, 태국에서도 신선한 우유에 있어서 Aflatoxin M1 오염현황을 보고하였다. 중국에서는 우유 및 유제품에 있어서 Aflatoxin M1 오염현황을 보고하였는데, 우유에서는 0.04∼0.16 μg/L, 분유(powdered milk)에서는 0.16∼0.32 μg/L 및 유제품에서는 0.32∼0.5 μg/L의 Aflatoxin M1 수준을 보였다 (Pei et al., 2009). 마찬가지로, 태국의 Ruangwises와 Ruangwises(2009)가 보고한 바와 같이, Aflatoxin M1 수준은 LOD에서 0.114 μg/L까지 다양하였다. Xiong 등(2013)은 중국산 우유에 0.01∼0.42 μg/L의 범위를 보고하였다. 또한 태국의 우유에서 Aflatoxin M1 의 발생률은 다른 나라들에 비해 상당히 높은 것으로 보고되었다.
남아시아에서 우유에 존재하는 Aflatoxin M1에 관한 다양한 연구가 진행되었다. 대부분의 연구는 이란과 파키스탄에서 진행되었으며, 일부 연구에서는 우유에 매우 높은 평균 Aflatoxin M1 농도를 나타내기도 하였다(Ahmad et al., 2018). Fallah 등(2011)의 연구에 의하면, 우유 및 유제품의 Aflatoxin M1 오염을 측정하였는데, 우유에서는 0.323 μg/L, 치즈에서는 0.085 μg/kg, 요구르트에서는 0.016 μg/L, kashk에서는 0.044 μg/kg, doogh에서는 0.005 μg/L로 Aflatoxin M1의 평균 수준을 보였다. 마찬가지로, 파키스탄의 Sadia 등(2012)에 의하면 우유에서 AFM1 함량은 0.252 μg/L라고 보고하였다. 또한, 그들은 우유로부터 생산된 사탕(sweets)에 있어서 Aflatoxin M1의 평균 0.48 μg/kg의 농도로 존재한다는 것을 발견하였다. 인도의 Siddappa 등(2012)은 우유에 0.1∼3.8 μg/L의 평균 Aflatoxin M1 수준을 보고하였다. 또한 파키스탄의 Iqbal과 Asi(2013)의 연구에 의하면, 우유에서는 0.212 μg/L, 요구르트에서는 0.147 μg/L, 치즈에서는 0.189 μg/kg, 버터에서는 0.156 μg/kg의 평균 Aflatoxin M1 수준을 보고하였다. Aflatoxin M1의 수준은 우유와 다른 유제품에서 비교적 높았고, 소비자들에게는 심각한 건강 위험이 될 것이다(Ahmad et al., 2018). 반대로, 우유와 유제품의 Aflatoxin M1 수준이 낮은 보고서도 있다. 남아시아에서 수행된 여러 연구 중에서 Aflatoxin M1 수준의 광범위한 변화는 기후 및 지리적 차이뿐만 아니라, 공급 시스템, 농장 관리 시스템 및 분석 방법의 차이에 기인할 수 있기 때문이다(Asi et al., 2012). 특히 남아시아에서는 여름 동안 목초지, 풀, 잡초, 녹색 사료와 같은 신선한 동물 사료를 구할 수 있다. 하지만, 겨울 동안 신선한 녹색 사료가 부족하기 때문에 밀, 옥수수, 목화씨로 구성된 더 많은 농축된 사료가 사용된다(Ghiasian et al., 2007). 더 나아가서, 부적절한 보관 조건하에서 사일리지로 보존된 녹색의 사료와 건초는 Aspergillus 균의 영향을 받을 수 있으며, 결국 그 후 Aflatoxin이 생산될 수 있다(Tajkarimi et al., 2008)
시리아, 이집트, 레바논, 수단, 쿠웨이트, 모르코, 세르비아, 브라질의 우유와 유제품에 있어서 Aflatoxin M1에 대한 많은 연구가 진행되었다. AFM1에 오염된 우유 샘플 중 가장 높은 농도(2.07 μg/L)와 발생(42/44)은 수단에서 나타났다(Elzupir and Elussein, 2010). 총 42개의 샘플이 권장 한계인 0.05 μg/L를 초과하였다. 모로코에서는 Zinedine 등(2007)은 우유 샘플의 89%가 평균 0.0186 μg/L의 Aflatoxin M1로 오염되었으며, 3개의 샘플이 EU 권장 한계 이상임을 조사하였다. 마찬가지로, 브라질의 Oliveira와 Ferraz(2007)에 의하면 우유에 포함된 Aflatoxin M1의 높은 평균 수준은 0.062 μg/L이며, 그 범위는 0.011∼0.161 μg/L이었다. 평균 수준이 0.018∼0.250 μg/L는 이집트의 우유에서 보고되었다(Motawee et al., 2009). 자료들을 종합해 본 결과, 특히 수단과 같은 아프리카 국가들에서 우유 및 유제품의 Aflatoxin M1 발생률이 높다는 것을 보여주고 있다(Iqbal et al., 2015). 따라서 이 독소의 높은 발생률의 주요 원인으로는 인식 부족과 분석 시설의 한계성 때문일 것이다.
다양한 나라에서 생산되는 우유 및 유제품에 있어서 Aflatoxin M1 허용한계 및 규정
우유 및 유제품에 있어서 Aflatoxin M1 최대 한도에 대한 국제 규정은 0∼1.0 μg/kg이며, Table 1에 자세하게 정리되어있다. EU는 비유 중인 젖소의 사료에서는 20 μg/kg을 넘지 않아야 하며, 우유에서는 0.05 μg/kg 이하로 총 Aflatoxin 함량을 제한하고 있다(Iqbal et al., 2015). 실제로 규제 한계는 건조 물질 내 총 Aflatoxin 농도의 1.7%(0.8∼2.0%)에 해당하는 우유 내 Aflatoxin M1 농도로 정의된다. 왜냐하면 30 μg/kg의 AF를 함유한 식단을 섭취하는 소는 0.5 μg/kg 이상의 Aflatoxin 잔류물을 함유한 우유를 분비하기 때문이다(EFSA, 2004).
Resources: EC, 2006; FAO/WHO, 2009; Park et al., 2012; Chase et al., 2013; Iqbal et al., 2015.
미국 식품의약국은 인간 식품과 우유에 대해 각각 20 μg/kg과 0.5 μg/kg의 Aflatoxin 농도에 대한 조치 수준을 확립하였다(Chase et al., 2013). 식품 내 Aflatoxin에 대한 규제 한계는 0∼50 μg/kg이다(FAO/WHO, 2009). 미국 규정에 따르면 Aflatoxin M1 수준은 0.5 μg/kg을 초과하지 않아야 한다. 그러나 Codex Alimentarius는 영아 우유와 후속 우유(follow-on milk)의 경우, 50 ng/kg을 규제 한계로 설정하고, 0.025 μg/kg을 초과할 수는 없다고 규정하고 있다(EC, 2006). 마찬가지로 오스트리아와 스위스의 경우, 최대 수위는 영아용 식품의 경우 10 pg/mL에 불과하다. 지금까지 많은 연구에서 Aflatoxin M1이 우유와 유제품에 존재하고 있음을 보여주었다.
우유 및 유제품에서 Aflatoxin M1의 검출 방법
일반적으로, 우유와 유제품에서 Aflatoxin M1 추출은 아세토나이트릴, 메탄올 또는 아세톤과 같은 극성 유기 용매의 수용성 혼합물을 포함하고 있다(Iqbal et al., 2015). 클로로포름으로의 추출은 염소 처리된 용제의 소비를 줄이기 위한 노력으로, 보다 환경 친화적인 용제로 대체되거나 감소되었다 (Shephard, 2008). 대부분의 크로마토그래피 방법을 이용한 결과는 샘플 준비와 추출의 효율에 전적으로 영향을 받는다. 여기에는 추출물을 순수하게 정제하는 후속처리가 포함되기도 한다. 더 나아가서 신뢰할 수 있는 방법을 확립하기 위해서 샘플 추출물을 오염시킬 수 있는 다양한 간섭 화합물들의 존재를 반드시 제거해야만 한다 (Krska et al., 2005).
현재 일반적으로 사용되는 정화 방법으로는 칼럼 크로마토그래피, 고체상태추출(SPE) 칼럼, 액체-액체 추출, 면역친화성 칼럼(IAC), 그리고 원 스텝을 다기능적인 정화 칼럼(MycoSep)등이 있다(Iqbal et al., 2015). 이러한 다양한 방법들은 속도, 단순성 및 용제 효율과 같은 많은 이점을 제공하며, 또는 경우에 따라서 복구 및 비용 절감의 이점을 제공하기도 한다(Fuchs et al., 2002). 샘플 정제는 최소 10초에서 최대 30초면 가능하다. 이렇게 빠르고 효율적인 정제는 일반적으로 3∼4단계의 기존 고체상태추출(SPE) 또는 IAC 방법을 대체할 수 있는데, 그 이유는 두 단계 모두 칼럼의 사전 조건화, 칼럼의 포장 재료에 추출된 물질 유지, 바람직하지 않은 화합물 세척 및 분석을 원하는 물질의 용출이 필요하기 때문이다(Fuchs et al., 2002). 그러나, IACs 칼럼을 사용하여 mycotoxins와 항체의 매우 특정한 부착 때문에 크로마토그래피를 계속 사용하면 최소의 간섭이 발생하므로 결국 검출 수준이 낮게 나타난다.
이전의 연구 결과에 따르면 형광 검출(FLD) 및 ELISA를 이용한 액체 크로마토그래피(LC)를 사용하였을 때 우유 및 유제품의 AFM1 분석에 가능하다는 연구보고가 있었다. 그러나 우유 및 유제품의 AFM1 검출에는 TLC(thin layer chromatography, 박층 크로마토그래피), 형광측접법(fluorometry), 액체 크로마토그래피-대립 질량분석기(UHPLC-MS/MS), 측면유동 면역분석기, 젤을 이용한 면역분석기 등의 다른 방법이 채택되어지고 있다(Hussain and Anwar, 2008; Goryacheva et al., 2009; Fallah, 2010; Huang et al., 2014). AFM1 분석을 위해서 HPLC를 형광 검출(FD)과 함께 사용하는 것은 매우 일반적이면서도 효과적이다.
박층 크로마토그래피(TLC)는 유기성분들의 분리, 순도 평가, 식별을 위한 매우 오래된 방법이다. 사실, 그것은 이전의 AF 분석에서 가장 널리 사용된 분리 기법 중 하나이다. 또한, 1990년에 AOAC는 1 μg/g의 낮은 수준에서 AF를 식별하고 수량화하기 위한 선택 방법으로서 TLC를 공식 방법으로 포함시켰다. 그러나 FD(fluorescence detection)가 장착된 HPLC 방법이 TLC를 대체하게 되었으며, 현재 MS나 GC와 같은 다른 도구와 함께 많이 사용되고 있다(Iqbal et al., 2015). 지난 10년 동안, mycotoxins 분석은 다양한 흡착제를 사용하는 HPLC에 크게 의존해 왔다. 독소의 극성에 따른 분리는 정상 또는 역상 HPLC를 사용하여 수행되었다. 예를 들면, 샘플 전처리에 있어서 면역친화성 칼럼 또는 MycoSep 칼럼이 사용되고 있다(Asi et al., 2012; Iqbal et al., 2013). 물론 우유 또는 유제품의 종류에 따라 다르지만, AFM1의 HPLC 검출에 사용되는 방법은 이동 단계의 극성에 있어서 약간의 수정이나 변동으로 가능하다. 형광을 통한 검출은 분자에 있는 발색단(chromophore)의 존재에 의존한다. 그리고 대부분의 mycotoxins은 이미 자연적인 형광을 가지고 있고 HPLC-FD로 직접 검출될 수 있다(Valenta, 1998). HPLC의 주요 장점으로는 분리능력이 매우 좋고, 검출한계(LOD)가 매우 낮다는 것이며, 또한 여기에 다중 검출 시스템(fluoresce, UV)을 결합하면 하나의 표본에서 여러 화합물을 검출할 수 있다는 것이다.
최근에 ELISA는 상대적으로 쉽게 사용할 수 있기에 많이 이용되고 있다. Aflatoxin M1 검출에 상업적으로 이용 가능한 ELISA 키트는 대개 표적 분자에 특정한 1차 항체 또는 효소 및 필요한 표적 결합체를 사용하는 경쟁 검사 형식에 기초를 두고 있다(Tekinsen and Eken, 2008; Ertas et al., 2011). ELISA의 장점으로는 휴대가 용이하고 신속하면서도 매우 특이적으로 분석이 가능하다는 것이다. 단, 이 키트의 단점은 대량 검사의 비용이 증가할 수 있는 일회용이라는 점이다(Bilandzc et al., 2010). 비록 ELISA 분석은 분명 경쟁력은 많이 있지만, 하지만 항체의 민감도가 좁아 검출 범위가 제한적이며, 위양성(false positive) 결과를 보이기도 한다는 것이다(Iqbal et al., 2015). 따라서 향후 민감도 개선과 정확한 결과를 얻기 위한 더 많은 연구가 진행되어야 할 것이다.
우유 및 유제품 산업의 향후 과제
세계의 많은 지역에서, 우유는 건강과 영양에 대한 다양한 장점 때문에 소비자들 사이에서 매우 인기가 있으며, 또한 긍정적인 이미지를 가지고 있고, 더 나아가서 건강한 신체를 만드는데 필수적인 식품으로 인식하고 있다. 하지만 최근 젖소 사육은 지구의 온도가 계속 상승함에 따라 점점 더 어려워지고 있는 것이 사실이다(Iqbal et al., 2015). 예를 들면, 이러한 상승하는 기온과 변덕스러운 날씨 변화, 대기 중의 높은 농도의 이산화탄소 등으로 가축 사육에 있어서 많은 것들을 고려해야만 한다. 왜냐하면 상승된 온도로 인한 가뭄 및 홍수 같은 극한적인 기후의 변화로 인하여, 젖소가 섭취하는 사료와 음용하는 식수에 있어서 질적인 변화와 양적인 제한 때문에 젖소의 우유의 생산량과 우유의 품질에 직․간접적으로 영향을 줄 수 있기 때문이다(Iqbal et al., 2015). 사실, 옥수수와 밀에서 곰팡이를 생산하는 mycotoxins의 존재는 환경 조건에 크게 좌우되며, 그것은 예상되고 있다. 예를 들어, Aflatoxin을 생산하는 Aspergillus 종들은 예상되는 기후 변화와 함께 더 널리 전파되고 더 많이 존재하게 될 것이다. 또한, 증가하는 인구 수요를 충족시키기 위해 세계 우유 생산량은 2000년 대비 2050년까지 두 배가 필요할 것으로 추산되고 있다(Iqbal et al., 2015). 더 나아가서, 극도로 높은 우유 값은 소비자들의 우유 수요의 감소를 초래할 수도 있는데, 예를 들면, 특히 저개발국가 등에서 소비자들이 높은 우유 가격을 지불할 수 없기 때문이다.
결 론
우유와 유제품에 들어있는 Aflatoxin M1은 동물 건강뿐만 아니라, 사람에게도 위험이 될 수 있다. 높은 수준으로 Aflatoxin M1가 오염된 사료를 섭취할 경우, 결과적으로 상당히 높은 수준의 Aflatoxin M1이 우유에 존재할 수 있으며, 특히 가축들이 심하게 오염된 사료를 섭취하였을 경우에는 그만큼 Aflatoxin M1 함량이 높아지게 된다. 물론 더 많은 우유 생산량과 여기에 관련된 다양한 노력들이 이러한 상황을 만들 수도 있을 것이다. 일반적으로 Aflatoxin M1은 우유와 유제품에 자연적으로 오염이 되는 물질로 인식되고 있다. Aflatoxin M1의 가장 높은 발생률과 수준은 남아시아이며, 그 뒤를 이어 아프리카 국가들이었다. 그러므로, 동물 사료에서 지속적인 Aflatoxin 수준 감시의 중요성과 이들 국가에서 미코톡신에 대한 엄격한 규제의 필요성이 강조되고 있다. 반면에, 유럽산 우유 및 유제품에 Aflatoxin M1의 존재는 이러한 독소에 대한 엄격한 규제 때문에 비교적 낮았다. 우유와 유제품에서 Aflatoxin M1 분석에 가장 인기 있는 방법은 HPLC이다. 그러나, 비록 적은 양일지라도 우유에 함유된 다양한 미코톡신을 동시에 검출하고 정량화할 수 있는 분석 방법들은 분석 비용을 절감하기 위해서는 반드시 필요하며, 또한 이 방법들을 통해서 우유에 들어있는 mycotoxins을 지속적으로 검사하는 것이 가능해진다. 결론적으로 다시 정리하면, 개선된 젖소 사양 시스템을 활용하고 분석 시설을 개선할 뿐만 아니라, 엄격한 규정 이행을 통해서 우유에 함유된 자연 오염 물질들을 피하거나 줄일 수 있을 것이며, 그리고 인간의 음식으로서 우유와 유제품의 안전을 보장할 수 있을 것이다.
요 약
일반적으로 우유는 필요한 영양분이 풍부한 식품으로 사람의 건강 증진, 유지 등에 큰 도움을 주고 있다. 하지만 전 세계적으로 우유와 유제품에 Aflatoxin M1의 존재는 20∼30년 전부터 알려져 왔다. Aflatoxin M1으로 오염된 우유와 유제품은 특히 지난 10년에서 20년 동안 전 세계적으로 중요한 문제이다. 특히, 이 제품들에서의 미코톡신의 존재는 특히 성인보다 더 민감한 어린이와 유아에게 중요한 문제이다. 이 총설에서는 최근의 자료를 검토하여 전 세계적으로 다양한 지역에서 생산되는 우유 및 유제품에서 발생한 Aflatoxin M1의 현황, 관련 규정, 감소 전략, 검출 방법, 향후 연구과제 등을 정리하였다. 우유 및 유제품의 Aflatoxin M1 오염을 최소화하기 위해서는 지속적으로 발전하고 있는 분석 기법을 이용한 엄격한 규제와 우수한 우유 처리기술이 반드시 필요하다. 더 나아가서, 우유 및 유제품에 존재할 수 있는 Aflatoxin M1이 인체 건강의 미치는 영향을 올바른 인식할 수 있도록 교육도 함께 진행되어야 할 것이다.
