서론
네델란드 Rotterdam 부근 Godua 지방에서 전통적인 방식으로 제조되는 Gouda 치즈는 네델란드의 주요 수출 농산품의 하나로서 자연치즈이다(Van Hoorde et al., 2008; Gill and Oudit, 2015). 일반적으로 담황색의 파라핀이나 왁스 등으로 포장된 Gouda 치즈의 단백질은 22%부터 35%까지이고, 지방은 25%에서 46%까지이며, 수분은 42%에서 55%까지이고, 염(salt)은 1.0%에서 1.5%까지이다(Van Hoorde et al., 2010ab; McCollum et al., 2012).
또한 Gouda 치즈는 소비자의 기호에 맞는 풍미형성과 전형적인 조직을 얻기 위하여 최소한 2∼6개월 이상 장기간 숙성기간이 필요하며, 이렇게 숙성된 자연치즈인 Gouda 치즈는 약간 딱딱한 원형의 모양으로 노란색을 가진 표면에 고유의 신맛(sour flavor)과 고릿한 향(rancid flavor)이 있다 (Yang, 2009; Colonna et al, 2011; McCollum et al., 2012; 서와 송, 2017).
한국농촌경제연구원의 2014년 보고에 의하면 FTA 특혜관세를 적극 활용한 미국산과 EU산 치즈는 현재 한국 시장의 81.9%를 차지한 상태이다(Korea Rural Economic Institute, 2014). 더 나아가서, 세계적인 명품 치즈로 알려진 많은 치즈들의 대부분은 비살균원유로 제조되고 있다는 것은 비살균원유 치즈의 중요성을 직접적으로 대변하고 있다(Kim et al., 2015; Song and Seo, 2017).
2016년 4월 4일 한국식품의약품안전처 공고 제2016-126호 축산물의 가공기준 및 성분규격 일부 개정고시에서 행정예고를 하였는데, 이것의 주요 목적은 살균하지 않은 원유로 만든 치즈를 제조 및 수입할 수 있도록 가공기준을 개정하여 국제기준과 조화를 이루고, 수출 및 수입 관련무역마찰 해소 그리고 다양한 제품을 생산할 수 있는 기반 조성으로 축산물가공업 활성화를 도모하기 위해서이다. 그리고 2016년 12월 29일에 한국식품의약품안전처고시 제2016-154호 식품의 기준 및 규격 전부개정고시에 하였다. 2018년부터 적용되는 개정된 식품공전의 치즈류의 제조 및 가공기준에서 60일 숙성치즈의 경우 비살균원유의 사용을 허용하였다(Song and Seo, 2017). 한국에서 비살균원유를 이용하여 다양한 치즈를 제조한 후 최소 60일 이상 숙성을 하면 합법적인 판매를 할 수 있기에 소비자들의 다양한 요구를 만족시킬 수 있을 뿐만 아니라, 치즈산업을 활성화시킬 수 있는 좋은 기회라고 생각된다. 하지만 과학적인 방법에 근거하여 다양한 처리법을 발전시켜 공중위생을 보호하고, 치즈 제조 전문가들의 엄격한 관리 및 감독을 통한 다양한 비살균 치즈의 독특한 특성과 전통을 지속적으로 전수 및 보존되어야 할 것이다(Song and Seo, 2017).
따라서 본 연구의 목적은 비살균 Gouda 치즈의 60일 숙성기간 동안 다양한 미생물들의 변화와 관찰 및 병원균인 Salmonella spp.로 오염시킨 원유로 제조한 비살균 Gouda 치즈의 미생물학적 안전성을 평가하기 위해서이다. 또한 궁극적인 목적은 한국의 비살균 치즈 기준의 적합성을 살펴볼 뿐만 아니라, 비살균 Gouda 치즈의 안전성과 관련된 기초적인 자료를 제시하고 본 실험이 진행되었다.
재료 및 방법
본 실험에서는 Fig. 1과 같이 다양한 Gouda 치즈가 건국대학교 수의과대학의 Center for One Health에서 제조되었다. 먼저 세균수 3만 이하의 1A와 체세포수 20만 미만의 1등급의 양질의 원유는 경기도 연천군에 위치한 애심목장에서 생산된 것을 구입하여 사용하였다. 응유효소인 rennet는 Mysecoren Animal Rennet(Maysa GIDA, Turey)와 혼합균주(Str. thermophilus, Str. lactis, L. bulgaricus, L. casei)로 구성된 유산균은 Lyofast YAB 450 AB(Sacco srl., Codaragok, Italy) 제품을 사용하였다. 본 실험을 위해서 제조된 다양한 Gouda 치즈들은 온도가 10±2℃ 그리고 상대습도가 85±5%인 숙성실에서 60일 이상 숙성시키면서 공시재료로 사용하였다.
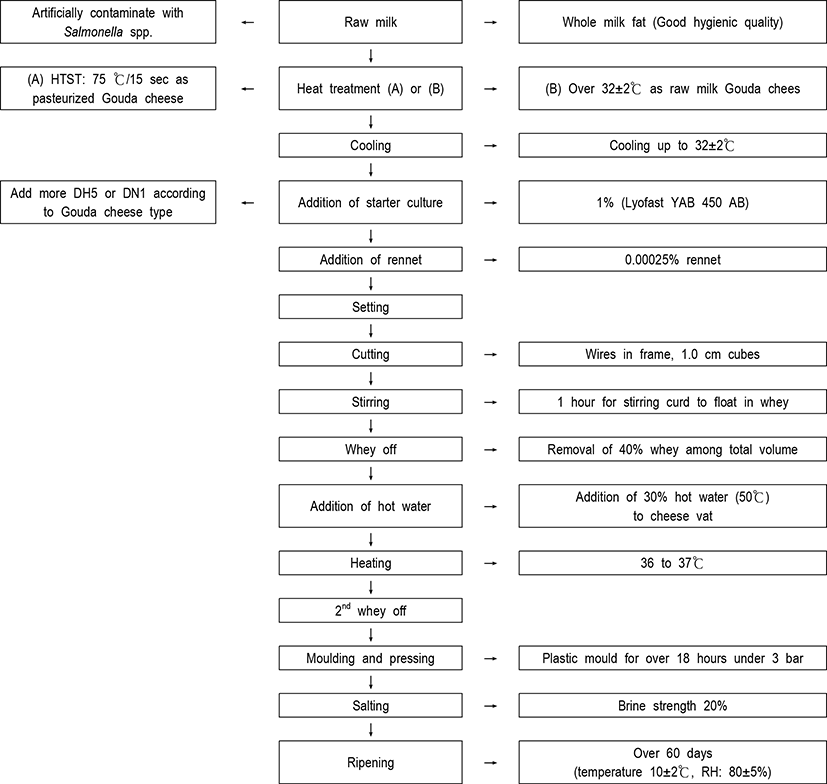
특히 본 실험에서 Gouda 치즈 제조시에 유산균은 Lyofast YAB 450 AB를 사용하였으며, Kefir에서 분리한 유산균인 DH5와 DN1의 항미생물 활력을 측정하기 몇 개의 대조구 비살균 Gouda 치즈에 추가적으로 첨가하였다. 유산균인 DH5와 DN1는 MRS(Difco, Detroit, MI, USA)에 도말하여 36℃에서 48시간 배양 후 MRS broth에 계대하여 사용하였다.
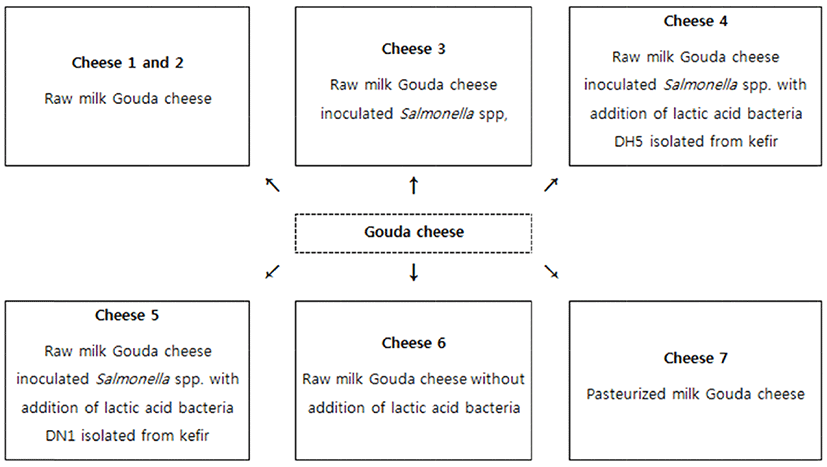
본 실험에서는 비살균 Gouda 치즈의 미생물의 안전성과 특성을 알아보기 위해서 총 7종류의 다양한 Gouda 치즈가 제조되었으며, Fig. 2에 각 Gouda 치즈의 특성이 자세하게 정리되어 있다.
Salmonella spp.는 미국 FDA(CFSAN, College Park, Maryland, USA)에서 분양받아 실험실에서 보유하고 있던 식품분리균주를 사용하였으며, —70℃에 보관하여 필요할 때마다 균주를 해동하고 사용하였다. Nutrient agar(Oxoid, Hampshire, U.K.)에 해동된 균주를 도말하여 37℃에서 호기적으로 24시간 배양하였다. 배양된 집락 중 단일집락을 선택하여 Tryptic Soy Broth(Oxoid)가 37℃에서 24시간 배양하였으며, 3번 이상 계대배양한 균액을 희석하여 접종액으로 사용하였다.
본 실험에는 원유를 살균하여 제조한 Gouda 치즈가 대조구로 하였으며, 실험구로는 비살균 원유로 Gouda 치즈를 제조하였다. 비살균원유로 제조된 Gouda 치즈에 다양한 농도의 병원성균인 Salmonella spp.를 접종하여 60일 이상 저장기간 동안의 변화를 관찰하였다.
미생물의 검사는 한국식품의약안전처에 제시된 공인방법에 의해서 진행되었다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 100 μL를 취하여 10배수로 희석한 희석액을 MRS(Difco, Detroit, MI, USA)에 도말하여 36℃에서 48시간 배양 후 흰색콜로리 집락을 계수하여 유산균수를 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 1,000 μL를 취하여 10배수로 희석한 희석액을 대장균군 건조필름(3M Petrifilm, USA)에 도말하여 36℃에서 24∼48시간 배양 후 생선된 푸른 집락중 주위에 기포를 형성하고 있는 집락수를 계산하고 그 평균집락수에 희석배수를 곱하여 대장균수를 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer(Interscience, USA)를 이용하여 1분간 균질화하고, 1,000 μL를 취하여 10배수로 희석한 희석액을 대장균군 건조필름(3M Petrifilm, USA)에 도말하여 36℃에서 24∼48시간 배양 후 붉은 집락중 주위에 기포를 형성하고 있는 집락수를 계산하고, 그 평균집락수에 희석배수를 곱하여 대장균수를 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 1,000 μL를 취하여 10배수로 희석한 희석액을 Aerobic Count Plate(3M Petrifilm, USA)에 도말하여 36℃에서 24시간 배양 후 생성된 붉은 집락을 계수하여 그 평균집락수에 희석배수를 곱하여 일반세균수로 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 100 μL를 취하여 10배수로 희석한 희석액을 xylose lysine deoxycholate agar(Oxoid)에 도말하여 36℃에서 24시간 배양 후 붉은 색 집락을 계수하여 Salmonella spp. 균수를 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 100 μL를 취하여 10배수로 희석한 희석액을 sorbitol MacConkey agar(SMAC; BD Difco, NJ, USA)에 도말하여 37℃에서 24시간 배양 후 집락을 계수하여 Esherichia coli O157:H7 수를 측정하였다.
치즈 샘플 25 g에 인산염완충희석액 225 mL를 첨가하여 stomacher blender인 Bag mixer (Interscience, USA)를 이용하여 1분간 균질화하고, 100 μL를 취하여 10배수로 희석한 희석액을 Oxford agar(Oxoid, Basingstoke, UK)에 도말하여 30℃에서 48시간 배양 후 집락 주위에 검은색 환을 가지고 있는 수를 계수하여 Listeria monocytogens수를 측정하였다.
치즈 샘플 25 g를 취하여 225 mL의 10% NaCl 첨가한 TSB 배지에 가한 후 35∼37℃에서 18∼24시간 증균배양을 하였다. 분리배양으로 증균배양액을 Baird-Parker 한천배지에 접종하고, 35∼37℃에서 18∼24시간 배양하여 황색불투명 집락을 확인하였다. 확인시험으로 분리배양된 평판배지상의 집락을 보통 한천배지에 옮기고 35∼37℃에서 18∼24시간 배양하였다. 그람염색을 실시하여 포도상의 배열을 갖는 그람양성 구균 확인 후 coagulase 시험을 실시(24시간 이내에 응고 유무 판정)하였다.
증균배양으로 시험용액 1 mL를 Cooked Meat 배지의 아랫부분에 접종하고, 35∼37℃에서 18∼24시간 동안 혐기배양하였다. 분리배양으로 카나마이신을 200 μg/mL의 농도로 가한 난황을 첨가하고 Clostridium perfringens 한천배지(또는 난황첨가 TSC 한천배지)에 증균배양액을 접종하고, 35∼37℃에서 18∼24시간 혐기배양하였다. Clostridium perfringens 한천배지에서 직경 2 mm 정도의 약간 돌기된 유황색으로 주변에 불투명한 백색환이 있는 집락(또는 TSC 한천배지에서 불투명한 환을 가지는 황회색 집락)은 확인시험을 실시하였다. 확인시험으로 분리배양된 평판배지상의 집락을 보통한천배지에 옮기고 35∼37℃에서 18∼24시간 혐기배양한 후 그람염색을 실시하였다. 동시에 보통한천배지를 35∼37℃에서 18∼24시간 호기 배양하여 균의 비발육을 확인하였다. 그람양성간균으로 확인된 집락은 glucose, lactose, inositol, raffinose를 1% 가한 4종의 GAM 배지에 옮겼다. 35∼37℃에서 3일간 배양 후 BTB-MR 지시약을 가해서 붉은 색으로 변하는 것을 양성으로 판정하였다. 운동성은 GAM 배지에서 35∼37℃에서 1∼2일간 배양하여 운동성의 유무를 관찰하였다. Glucose, lactose, inositol과 raffinose를 분해하며 운동성이 없는 것을 확인하면 Lecithinase 억제 시험을 실시한다. 난황이 포함된 TSC 한천배지에 접종하여 35∼37℃에서 24시간 혐기배양한 수 2∼4 mm 불투명한 환을 가지는 황회색 집락을 양성으로 판정하였다.
결과 및 고찰
본 연구에서 제조되어진 비살균 Gouda 치즈의 숙성중 미생물학적 변화는 Fig. 3에서 Fig. 7에 자세하게 나타나 있다.
총 7종류의 Gouda 치즈가 조사되었는데, Cheese 1과 2는 전통적인 비살균 Godua 치즈이며, Cheese 3은 원유에 인위적으로 Salmonella spp.를 오염시킨 후 제조된 비살균 Gouda 치즈이다. Cheese 4와 5는 Cheese 3의 조건에서 추가적으로 유산균 DH5와 DN1을 각각 첨가하였다. Cheese 6은 유산균의 첨가없이 제조된 비살균 Gouda 치즈이며, Cheese 7은 살균된 원유로 제조된 Gouda 치즈이다.
Gouda 치즈가 제조된 당일을 1 day로 하여 매 20일인 20 day, 40 day, 60 day에 대장균 및 대장균군, 일반세균(AC), 유산균(LAB), Salmonella spp.를 검사하였다. 60 day에는 추가적으로 Listeria monocytogenes, Staphylococcus aureus, Clostridium perfringens, E. coli O157:H7를 조사하였다.
일반적으로 치즈에 있어 잠재적으로 건강에 위험을 줄 수 미생들을 살펴보면 다음과 같다. Salmonella spp.와 Staphylococcus aureus 그리고 다른 대장균들은 상당히 자주 발생하고, 중간 정도의 질환을 유발한다. 드물게 발생하는 Listeria monocytogenes는 심한 질환을 유발하지만 반면 효모도 드물게 발생하지만 질환을 전혀 유발하지 않는다. Mycobacteria(결핵균들)와 브루셀라(Brucella abortus)는 거의 발생하지 않지만 만약 발생하면 심한 질환을 유발하고, Mycotoxin(곰팡이독)와 바이러스도 거의 발생하지 않지만 만약 발생하면 중간정도의 질환을 유발한다(Bryan et al., 1997; Kim et al., 2015).
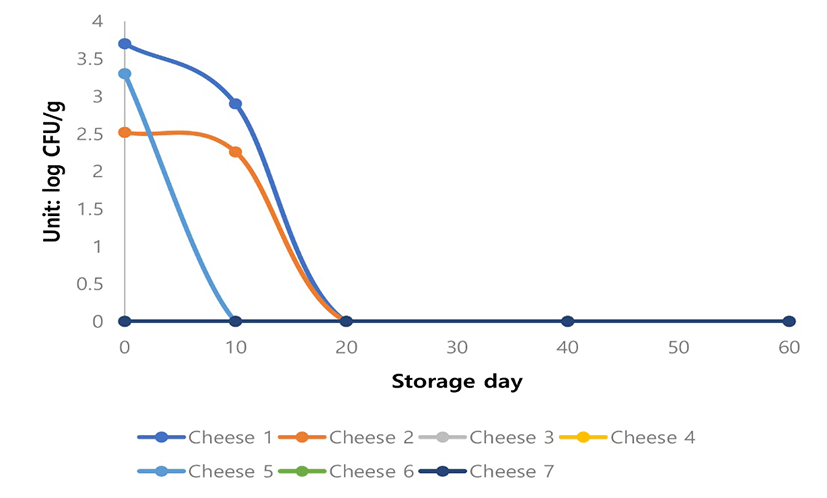
Cheese 1과 2에 있어서 미생물학적인 변화를 분석해 보면, 60일 저장기간 동안 Salmonella spp.는 전혀 검출되지 않았으며, E. coli는 20 day 부터는 검출되지 않았다(Fig. 3).
대장균군은 Cheese 1에서 40 day부터 검출되지 않았지만 Cheese 2에서는 60 day까지 검출되었다. Cheese 1과 Cheese 2는 비살균 Gouda 치즈이기에 약간의 차이는 있었지만 전반적으로 비슷한 경향을 보였다(Fig. 4).
일반세균수(Aerobic count)는 Cheese 7을 제외하고 Cheese 1부터 6까지는 저장기간 동안 감소하는 것으로 나타났다(Fig. 5).
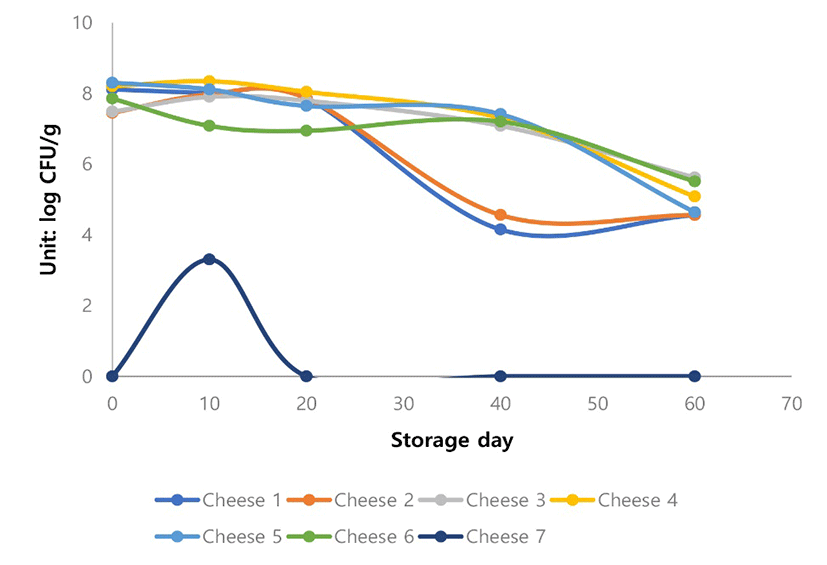
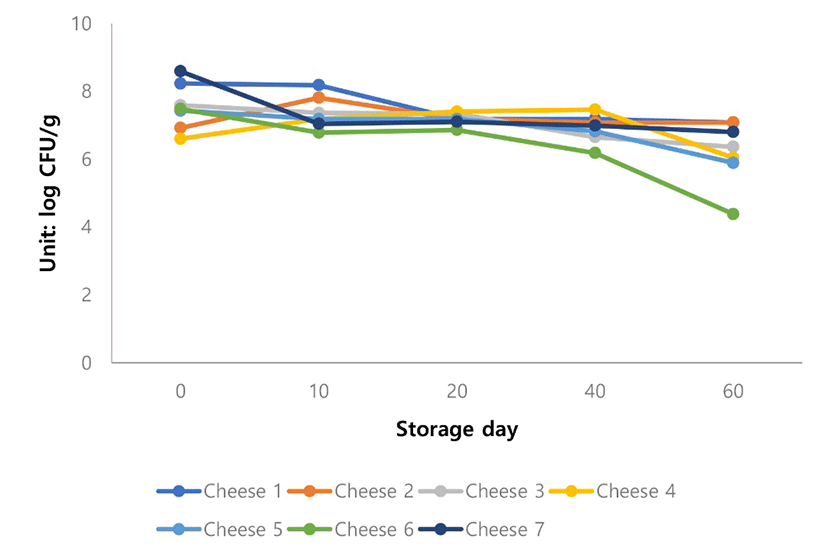
Cheese 6는 유산균첨가 없이 제조된 비살균 Gouda 치즈인데 저장기간이 길어질수록 유산균수가 다른 것들에 비해서 유의적으로 낮게 나타났다(Fig. 6).
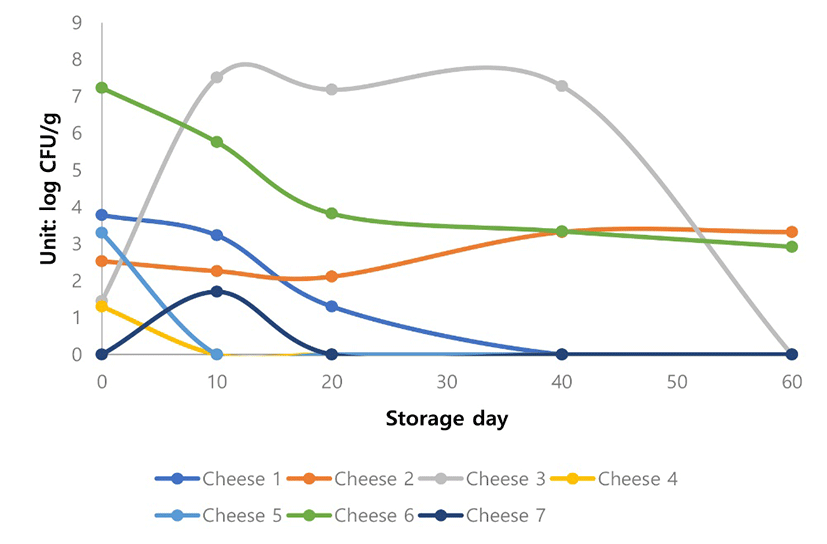
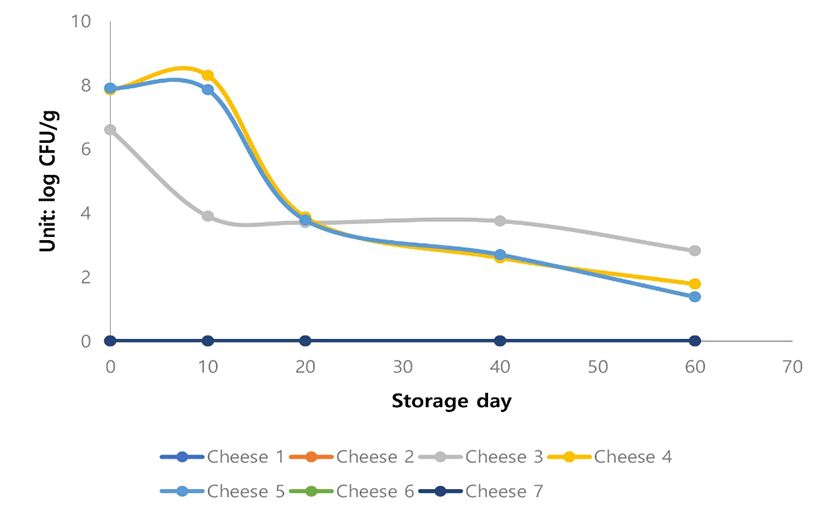
Cheese 3, Cheese 4와 Cheese 5에 있어서 미생물학적인 변화를 분석해 보면, 60일 저장기간 동안 Salmonella spp.의 저해가 관찰되었다(Fig. 7). 특히 Cheese 4와 Cheese 5에 추가적으로 첨가된 DH5와 DN1은 kefir에서 분리한 유산균으로서 이미 생리활성 능력이 검증되었다. 본 실험에서 도 Cheese 3보다 유의적으로 Salmonella spp.의 저해를 보였다(Fig. 7). 향후 비살균 치즈 제조시에 첨가될 수 있는 항미생물활력이 우수한 유산균을 사용하여 원유에 오염된 또는 치즈 제조시 오염될 수 있는 다양한 병원성 식중독 미생물 저해에 관한 추가적인 연구가 진행되어야 할 것이다.
그리고 Cheese 7는 전통적인 방법인 살균한 원유로 제조한 Gouda 치즈인데, 대장균 및 대장균군, Salmonella는 거의 검출되지 않았으며, 유산균은 다른 것들에 비해서 약간 높게 나타났으며, 일반세균수는 20일 검출되고, 그외는 검출되지 않았다(Fig. 3 to Fig. 7).
60일에 Cheese 1부터 Cheese 7까지의 모든 샘플에 대한 Listeria monocytogenes, Staphylococcus aureus, Clostridium perfringens, E. coli O157:H7 검사에서 모두 음성으로 판명되었다(data not shown).
우유는 완전식품으로 널리 이용되고 있는 매우 유용한 음식자원 중의 하나이지만, 우유의 성질상 외부의 환경에 매우 쉽게 영향을 받는 식품이기도 하다(Johnson, 2002). 따라서 원유를 살균하지 않고 비살균 치즈 제조시에는 더욱더 엄격한 관리감독이 요구되어지는 것은 사실이다. 최근 Lee와 Yoon(2017)은 미생물학적, 물리적, 그리고 화학적 위해요인이 어떻게 원유 및 치즈에 다양한 오염을 유발할 수 있는지를 보고하였다. 그 중에서 먼저 미생물학적 위해요인을 살펴보면 여기에는 효모, 곰팡이, 병원성 미생물 등이 포함되는데, 특히 높은 치사율을 가지고 있는 세균인 Listeria monocytogenes 그리고 E. coli, Salmonella, S. aureus는 우유, 치즈, 육류 등 축산물에 주로 존재하는 것으로 알려져 있다(Gohar et al., 2017; Lee and Yoon, 2017). 원유에서는 0.1∼20% 그리고 치즈에서는 1.1∼26.7% 정도 L. monocytogenes가 검출되었다(Seyoum et al., 2015). 원유 및 치즈에서 10.3∼76.4% 정도 E. coli가 검출되었다(Ombarak et al., 2016). E. coli O157:H7은 매우 낮은 0.5∼3.8% 정도가 보고되었지만, E. coli O157:H7은 Shiga toxin을 생산하는 E. coli로, 용혈성 요독증후군(hemolytic uremic syndrome), 출혈성 대장염(hemorrhagic colitis) 등의 심각한 질병을 유발하는 중요한 병원성 세균이다(Ahmed and Shimamoto, 2014; Kiros et al., 2016). 또한 Salmonella는 자연계에 널리 존재하는 세균으로 건강한 사람에게는 치사율이 1% 정도에 불과하지만, 면역력이 약한 집단(노인, 아이 등)에게는 매우 위험하다(CFSPH, 2013). 원유에서 0.5∼6.1% 그리고 치즈에서 0.5∼4.3% 정도 Salmonella가 검출되었다(Almeida et al., 2007; Ahmed and Shimamoto, 2014). 일반적으로 독소를 생산하기 위해서는 최소 105 CFU/g 이상의 S. aureus는 균체가 존재하여야 하며, 만약 이 독소를 사람들이 섭취하였을 때 식중독을 유발하는 병원성 세균이다(Rola et al., 2016). 특히 S. aureus는 사람의 손, 코 점막, 타액 등에 주로 존재하기 때문에, 작업자들에 의해 원유 및 치즈에 상호 교차오염될 수 있어 특별한 주의가 요구되며, 다른 세균들보다 S. aureus는 원유에서는 46.2∼73.5%, 치즈에서는 6.3∼75%로 높게 검출되었다(André et al., 2008; Kiros et al., 2016; Rola et al., 2016; Lee and Yoon, 2017).
또한 D’Amico 등(2008)은 가공 후 과정을 오염시키는 물질이 Listeria monocytogenes 경우에는 60일 숙성과정으로는 살균(또는 비살균) 우유로 제조된 surface-mold-ripened 연질 치즈의 안전성을 보장할 수 없다고 보고하였다. 연구자들은 “이 종류의 치즈는 숙성이 아닌 다른 방법을 사용해서 안정성을 추구해야 되기 때문에 현재 연방 규정을 개정할 필요성이 있다”라고 결론을 내렸다. FDA는 Listeria monocytogenes 오염에 중점을 두고 치즈의 안정성에 대한 전국적인 조사를 시행했다(Gould et al., 2014). 이 조사에는 치즈 제조 시설의 규모와 상관없이 살균 및 비살균 치즈 제품을 생산하는 모든 시설이 포함되었다. 11월에 비살균 우유로 제조되었고, 규정에 따라 60일간 숙성시킨 Gouda 치즈에 의한 38건의 질병의 발생을 CDC가 보고한다(US CDC, 2010).
D’Amico 등(2010)의 2012년 12월에 숙성된 Gouda 치즈와 stirred-curd 체다치즈 내에 생존하는 E. coli O157:H7 제거에 대한 연구에서 숙성조건이 60일 때 체더치즈의 Brucella abortus는 제거할 수 있었지만, 비살균 Gouda 치즈 또는 비살균 stirred-curd 체더치즈 내의 살아있는 E. coli O157:H7는 완전히 제거할 수 없다고 보고하였다.
다음으로 물리적 위해요인에는 매우 다양한 것으로 알려져 있지만 충분히 교육을 통해서 예방할 수 있다(Lee and Yoon, 2017). 마지막으로 농약, 항균물질, 호르몬제, 곰팡이 독소 등이 화학적 위해요인이다(Lee and Yoon, 2017). 부적절한 숙성으로 치즈에 ochratoxin A, aflatoxin M1과 같은 곰팡이독소가 오염될 수 있기 때문에 주의해야 한다고 Hymery 등(2014)은 발표하였다. 일반적으로 Aspergillus flavus와 Aspergillus parasiticus가 생성하는 Aflatoxin 독소는 발암물질 1급으로 IARC(국제암연구소)의해 분류되고 있으며, 특히 Aflatoxin은 열이나 산에도 내성을 가지고 있어 원유에 존재할 경우 매우 위험하다(Anfossi et al., 2012). 왜냐하면 Aflatoxin은 원유나 치즈에 파괴되지 않은 상태로 존재하기 때문이다(Anfossi et al., 2012). Aflatoxin M1의 검출보고에 의하면 우유에서는 21.6∼100% 그리고 치즈에서는 47.6∼55.0%의 높은 수준을 보였다(Kamkar et al., 2011). 반면 Ochratoxin A는 우유와 치즈에서 각각 4.8%, 32.6%의 비율로 검출되었다(Dall’Asta et al., 2008; Mohajeri et al., 2013). 또한 Dokuzlu와 Tayar(2001) 그리고 Fontaine 등(2015)은 항생제인 penicillin, tetracycline, roquefortine C와 mycophenolic acid, 중금속인 철, 구리 등이 원유와 치즈에서 자주 검출되었다고 보고하였다.
더 나아가서 2018년부터 적용되는 개정된 식품공전의 치즈류의 제조 및 가공기준을 정확히 이해할 뿐만 아니라, 60일 숙성된 비살균 치즈의 안전성에 관한 지속적인 연구가 진행되어야 할 것으로 사료된다(Fig. 8).

따라서 3가지의 다양한 위해요인뿐만 아니라, 식품공전의 치즈류의 기준규격에 근거하여 비살균 치즈 제조와 판매 그리고 치즈 제조 공장에서 이러한 식중독 세균들을 제어하기 위한 과학적 근거 방안과 관련 연구를 통한 구체적인 방법이 확립되어야 할 것으로 사료된다.
요약
본 연구에서는 비살균 원유로 제조되고 숙성실에서 60일 이상 숙성된 7가지의 다양한 Gouda 치즈의 미생물학적 안전성을 실험적으로 검증하기 위해서 저장기간 동안에 다양한 미생물학적 변화를 조사하였다. Cheese 1과 2는 전통적인 비살균 Godua 치즈에 있어서는 60일 저장기간 동안 Salmonella spp.는 전혀 검출되지 않았으며, E. coli는 20 day부터는 검출되지 않았다. 대장균군은 Cheese 1에서 40 day부터 검출되지 않았지만, Cheese 2에서는 60 day까지 검출되었다. Cheese 1과 Cheese 2는 비살균 Gouda 치즈이기에 약간의 차이는 있었지만 전반적으로 비슷한 경향을 보였다. Cheese 3(원유에 인위적으로 Salmonella spp.를 오염시킨 후 제조된 비살균 Gouda 치즈), Cheese 4(Cheese 3에서 kefir에서 분리한 DH5 유산균 첨가)와 Cheese 5(Cheese 3에서 kefir에서 분리한 DN1 유산균 첨가)에 있어서는 60일 저장기간 동안 Salmonella spp.의 저해가 관찰되었다. 특히 Cheese 4와 Cheese 5에 추가적으로 첨가된 Kefir에서 분리한 유산균 DH5와 DN1은 Cheese 3보다 유의적으로 Salmonella spp.의 저해를 보였다. Cheese 6(유산균첨가 없이 제조된 비살균 Gouda 치즈)에서는 저장기간이 길어질수록 유산균수가 다른 Cheese들에 비해서 유의적으로 낮게 나타났다. 그리고 Cheese 7(살균한 원유로 제조한 전통적인 Gouda 치즈)에 있어서는 대장균 및 대장균군, Salmonella ssp.는 거의 검출되지 않았고, 유산균은 다른 Cheese들보다 약간 높게 나타났다. 60일 숙성된 Cheese 1부터 Cheese 7까지의 모든 샘플에 대한 Listeria monocytogenes, Staphylococcus aureus, Clostridium perfringens, E. coli O157:H7 검사에서 모두 음성을 보였다. 향후 kefir에서 분리한 유산균 DH5와 DN1의 비살균 원유를 이용한 숙성치즈의 제조에 관한 연구가 필요하겠다. 본 연구에서 Salmonella spp.를 인위적으로 접종한 Cheese 4와 5에서 보여준 Salmonella spp.의 저해 효과는 비살균 원유를 이용한 숙성치즈의 제조에 보다 큰 안전성을 부여할 것이라 사료된다.