서론
프로바이오틱스는 일반적으로 Lactobacillus, Lactococcus, Leuconostoc, Peidococcus, Streptococcus 등으로 분류되며, 이들 중 특정 프로바이오틱스는 면역 시스템 조절을 통해, 염증 조절, 항암, 항 돌연변이 등의 효과를 갖고 있다고 알려져 있다(Jorjão et al., 2015). 이러한 프로 바이오틱스의 면역 조절 시스템은 크게 두 가지로 ‘선천성 면역 활성’과 ‘비 면역 반응 비활성화’으로 나뉘어진다(Ashraf et al., 2014; Tao et al., 2015). 선천적 면역 시스템은 미생물의 침입 감지로부터 시작되며, 후천적 면역(적응면역) 의 경우 T 림프구와 B 림프구로 이루어져 있으며, 이는 생식 세포에서 암호화 되지 않고 유기체에서 새로 생산되는 항원 수용체를 사용하기 때문에 매우 정확하고 민감하다고 알려져 있다(Ma et al., 2015).
면역계에서 MHC 클래스 II 및 I 분자는 병원체 특이적 T 세포를 활성화시키는 CD4+및 CD8+ T 세포로 이동한다. CD4+는 T helper cell 1(Th1), T helper cell 2(Th2), T helper cell 17(Th17) 및 regulatory T helper cell(Treg)와 같은 T helper cell로 구성된다. 각각의 T helper cell은 특이적 활성을 가지며, Th1은 전 염증성 사이토카인(TNF-α, IFN-γ, IL-1β, IL-2, IL-6, IL-12) 을 분비하고(Mirzaee et al., 2015), Th2는 항 염증성 사이토카인(IL-4, IL-5)을 분비하며, Treg는 IL-10을 분비한다. T helper cell 사이의 균형은 인산화 시스템에 의해서 조절되지만, T helper cell 간의 불균형에 의해 면역, 알레르기 및 전신성 자가 면역 질환과 같은 질병을 일으키는 장기간 면역 결핍을 유도한다(Singh et al., 1999; Iwasaki et al., 2010).
특히 Lactobacillus gasseri 는 인간의 위 장관에 매우 풍부하게 존재한다고 알려져 있다. 일부 선행 연구들에 따르면 L. gasseri의 발효 생성물은 면역 조절, 항균 및 항 고혈압제에 효능이 있다고 알려져 있으나, 우유 내에서는 L. gasseri의 생육 활성이 좋지 않은 것으로 보고되어진다(Arakawa et al., 2008). 프록토올리고당, 갈락토올리고당 등이 프리바이오틱스로써 필요하다(Manning et al., 2004; Hardy et al., 2013). 식물 추출물은 현재까지 항산화, 항염증 등의 생리활성에 주목하여 연구되어왔다(Mirzaee et al., 2015; Oh et et al., 2016). 이전 선행연구를 통하여 우유 내 L. gasseri 505의 생장 촉진에 유의적으로 가장 높은 영향을 주는 식물 추출물로서 꾸지뽕잎 추출물을 선별하였다. 꾸지뽕(Cudrania tricuspidata)은 항균 및 항암 요법의 약제로 아시아에서 사용되어 왔으며, 많은 연구에서 꾸지뽕(Cudrania tricuspidata) 오일에는 항균 효과가 있다고 보고되었다 (Bajpai et al., 2013). 그러나 특정 유산균의 생장을 촉진시키는 프리바이오틱스로서의 역할과 상승효과에 관련된 연구는 전무한 설정이다. 따라서 본 연구에서는 CT를 첨가한 우유를 L. gasseri 505로 발효한 발효유의 면역조절 활성을 확인하고자 하였으며, real-time PCR, ELISA 및 western-blotting 분석을 통해 면역조절 사이토카인의 생성량 및 단백질 발현을 측정하였다.
재료 및 방법
Lactobacillus gasseri 505(Korean Culture Center of Microorganisms, Seoul, Korea; KCCM 11766P)은 유아분변 유래 유산균으로 Man, Rogosa and Sharpe(MRS) (Difco Laboratories, MI, USA) agar로 37℃에서 48시간 배양하였다. MRS agar 배지에서 배양된 각각의 colony를 10 mL의 MRS broth로 옮겨져 37℃에서 18시간 2회 계대배양하였다. 배양 완료 후, phosphate-buffer saline(PBS)를 이용하여 원심분리기(4000 rpm, 10 min, 4℃)로 세척 과정을 3회 반복하였다.
꾸지뽕잎은 전라북도 순창에서 구매하였으며, 추출물을 동결 건조하여 사용하였다. 우유(Control)와 동결건조한 꾸지뽕잎 추출물 [0.2% (g/g)]을 첨가한 우유(CT)는 85℃에서 15분간 살균하였으며, 냉각 후 L. gasseri 505를 3%로 접종하였다(ca. 1×107 CFU/mL). 혼합액은 41℃에서 40시간 발효하여 FCT를 제조하였다. 모든 샘플은 동결건조하여 —20℃ 보관하며 사용하였다.
RAW 264.7 대식세포는 American Type culture Collection(Rockville, MD, USA)으로부터 구입하였으며, 1% penicillin/streptomycin(GE healthcare Life Sciences, Logan, Utah, USA) 와 10% fetal bovine serum(FBS) (GE healthcare Life Sciences, Logan, Utah, Australia) 가 포함된 Dulbecco's modified Eagle's medium(DMEM) (GE healthcare Life Sciences, Logan, Utah, USA)을 이용하여 5% CO2, 37℃ 조건에서 배양하였다.
RAW 264.7 cells을 (1×106 cells/well)로 96 well-plate에 도포하였으며, 12시간 후 무혈청 DMEM 배지로 교체 후 12 시간 뒤에 샘플처리를 실시하였다. RAW 264.7 cells에 동결건조한 Control, CT, FCT 파우더를 무혈청 DMEM 배지를 이용하여 10 mg/mL, 5 mg/mL, 2.5 mg/mL, 1.25 mg/mL 농도로 처리하여 24시간 동안 반응하였다. 배양액을 제거한 후, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT, Sigma, USA) 용액(48 μL)을 첨가하여 37℃, 5% CO2에서 4시간 동안 배양하였다. 상층액을 제거하고 dark formazan crystals을 100 μL DMSO와 100 μL D.W을 첨가 후, Synergy H1 plate reader(Bio-Tek Instruments Inc.)를 이용하여 540 nm에서 흡광도를 측정하였다.
사이토카인을 측정하기 위해서(전 염증성/ 항 염증성 사이토카인) RAW 264.7 cell (1×106 cells/96 well plates) RAW 264.7 cells에 동결 건조한 Control, CT, FCT 파우더를 무혈청 DMEM 배지를 이용하여 10 mg/mL, 5 mg/mL, 2.5 mg/mL, 1.25 mg/mL 농도로 처리하여 37℃, 5% CO2에서 24시간 동안 반응하였다. 배양 후 배양 상층액을 이용하여 사이토카인을 측정하였다. 배양 상층액은 측정 전까지 —70℃에서 보관하였다. 사이토카인은 Enzyme-linked immunosorbent assay kits는 ELISA MAX Deluxe Set(BioLegend Inc., San Diego, CA, USA)을 사용하여 측정하였다.
RAW 264.7 cells을 1×106 cells로 6 well-plate에 분주하여 배양한 후, 샘플(동결 건조한 Control, CT and FCT 파우더)을 무혈청 DMEM 배지를 이용하여 10 mg/mL, 5 mg/mL, 2.5 mg/mL, 1.25 mg/mL 농도로 처리하여 37℃, 5% CO2에서 24시간 동안 반응하였다. 배양 후, Dulbecco’s Phosphate-buffered Saline(D-PBS) (PBS, Welgene, Daegu, Korea)를 이용하여 세척한 후 10,000 rpm에서 5 분 동안 원심분리를 실시한다. 상층액은 제거한 뒤, pellet을 RIPA buffer(Sigma, St Louis, MO, USA)와 protease inhibitor cocktail tablet(Roche Diagnostics, Mannheim, Germany)를 이용하여 세포 내 단백질을 추출한다. 8,000 rpm, 10 min 원심분리 후, 단백질 25 μg을 12% SDS-PAGE gel(BioRad Laboratories, Hercules, CA)에 로딩하였다. 그 후, Trans blot Turbo transfer pack(BioRad Laboratories, Hercules, CA)에 전이하였다. Tris-buffered saline with 0.05% Tween-20과 무지방 분유로 blocking한 후에 iNOS, COX-2의 1차 항체(Cell Signaling Technology, Boston, MA, USA)와 2차 항체(Santa Cruz Biotechnology Inc., Santa Cruz, CA)를 처리하였다. 2차 항체 처리 후 ECL(BioRad Laboratories, Hercules, CA)를 이용해서 단백질 밴드를 검출하고, Bio-rad ChemiDoc MP imaging system과 quantified with ImageJ software(National Institutes of Health, Bethesda, MD, USA)를 이용하여 정량화하였다.
결과
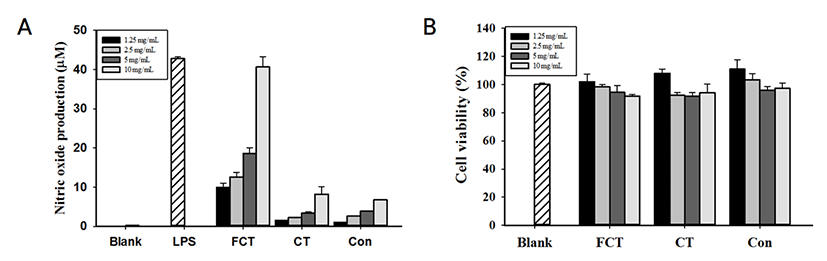
Control, CT와 FCT 비교 결과, FCT가 유의적으로 가장 높은 NO 생성량(40.63 μM)을 나타내었으며, 농도 의존적으로 증가하는 것을 확인하였다(Fig. 1). 10 mg/mL FCT의 NO 생성량은 5 ng/mL LPS(42.75 μM)를 처리한 군과 유사한 NO 생성량을 나타내었다. CT의 경우, 8.21 μM의 NO 생성량을 나타내었다. 세포활성의 경우, 10 mg/mL 부터 1.25 mg/mL 농도의 모든 샘플군에서 80% 이상의 세포활성을 나타내었다(Fig. 1B).
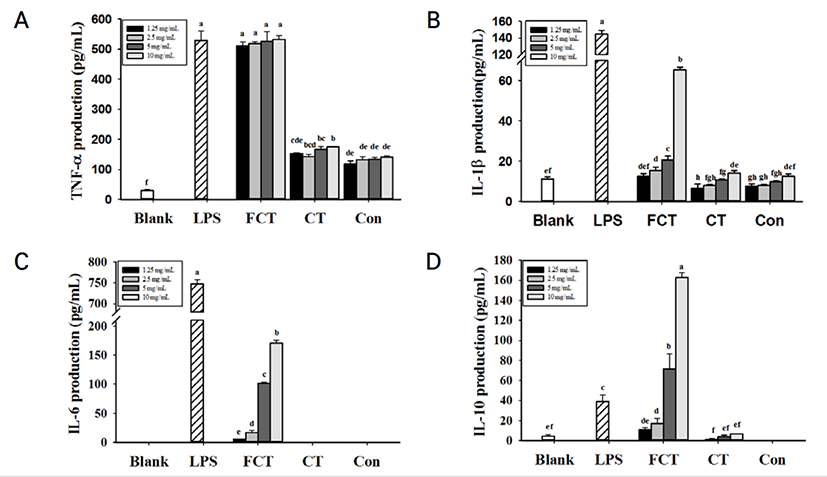
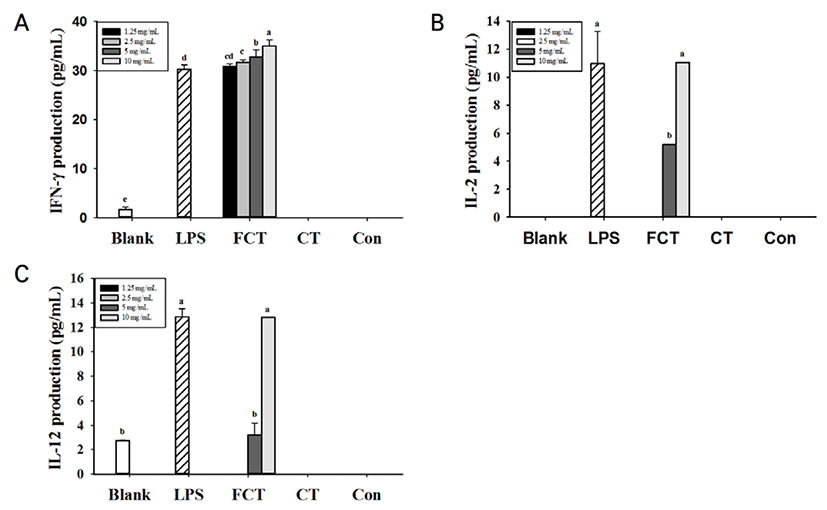
FCT를 처리한 RAW 264.7 cells에서 Control과 CT를 처리한 RAW 264.7 cells와 비교하여 TNF-α, IL-1β, IL-6 and IL-10 등의 사이토카인 생성량이 유의적으로 증가한 것을 확인되었다 (Fig. 2). 특히, FCT를 처리한 군에서 TNF-α와 IL-6의 생성량이 다른 사이토카인에 비하여 높은 생성량을 나타낸 것을 확인하였다. 그러나, CT를 처리한 군에서는 매우 낮은 농도의 사이토카인이 측정되었다. 10 mg/mL로부터 1.25 mg/mL의 Control과 CT를 모두 처리한 군에서는 IL-6이 검출되지 않았다. IL-10 생성량 측정 결과, FCT 10 mg/mL를 처리한 군에서 IL-10의 생성량(162 pg/mL)이 5 ng/mL LPS를 단독으로 처리한 군(39.1 pg/mL)보다 4배나 높게 발현된 것을 확인하였다. FCT를 처리한 군에서 농도 의존적으로 IFN-γ, IL-2, IL-12 분비가 증가한 것을 확인하였다(Fig. 3). 10 mg/mL 농도의 FCT는 5 ng/mL의 LPS를 처리한 군과 IFN-γ, IL-2와 IL-12 생성량을 비교하였을 때 유의적인 차이가 없는 것으로 확인되었다. 그러나 CT의 경우, IFN-γ, IL-2와 IL-12는 측정되지 않았다. IL-4의 경우, Control, CT, FCT에서 모두 검출되지 않았다.
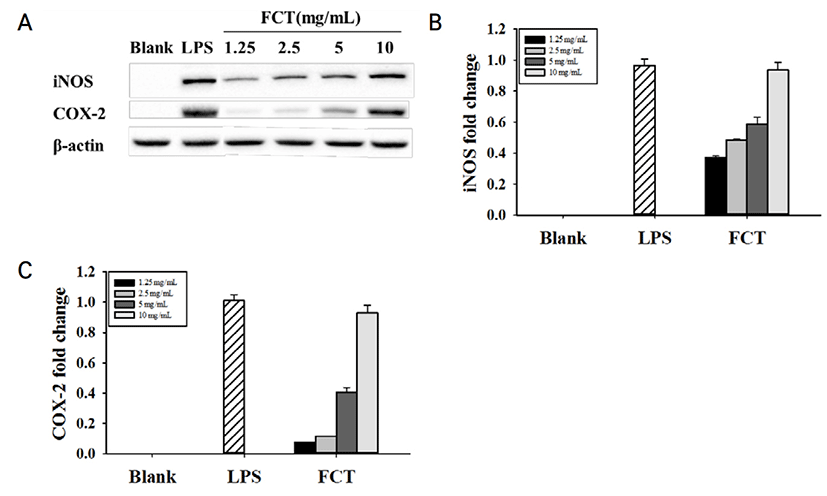
iNOS 및 COX-2와 같은 전 염증성 매개체가 염증 반응을 조절하는 중요한 역할을 한다. 전 염증성
매개인자의 단백질 발현을 평가하기 위해 RAW 264.7 cell에 Control, CT, FCT를 처리하였다.
Control과 CT에서는 iNOS와 COX-2의 단백질 발현이 측정되지 않았다. 하지만 FCT 10 mg/mL가 iNOS와 COX-2에서는 농도 의존적으로 단백질 발현이 확인되었다(Fig. 4). 10 mg/mL 의 FCT의 경우, iNOS와 COX-2 발현 정도는 5 ng/mL LPS와 유사하게 측정되었다. 이러한 결과로 볼 때, FCT는 RAW 264.7 cell의 세포 면역활성에 있어서 iNOS 및 COX-2 발현을 높게 증가시키는 것을 확인하였다.
고찰
염증 과정에서 대식세포는 외래 또는 감염 인자를 제거하고, TNF-α, IL-1β, IL-6, 산화 질소를 포함하는 성장 인자 및 염증 매개체의 방출을 방지하기 위해 방어 분자의 발현에 중요한 역할을 한다. 본 연구에서는 신바이오틱스 발효유의 면역증강 활성 정도를 LPS와 비교하여 NO, 면역조절 사이토카인의 발현을 통해 확인하였다.
NO는 선천면역의 대표적인 세포인 대식세포에 의해 생성되어 면역계에서 외부물질에 대한 방어작용을 하는 중요한 신호 전달 물질이다. 대식세포의 면역활성 정도를 확인할 수 있는 NO 생성량을 측정한 결과, CT의 경우, 10 mg/mL에서 Control과 차이가 미비하였다. 그러나 발효과정을 거친 FCT의 경우 유의적으로 가장 높은 NO 생성 활성을 보이는 결과를 통해 면역활성을 높인다는 것을 확인할 수 있었다. 더불어 농도 의존적인 활성을 보였으므로 활성의 제어가 용의할 것으로 사료된다.
면역 활동에 의한 사이토카인의 정략적 측정을 위해 본 연구에서는 ELISA를 실행하였다. CT의 경우, TNF-α, IL-1β, IL-10에서 Control과 비교하였을 때 생성량에 유의적이 차이가 있었으나, IL-6의 경우에는 발현되지 않았다. FCT의 경우, Control과 CT와 비교하였을 때, TNF-α, IL-1β, IL-6 등의 전 염증성 사이토카인을 유의적으로 가장 높게 증강시켰다. 전 염증성 사이토카인인 TNF-α, IL-1β 및 IL-6은 조직 손상의 발생(Tsai et al., 2012; Ma et al., 2015; Dwivedi et al., 2016 ) 및 전신성 염증 반응의 발달에 중요한 역할을 한다(Wei et al., 1995). TNF-α는 수지상세포를 성숙시켜 T 세포의 활성과 성장 등을 조절하며, 암세포의 살상 및 암 전이의 억제 작용 등의 항암작용을 나타낸다(Strieter et al., 1993; Kikuchi et al., 2003). IL-1β는 T세포의 활성화, B 세포의 성숙 및 NK 세포의 활성을 증가시키며, 암세포의 증식을 억제하는 활성을 가지고 있고, IL-6는 B 세포의 분화 촉진, 항체 분비 자극, Ig 생성 유도 및 T 세포의 분화 증식에 관여한다(Delgado et al., 2003). 따라서 FCT가 TNF-α, IL-1β, IL-6를 증강시킨 결과를 통해 면역반응을 조절하는 작용과 항암기능을 가지고 있을 것으로 사료된다.
Nitric Oxide Synthase(NOS)는 L-arginine이 L-citruline으로 변화되는 과정에서 면역계에서 외부물질에 대한 방어작용을 하는 중요한 신호 전달 물질인 NO를 생성한다(Nathan et al., 1992). NOS는 세포질 내 항상 존재하는 constitutive(cNOS)와 면역학적으로 변화에 의해 유도되는 inducible form(iNOS)이 있으며, 이 중 LPS와 사이토카인에 의해 NOS 유전자 발현이 유도되는 것은 iNOS이다(Vane et al., 1994). RAW 264.7 세포에서 FCT에 의한 iNOS의 발현 결과, 단백질 수준에서 FCT가 높은 발현을 나타내었다.
FCT는 또한 Treg로 Regulatory T helper cell로 알려진 IL-10에 대한 높은 발현 효과를 나타냈다. CT에서 IL-10의 발현은 매우 미비하게 측정되었으나, FCT의 경우 높은 수준의 발현을 나타내었다. IL-10은 Th1, Th2 및 Th17(Saravia et al., 2010) 및 Treg 세포(O’garra et al., 2004; Grazia et al., 2006; Chiba et al., 2010; Sabatos-Peyton et al., 2010; MacKenzie et al., 2014)에 의해 생성된다. IL-10은 전형적으로 IL-12를 저해하는 항 염증성 사이토카인이며, 결과적으로 Th 또는 Treg을 증가시키는 IFN-γ 생산을 억제한다. IL-10은 항원 제시를 낮추고, 대식세포 활성화를 억제하여 친 염증 분자 및 케모카인 생성 억제를 통해 면역활동을 조절한다(Tao et al., 2015). 이는 FCT가 CD8+ 및 CD4+의 T 세포의 억제로 이어질 수 있는 Treg의 발현을 증가시켜 면역 항상성을 균형 잡는 데 도움이 되는 것으로 사료된다(Raynor et al., 2012).
프로바이오틱스가 면역 기능에 미치는 영향을 일부 선행 연구에서 Th1 / Th2 또는 친 염증성 혹은 항 염증성 사이토카인 밸런스에 중점을 두어서 연구를 진행해 왔다(Singh et al., 1999). 전 염증성 사이토카인은 Th1 세포를 생성하는데, 이는 주로 세포 내 병원균에 대한 방어 및 Th2 항 염증 반응의 불균형인 과민반응에 대응한다. 항 염증성 사이토카인은 Th2를 생성하는데, 이는 세포 외 병원균에 대한 보호를 한다고 알려져 있다(Kidd, 2003). 그러므로, 효소 반응(Th1 / Th2) 사이의 균형이 매우 중요하다. 일부 연구에 따르면 프로바이오틱스는 특정 T 세포와 관련된 면역 조절 억제를 예방하는 특정 면역 반응을 촉진하기 위해 사이토카인 균형을 유리하게 조절한다고 알려져 있다(Bermudez-Brito et al., 2014). 특히, 프로바이오틱스 중에서도 락토바실러스는 면역 체계 균형을 조절하는데 매우 중요한 역할을 한다(Jorjão et al., 2015). 또한, 락토바실러스는 Treg인 IL-10 생산을 유도하며, Th1 반응을 억제하여 과도한 조직 손상을 일으킬 수 있다. 본 연구에서 사용한 L. gasseri 505의 경우, 이전 연구에서 꾸지뽕잎 추출물과의 발효과정 중 항산화 활성 및 기능성 펩타이드를 생성이 우수한 것으로 밝혀졌다(Oh et et al., 2016). 이는 단순히 CT로 인한 효과가 아닌 FCT 즉, 꾸지뽕잎 추출물과 L. gasseri 505 의 발효 대사 과정에서 발생한 기능성 펩타이드에 의한 면역 활성 조절 능력이 향상된 것으로 판단된다.
결론적으로, 본 연구에서는 프리바이오틱스 소재인 꾸지뽕 잎 추출물과 L. gasseri 505의 발효물이 염증 조절에 있어 높은 활성을 갖는 것을 확인하였다. 전 염증성 사이토카인인 TNF-α, IFN-r, IL-1β, IL-2, IL-6와 Treg로부터 분비된 IL-10은 단백질 수준에서 FCT가 가장 높은 발현을 나타내었다. 또한, iNOS 및 COX-2와 같은 염증 매개인자도 FCT에서 농도 의존적으로 가장 높은 발현을 나타내었다. 따라서, 꾸지뽕잎 추출물과 L. gasseri 505로 발효한 신바이오틱스는 향후 식품 및 유가공 산업에서 면역조절 기능성 유제품으로서의 활용 가능성이 높을 것으로 사료된다.
