서 론
생균제(Probiotic)란 살아있는 미생물 균체를 섭취함으로써 미생물이 분비하는 효소, 유기산, 비타민 및 무독성 항균물질 등에 의한 장내 균총의 정상화는 물론 장질환 치료를 통해 신체기능 개선을 목적으로 생산된 제품을 말한다(Rivero-Perez et al., 2008). 생균제의 종류로는 유산균(Lactobacillus)과 진균(곰팡이, Aspergillus, 효모, Saccharomyces) 등이 일반적으로 널리 알려져 있는데 이 중 가장 대표적인 것으로 Lactobacillus(Lee et al., 2008)를 들 수 있다. 젖산균은 복잡한 필요 영양 조건을 가지고 있으며, 프로바이오틱스 또는 발효식품에 이용된다. Lactobacillus 및 Bifidobacteria와 같은 유산균은 한 가지 이상의 종만으로도 장내 균총에 직접 영향을 미칠 뿐만 아니라, 면역조절, 장투과성, 생체활성 또는 신진조절 대사산물을 생성함으로써 다른 장기에 영향을 미친다(Khanizadeh et al., 2008; Lee et al., 2008; Li et al., 2012). 또한, Hood와 Zittola(1998), MaFarland(2000), Kullisaar 등(2003)은 유산균은 활성산소로부터 자신을 보호할 수 있는 항산화 활성을 가지고 있다고 보고되었는데, 이미 Wagner 등(1999)과 Delzenne 등(2011)은 Lactobacillus sp. SBT 2028과 L. fermentum strain ME-3 등 여러 유산균의 높은 항산화 효과가 보고되었다.
2002 FAO/WHO의 지침에 따르면, 박테리아가 일반적으로 안전하다고 인정될지라도, 잠재적인 probiotic에 최소한으로 요구되는 안전성 실험으로 항생제 내성, 특정 대사활동, 내산성 및 담즙산 내성, 장 부착능력, 병원균에 대한 길항작용 및 저장성 실험 등을 공시하고 있다(Jun, 1998; Rial, 2000; Salminen, 2001). 균주선발에 있어서는 독립된 균주의 섭취보다는 혼합 균주를 사용함으로써 여러가지의 건강 기능성 및 프로바이오틱 효과를 낼 수 있는 장점이 있는데, 이는 혼합 균주를 배합하여 환자의 장 건강에 최적화시켜 장 기능 개선과 면역력 증진을 증대시킬 수 있는 맞춤형 프로바이오틱스를 구축할 수 있는 장점이 있다.
따라서 본 연구에서는 베트남인 분변으로부터 내산성, 내담즙산성 등 기초생리활성 능력이 우수한 유산균 6종을 선발하고, 항산화 효과(DPPH, ABTS, FRAP assay)를 검증하여 베트남인으로부터 최종 선발된 L. acidiphilus V4, L.plantarum V7 2종과 김치유래 유산균인 L. paracasei DK121 1종 간의 열 안정성, Mucin 장내부착능 등 균주간 혼합도를 통해 프로바이오틱으로서의 개발 가능성을 상용균주와 비교하였다.
재료 및 방법
유산균의 배양 및 보관에는 MRS 배지(Difco Co., Detroit, MI, USA)와 glycerol(Sigma, Germany)을 사용하였다. 당 발효성에는 API 50 Kit(biomerieux, France), 내산성 및 내담즙성에는 Pepsin (Sigma, Germany), Bacto oxgall(Difco, USA), 항산화실험에는 6-hydroxy-2,5,7,8-tetramethyl chroman-2-carboxylic acid (Trolox), 2,2-Diphenyl-1-picrylhydrazyl(DPPH), 2,2’-azino- bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS), trichloroacetic acid, 2,4,6-tripyridyl-s-triazine, FeCl3․6H2O (Iron(Ⅲ) chloride hexahydrate 97% A.C.S reagent) 등은 Sigma- Aldrich Co.(ST. Louis, MO, USA)로부터 구입하였고, Mucin solution (Sigma, USA)을 구입하여 사용하였다.
실험에 사용된 시료는 삼성서울병원에서 IRB 승인을 받은 한국에서 거주 중인 6개월 미만의 성인 베트남인 60명의 남녀로부터 분변을 혐기적으로 채취하였다. 적당량의 분변을 취하여 멸균 혐기 희석액으로 십진희석한 희석액을 MRS 한천평판배지(Difco, Detroit, USA)에 도말 접종한 다음 37℃에서 48시간 배양하여 MRS 한천평판배지상에 나타는 유백색의 단일 콜로니를 백금이로 취하여 0.05% L- Cystein이 함유된 MRS 액체배지에 순수 분리하고, 수 회 계대 배양 후 얻어진 약 150여 균주를, 15%(v/v) grycerol에 현탁하고 –72℃에서 보관하여 실험에 사용하였다.
분리 균주의 동정을 위하여 일차적으로 형태학적, 생화학적 특성을 조사하였으며, 16s rRNA 유전자 염기서열을 분석하였다. 형태학적 특성은 그람염색 후 현미경으로 관찰하였으며, 생화학적 특성 조사는 API 50 Kit(biomerieux, France)를 이용하여 37℃에서 48시간 배양 후 실시하였고, 실험 결과는 Bergey’s manual과 API LAB PLUS 프로그램(API50 CHL, biomerieux, France)으로 비교 분석하였다. 유전학적 동정을 위한 16S rRNA sequencing은 유니버설 프라미어(universal primer)인 27F와 1492R을 이용하여 16S rRNA 유전자 부분을 증폭하여 DNA 서열분석(Magrogen㈜, Korea)을 의뢰하여 확인하였다.
내산성 시험은 Hood와 Zottola(2009)의 방법을 변형하여, MRS 액체배지에서 18시간 배양한 균주를 4,350×g로 15분간 원심분리하여 상징액을 제거한 후, pH 1.5, 2.0, 3.0으로 각각 조절한 MRS 액체배지에 초기 균수가 107 CFU/g이 되도록 시험균을 접종하고, 37℃ incubator에서 2시간 동안 배양 후 생균수(CFU/g)를 측정하였다. 내담즙성 실험은 내산성 시험 이후 연속성 실험을 위하여 Bacto oxgall(Difco Co., USA)의 농도를 0.3%(w/v)가 되도록 첨가하여 배양하고, 37℃ incubator에서 24시간 배양 후 다음과 같은 방법으로 측정하였다.
생존율 (%) = [생존 균수(CFU/g)/초기 균수(CFU/g)]×100
선발 유산균의 항산화 활성 측정을 위한 전처리 방법에는 Lin과 Chang (2005)의 방법을 이용하여, Lactobacilli MRS broth 배지에 접종하여 37℃에서 18시간 간격으로 3회 계대배양한 배양액을 3,000×g에서 10분간 원심분리하여 상등액을 제거한 후 PBS buffer 용액으로 2회 세척 및 현탁하여 사용하였다.
DPPH 라디칼 소거활성을 측정하기 위해 Rivero-Prez M.D 등(1993)의 방법을 일부 수정하여 실험을 수행하였다. 2,2-Diphenyl- 1-picrylhydrazyl(DPPH, Sigma, U.S.A) 시약 7.8 mg을 100 mL 에탄올에 녹여 제조하여 사용하였고, DPPH 용액 1 mL에 에탄올 50 μL와 유산균 전처리 샘플 100 μL를 혼합한 후 37℃에서 30분간 암실에서 반응 후 515 nm에서 uv/vis spectrophotometer(X-ma 1200, Human corp., Korea)를 이용하여 흡광도를 측정하였다.
ABTS 라디칼 소거활성의 측정은 Cho 등(1996)의 방법을 일부 수정하여 실험하였다. 7.4 mM ABTS stock solution(Sigma, USA) 5 mL와 2.6 mM potassium persulfate(Sigma, USA) 5 mL를 섞은 뒤 암실에서 24시간 반응시킨 뒤 실험에 앞서 734 nm 흡광도에서 0.700±0.020 (mean±SE)이 되도록 phosphate buffered saline (pH 7.4)으로 조정한 뒤 조정된 시약 0.9 mL에 유산균 전처리 샘플 0.1 mL를 혼합한 후 암실에서 3분간 반응시킨 뒤 734 nm에서 흡광도를 측정하였다.
Ferric ion reducing antioxidant power(FRAP) 활성은 Fe (Ⅲ)-2,4,6-tripyridyls-triazine(TPTZ)가 항산화 물질에 의해 Fe(Ⅱ)-TPTZ로 환원되는 원리를 이용하여 분광법으로 측정하는 방법으로 Shahrokh의 방법(2008)을 일부 수정하여 실험하였다. 300 mM acetate buffer (pH 3.6) (Sigma, USA) 50 mL와 10 mM 2,4,6-tripyridyl-s-triazine (TPTZ, in 40 mM HCL) (Sigma, USA) 5 mL, 20 mM FeCl3․6H2O (Iron(Ⅲ) chloride hexahydrate 97% A.C.S reagent) (Sigma USA) 5 mL를 혼합하여 제조하여 사용하였다. FRAP 용액 1.2 mL에 증류수 20 μL와 유산균 전처리 샘플을 40 μL를 혼합하고, 37℃ 암실에서 30분간 반응시킨 후 593 nm에서 흡광도를 측정하였다.
MRS 액체배지에서 18시간 간격으로 3회 계대 배양한 배양액을 초기 균수가 107 CFU/g이 되도록 시험균을 접종하여 각 온도별(37~ 65℃), 시간별(5분, 15분)로 각각 열처리한 다음, 생균수를 측정하여 생존율[(실험구의 Log지수값/대조구의 Log지수값)×100]을 측정하였다.
장내 부착능 측정은 Azcarate-Peril(2002)의 방법을 통해 mucin protein을 이용하여 수행하였다. Mucin solution(10 mg/mL in H2O)(Sigma, U.S.A)을 96 well plate(SPL, Korea)의 각 well에 100 μL씩 분주하여 4℃에서 12시간 동안 반응시켜 mucin을 well 표면에 부착시켰다. 이후 plate의 각 well을 0.85% NaCl로 2회 세척하였다. 선발 균주는 MRS 액체배지에서 37℃, 18시간 동안 3회 계대배양한 배양액을 8,000×g로 2분간 원심분리하여 상징액을 제거하고, 0.85% NaCl로 2회 세척 및 현탁하여 연속희석을 실시하여 각 well에 1.0×107 CFU/g 수준으로 100 μL씩 분주하고 37℃에서 2시간 동안 반응시켰다. 반응하지 않은 균체의 제거를 위해 상등액을 제거한 후, 0.85% NaCl로 각 well을 5회 세척하고, 0.1% triton X-100을 분주하여 mucin에 부착된 균체를 회수한 후 0.85% NaCl에 십진희석하여 MRS agar plate에 3반복으로 plating하고, 37℃에서 24시간 배양 후 생균수를 측정하였다. 대조군으로 상용균주인 L. plantarum LP와 L. acidophilus La-5를 사용하였다.
결 과
37℃ MRS 배지에서 48시간 배양후 나타난 유백색의 단일 colony를 취하고, 그람양성의 간균인 13개의 균주를 선별하여 1차적으로 형태적인 분류를 하였다. 유산균의 생화학적 특성조사를 위해 API 50 CHL kit(Biomerieux, France)를 이용하여 당 발효성을 분석하였다(Table 1). 선발한 유산균 6종에 대한 탄수화물의 발효성을 분석한 결과, L. acidophilus 2종, L. plantarum 3종, L. paracasei 1종으로 동정되었다.
선발한 유산균 6종에 대한 동정은 Basic Local Alignment Search Tool(BLAST)을 사용하였으며, 유산균의 16S rRNA를 추출하여 동정한 결과는 Table 1로 나타내었다.
유산균의 당 발효성과 16S rRNA sequencing의 동정결과, V9 균주는 당 발효성에서 L. paracasei로 동정되었으나, RNA 염기서열에서는 L. plantarum으로 동정되었고, V11 균주는 당발효성에서 L. acidophilus로 동정되었으나, RNA 염기서열에서는 L. plantarum으로 동정되었다.
유산균이 살아있는 상태로 장내에 도달하기 위해서는 위와 장의 pH 2~8 범위에서 생존할 수 있어야 한다(Hood, 1998). 내산성 실험의 경우, 사람 위의 pH인 1.5~3.0 범위에서 대부분의 미생물이 사멸하거나 활성이 저하된다. 베트남인 분변에서 선발한 균주를 pH 1.5, 2.0, 3.0로 조정하고 pepsin(1,000 unit/mL)을 첨가한 인공위액 조건에서 2시간 처리하여 생균수를 측정하였으며, 상용균주인 L. plantarum LP를 대조구로 사용하였다. 그 결과, V10의 pH 1.5 조건을 제외한 균주들이 상용균주와 비슷한 생존율을 유지하여 높은 내산성을 나타내었다(Fig. 1(A)). 내담즙성 실험에는 유산균이 위를 통과하여 장으로 이동되는 것을 고려하여야한다(Rial, 2000).
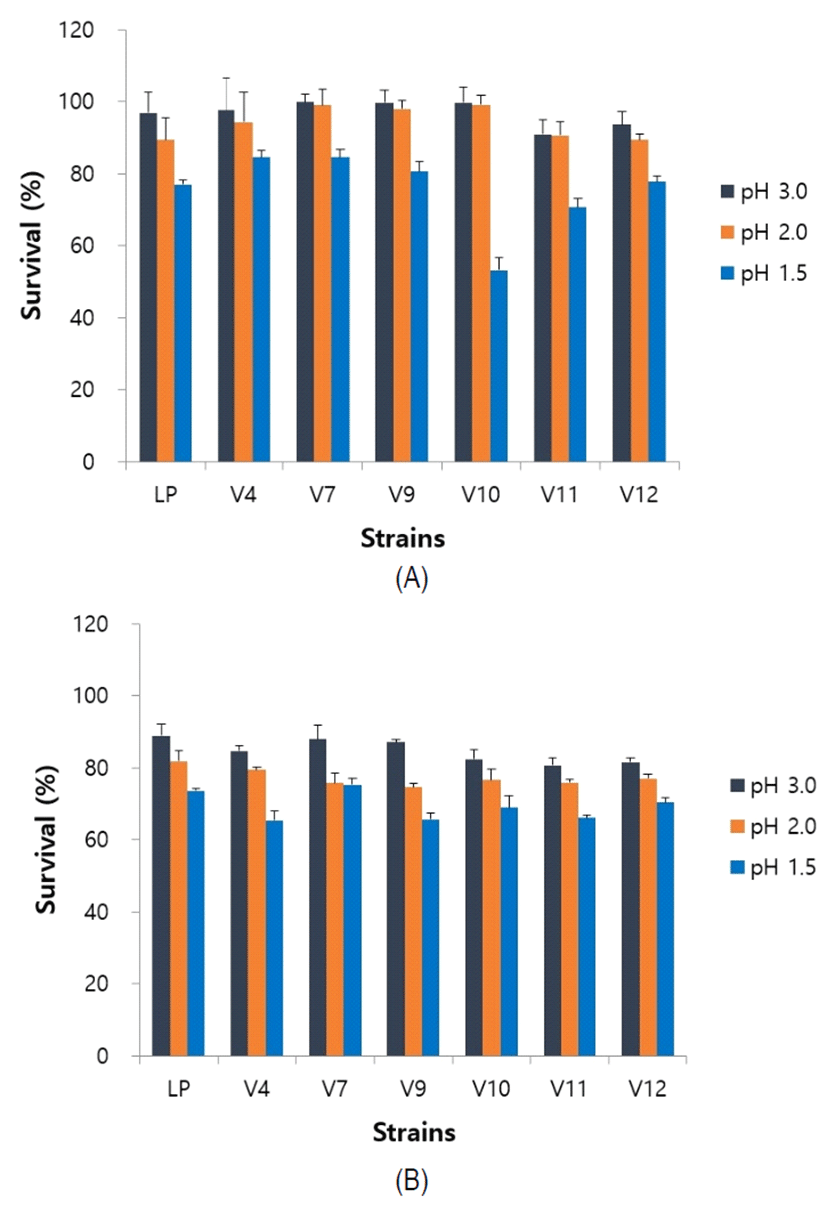
내산성 실험 이후 동일 조건하에 인공 위액에서 2시간 처리한 후, 동량의 0.3% oxgall을 첨가한 인공위액이 함유된 배지에서 인공 담즙액을 24시간 처리한 결과, Fig. 1(B)에 나타난 바와 같이 pH 1.5 조건에서는 생존율이 70% 미만으로 나타났으나, V7의 경우 상용균주와 비교하였을 때 75% 이상을 유지하였다. 따라서, 본 연구에서 분리한 6종의 균주들은 상용균주와 비교하였을 때, 높은 내산성 및 내담즙성이 우수하여 생균제로서의 가치가 충분할 것으로 판단되었다.
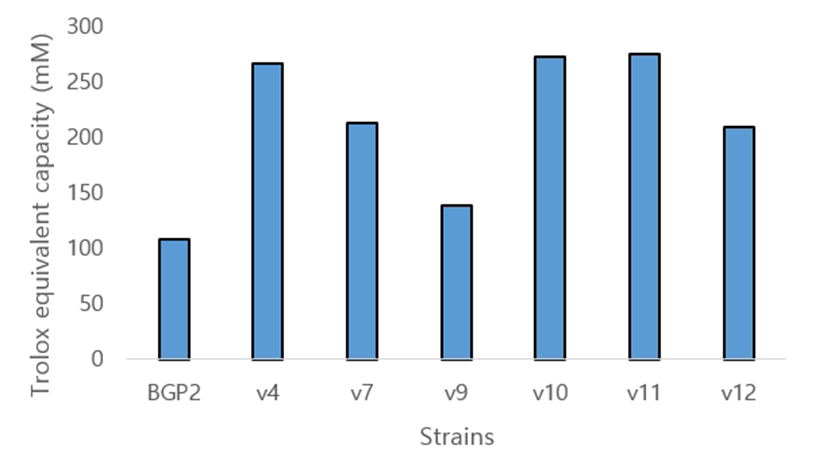
베트남인 분변에서 분리된 6종의 유산균들의 DPPH radical 소거 활성을 측정한 결과는 Fig. 2와 같다. 분리된 6종의 유산균은 모두 대조구인 L. paracasei BGP2보다 높은 활성을 보였고, 특히 L. acidophilus V4와 L. plantarum V10, V11 세 종의 유산균에서 높은 항산화 소거능을 나타내었다. Cho 등(2009)은 김치에서 분리한 L. plantarum YS712 균주가 Enterococcus sp.와 Lactococcus sp.에 비해 95.8%로 가장 높은 radical 소거능을 나타내었다고 보고한 바 있다.
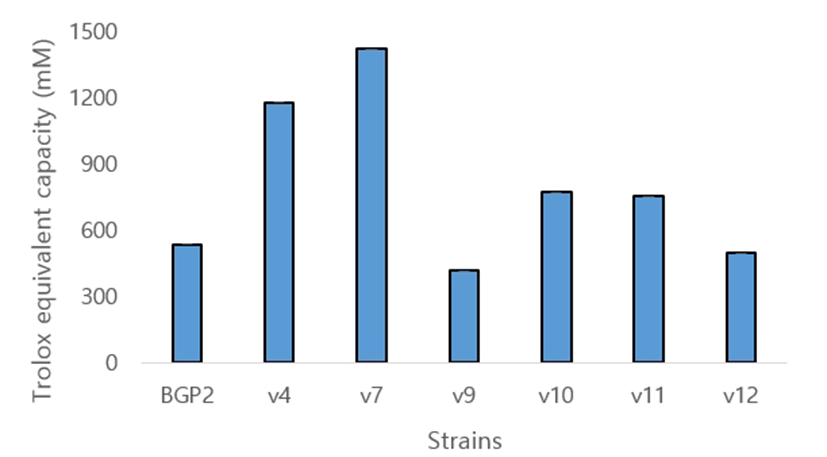
ABTS radical 소거능을 측정한 결과는 Fig. 3과 같다. 상용균주인 L. paracasei BGP2보다 V7의 활성이 가장 높게 나타났으며, V4 또한 높은 소거 활성을 나타냈다. 다음으로 V9와 V12는 가장 낮은 소거 활성을 나타냈다.
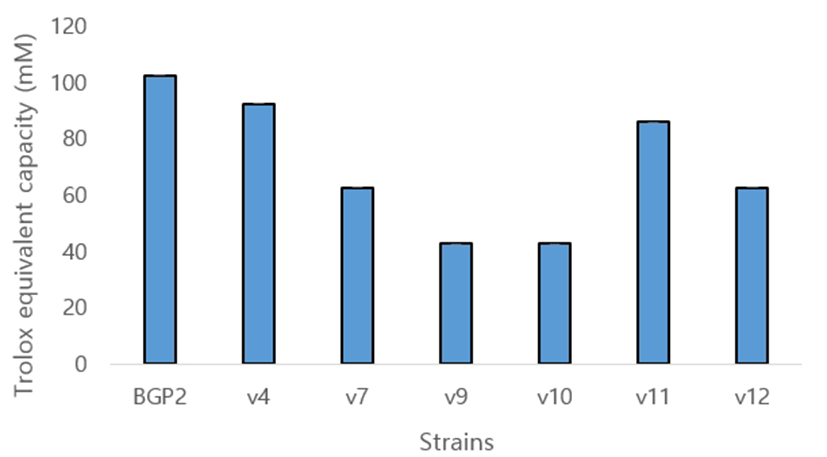
FRAP 활성 분석 결과에서는 6종의 유산균 모두 상용균주인 L. paracasei BGP2보다 전반적으로 낮은 라디칼 소거능을 나타내었다. 유산균은 활성산소로부터 자신을 보호할 수 있는 항산화 활성을 보이는 것으로 알려져 있다. 또한, 유산균의 세포막에 존재하는 teichoic acid와 세포벽에 존재하는 peptidoglycan 등은 주로 금속이온 chelating, free radical의 소거, 그리고 환원작용 등이 복합적으로 관여하여 나타나는 것으로 보고되고 있다(Lonkar et al., 2005). 따라서, 이들의 기능이 본 연구를 통해 선발된 6종의 항산화 활성에 영향을 끼친 것으로 보인다.
선발된 유산균 6종 중 항산화 활성 능력이 우수한 L. acidophilus V4, L. plantarum V7 2종과 단국대학교 천안캠퍼스 우유신소재 실험실에서 분리하여 보유 중인 L. paracasei DK121과의 복합생균제로서의 내열성을 실험하기 위해 V4, V7, DK121을 5:4:1(v/v)로 혼합하여, 각각 55, 65℃에서 5, 15분씩 열처리하여 대조구(37℃)와 생균수를 비교하면, 55℃에서 5분 97.0%, 99.8%, 99.5%, 98.6% 15분 94.1%, 94.1%, 72.2%, 76.4%, 65℃에서 5분 84.4%, 73.2%, 78.3%, 66.0%, 15분 73.6%, 65.3%, 64.1%, 63.8% 등의 생존율을 나타냈다(Fig. 5).
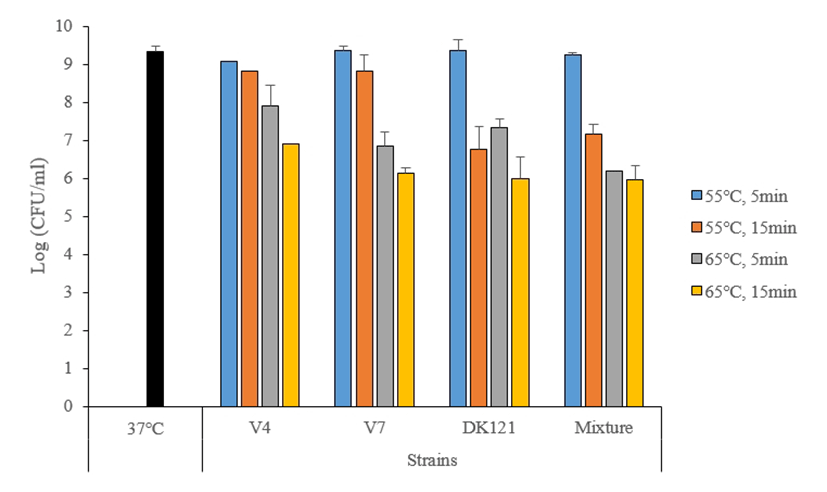
Chae 등(2014)은 균주선발에 있어서는 독립된 균주의 장점보다는 혼합균주에 사용에서 기대되는 여러 가지의 기능성을 목적으로 혼합균주를 사용하여 기존의 연구들과 차별화를 두었는데, 본 실험에서의 혼합균주 내열성 결과가 단독균주에 비해 낮아 생균제로서 상업적 가치가 낮다고 판단되었다. Jung 등(1993)은 일반적으로 유산균 제제의 가공 과정에서 가장 문제가 되는 것이 미생물의 안정성과 더불어 보존성이라 보고하였는데, 향후 생균제 균주는 내열성과 안정성을 갖는 미생물의 발굴 필요성이 제기됨에 따라 본 연구를 통해 시도되었던 혼합균주 또한 균주 자체의 안정성을 유지시키며, 다양한 기능적인 측면들에 부합하는 복합유산균제제의 개발이 필요할 것으로 생각된다.
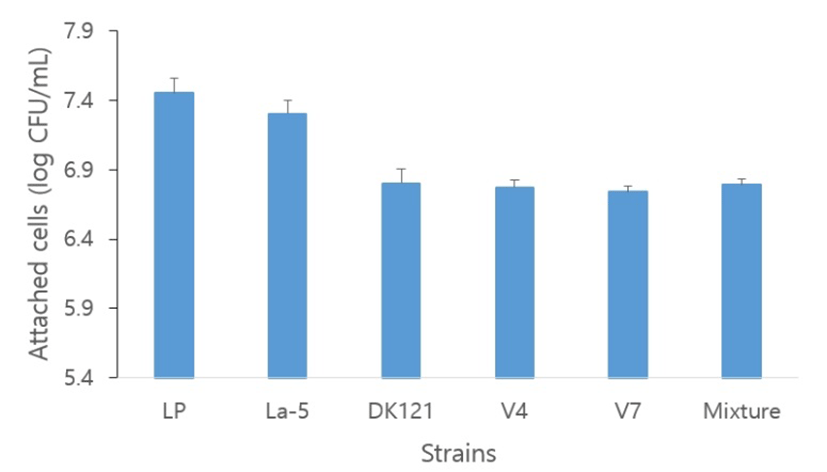
항산화 실험 결과를 통해 베트남인 분변으로부터 분리된 선발균주 V4, V7과 한국전통식품으로부터 분리한 유산균 L. paracasei DK 121과의 혼합균주 가능성을 조사하기 위해 mucin binding assay를 이용하여 mucin에 대한 결합능을 측정하였다. 대조군인 L. plantarum LP와 L. acidophilus LA–5의 부착된 생균수를 기준으로 장내 부착능을 비교하였다. Fig. 6에 나타난 바와 같이, 선발균주 및 혼합균주간의 부착능은 대조군에 비해 낮았지만, 실험에 사용된 상용균주 및 혼합균주 모두 6.4 log CFU/g 이상으로 우수한 결합능을 나타내었다.
요 약
본 연구에서는 베트남인의 분변으로부터 분리한 유산균의 probiotics 특성을 연구하기 위해 형태학적, 생화학적 특성조사 및 내산성, 내담즙성이 뛰어난 6개의 균주를 선별하고 동정하였다. 6개의 균주의 16S rRNA 분석 결과, L. acidophilus V4, L. plantarum V7, V9, V10, V11, V12의 2개 group으로 동정되었다. 베트남인의 분변으로부터 분리한 유산균은 pH 1.5, 2.0, 3.0의 산성 및 담즙산(0.3% oxgall) 조건에서 내산성과 내담즙성을 측정한 결과, V4, V7, V9, V11, V12의 5개 균주에서 70% 이상의 우수한 내산성과 내담즙성을 확인하였다. 항산화 활성에서는 V4, V7이 상용균주인 L. paracasei BGP2와 비교하였을 때, 높은 항산화 활성을 보여 최종 2종을 한국전통식품으로부터 분리한 L. paracasei DK121와의 혼합균주 가능성을 알아보았다. 열 안정성 실험에서 V4, V7, DK121을 5:4:1(w/v)로 혼합한 혼합균주는 55℃에서 5분 98.6%, 15분 76.4%, 65℃에서 5분 66%, 15분 63.8%로 단일균주보다는 낮은 생존율을 보였지만, 향후 적합한 혼합도간 연구를 통해 프로바이오틱 균주로서 충분한 가능성을 보여주었다. 장내 부착능에서는 선발균주 및 혼합균주 모두 상용균주와 비교했을 때 6.4 log CFU/g 이상으로 우수한 결합능을 보여 향후 내열성과 안정성을 갖는 우수한 균주라고 판단된다.
