서론
지금으로부터 약 100년 전에 러시아 과학자 Metchnikoff(1907)가 유산균에 의한 불로장수설을 발표한 이래 인류건강과 관련하여 유산균의 연구가 많이 발표되었다. 유산균은 치즈, 버터밀크, 발효유와 같이 발효유제품과 많은 발효식품에 이용되고 있다. 발효식품에 유산균의 역할은 식품의 풍미, 질 및 유통기한에 기여하는 lactic acid, carbon dioxide, dioxide 그리고 acetoin을 생성한다. Fuller(1989)는 probiotics이라는 용어를 처음으로 제안하였으며, 정의는 적당량 섭취하였을 때 인체의 건강에 이익을 주는 살아있는 미생물의 총칭으로 있다(FAO/WHO, 2002). Probiotics는 장내 생존율과 생리기능이 우수한 유산균으로서 Lactobacillus 및 bifidobacteria을 이용한 발효유와 생균제제로써 많이 이용되고 있다. 이러한 probiotics 균종은 장내균총의 균형을 개선하여 변비의 개선과 부패물질의 감소 등을 일으켜 정장작용을 하는 것으로 알려져 있다(Link-Amster et al., 1994; Spanhaak et al., 1998). 그리고 probiotics는 장 염증환자와 위장장해를 가진 사람에게 매우 효과적이라고 보고되었다(Nishitani and Mizuno, 2010). 그러나 probiotics는 우리가 흔히 접하는 유산균음료 또는 생균제제로서 제공되며, 장내에 도달하더라도 이들의 생존을 위한 영양소가 공급되지 않으면 사멸하고 만다. 따라서 장내에 존재하는 유산균과 공급된 유산균의 생존을 위하여 공급되는 물질이 필요한데, 이를 prebiotics라고 한다(Gibson and Roberfroid, 1995). 즉, 식이섬유, 올리고당, 흡수되지 않는 당류 등이 장내 미생물의 성장에 영향을 주는데, 이와 같이 인체에 유익한 장내미생물의 성장을 도와주는 성분들을 말한다. Lactobacillus와 bifidobacteria는 이들 prebiotics들을 잘 이용하는 것으로 알려져 있다(Kaplan and Hutkins, 2003; Huebner et al., 2007). Lactoferrin과 transferrin도 prebiotics로서 가능성도 제시되고 있다(Kim et al., 2004). Lactoferrin은 우유에서 발견되는 철 결합성 당단백질로 알려져 있다(Groves, 1960). Lactoferrin은 젖, 침, 눈물, 콧물 및 질 등에서도 존재한다(Masson et al., 1966). 생리적 기능으로는 항균작용, 항바이러스작용, 면역기능, 항염증반응, 항암작용, 세포생장 작용 및 bifidobacreia에 대한 생장촉진효과 등이 알려져 있다(Shimazaki, 2000). Lactoferrin의 분자량은 약 80,000으로 철과 결합하지 않았을 때는 무색이지만 철과 결합하면서 붉은색을 띤다. 때문에 최초로 발견되었을 때는 붉은 단백질(Red protein)이라고 불렸다(Sørensen and Sørensen, 1938). 한편, transferrin은 인체의 혈청 속에 흡수된 2분자의 Ⅲ가 철 이온과 결합하여 세포증식이나 헤모글로빈 생산에 필요한 철을 세포내에 운반하는 혈장단백질이다(Yang et al., 1984).
Lc. lactis subsp. cremoris FC는 카스피 해 요구르트의 명칭으로 강한 점성을 가지는 것을 특징으로 하는 코카커스 지방 유래의 발효유로부터 분리된 균주로 있다(Macura and Townsley, 1984). 카스피해 요구르트의 특징인 향미와 점성 등은 Lc. lactis subsp. cremoris FC에 의한 것이라고 하였다(Smit et al., 2005). Lc. lactis subsp. cremoris는 주로 요구르트, 버터 및 경질치즈에서 많이 사용되고 있다. Lc. lactis subsp. cremoris FC는 조건적 혐기성균, 그람양성 구균으로 상온 30℃에서 증식한다. 일반적으로 Lacococcus속은 대부분이 젖 유래로 있으며, 장내생존성이 낮은 것으로 보고되어 있기 때문에 사람의 건강에 대한 연구가 매우 부족하였다. 그러나 Lactococcus속 유산균 중에서도 장내 생존성이 우수한 것이 존재한다고 보고되었다(Kimoto et al., 1999, 2003). 특히 Lc. lactis subsp. cremoris가 생산하는 점성 다당체가 생체에서의 생리작용을 가지는 것이 보고되었다(Nakajima et al., 1992).
본 연구는 Lc. lactis subsp. cremoris FC에 있어서 lactoferrin group(native-lactoferrin, apo-lactoferrin, 그리고 holo-lactoferrin)과 transferrin group(apo-transferrin과 holo-transferrin)의 첨가가 생장에 미치는 영향을 알아보기 위하여 수행하였다.
재료 및 방법
Bovine lactoferrin은 모리나가유업(Zama, Japan)으로부터 공급받았다. Apo-와 holo-lactoferrin은 이전 보고된 Shimazaki and Hosokawa(1991)의 방법에 따라 제조하였다. 즉, native lactoferrin을 0.1 M citric acid(pH 2.0)에 24시간 동안 투석시킨 후, 다시 증류수에 48시간 투석하였다. 그리고 난 후 0.05M NaCl을 함유한 0.05 M phosphate buffer(pH 6.5)에 투석하였다. 얻어진 용액은 동결 건조하여 apo-lactoferrin을 얻었다. 한편, holo-lactoferrin은 apo-lactoferrin을 0.05 M sodium bicarbonate citric acid (pH 7.5)에 용해 후, iron(Ⅲ) ammonium citrate를 투여하고, 37℃에서 일정시간 정치하였다. 그리고 0.01 M phosphate buffer로 평형화된 heparin-sepharose에 용액을 통과시킨 후 0.01 M phosphate buffer를 이용하고 용출하여 holo-lactoferrin을 얻었다. 한편, apo-transferrin과 holo-transferrin은 Sigma(USA)로부터 구입하여 실험에 이용하였다.
Lc. lactis subsp. cremoris FC는 Caspian Sea Yogurt로부터 분리한 균주를 시험에 이용하였다. Lc. lactis subsp. cremoris FC의 활성촉진을 위한 예비배양배지는 De Man, Rogosa and Sharpe (MRS) broth(Difco, USA)를 사용하였다. 그리고 시험구에 접종량은 1%로 하였다. 한편, lactoferrin과 transferrin 첨가 생장효과를 측정하기 위한 배지는 MRS broth 영양을 1/5의 농도로 낮게 조절하여 첨가물의 활성 여부를 측정하였다. Lactoferrin group(apo-, holo-, native-)과 transferrin group(apo-와 holo-)은 멸균된 증류수에 일정 농도로 용해하여 0.22 μM syringe filter (Advantec, Japan)를 이용하여 멸균하였다. 멸균된 각각의 준비된 1/5농도의 MRS 배지에 lactoferrin group(apo-lactoferrin, holo-lactoferrin, native-lactoferrin)과 transferrin group(apo-transferrin와 holo-transferrin)을 4, 2, 1, 0.5, 0.25 mg/mL의 농도로 첨가하였다.
Lc. lactis subsp. cremoris FC의 활성촉진을 위한 예비배양은 멸균된 MRS broth에 접종하여 30℃ 배양기에서 24시간 호기 배양하였다. Lactoferrin과 transferrin의 첨가에 의한 생장촉진 여부는 96-well microplate법을 이용하여 확인하였다. 96-well microplate법은 각 well에 준비된 native-lactoferrin, apo-lactoferrin, holo-lactoferrin, apo-transferrin, 그리고 holo-transferrin을 4, 2, 1, 0.5, 0.25 mg/mL의 농도로 첨가하였고, 1/5 농도의 MRS broth를 넣어 최종 200 μL가 되도록 하였다. 그리고 예비 배양된 Lc. lactis subsp. cremoris FC를 1% 접종하였다. 그리고 30℃ 배양기에서 18시간동안 호기 배양하면서 3시간마다 MPR-A4i microplate reader를 이용하여 660 nm의 흡광도로 생육 여부를 측정하였다.
결과 및 고찰
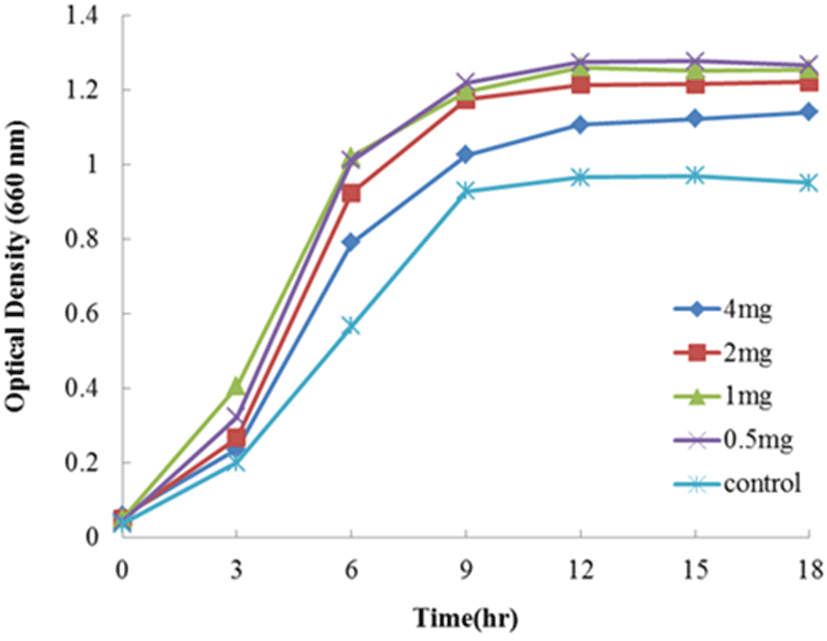
Lc. lactis subsp. cremoris FC의 생장에 대한 lactoferrin group과 transferrin group의 첨가에 대한 결과는 Fig. 1∼5에 나타내었다. Fig. 1은 1/5 농도의 MRS 배지에 native-lactoferrin을 농도 4, 2, 1, 그리고 0.5 mg/mL를 첨가하여 Lc. lactis subsp. cremoris FC의 생장을 측정한 결과이다. 대조구(무첨가구)와 비교하여 native-lactoferrin을 첨가한 모든 시험구는 생장의 촉진을 나타내었다. 첨가 시험구 중 가장 현저한 생장을 보여준 농도는 1 mg/mL였으며, 다음으로는 0.5 mg/mL를 첨가한 시험구이었다. 그러나 native-lactoferrin의 첨가량이 높은 시험구인 농도 2와 4 mg/mL는 오히려 농도 1 mg/mL 첨가한 시험구보다 생장이 미비하였다. 따라서 Lc. lactis subsp. cremoris FC의 생장 촉진에 현저한 영향을 미치는 native-lactoferrin의 농도는 1 mg/mL이었다.
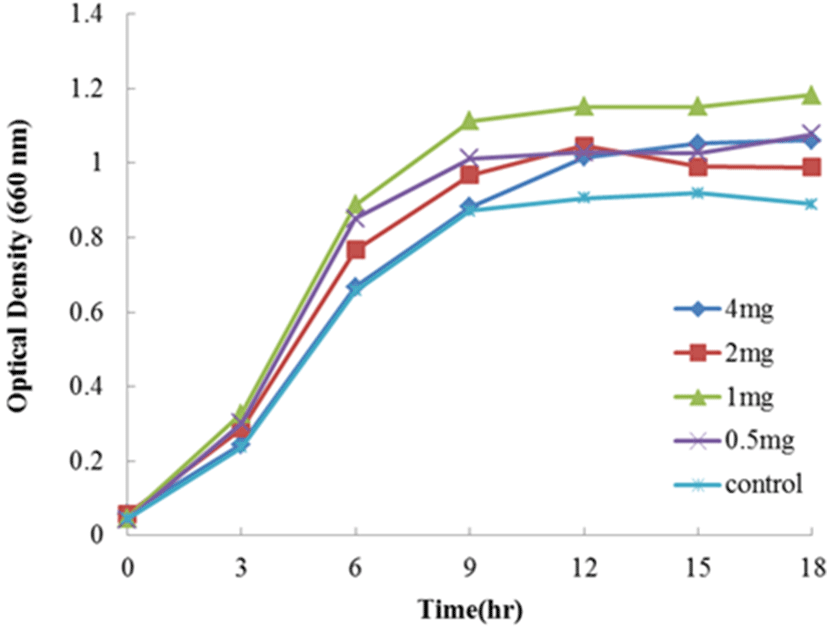
Fig. 2는 1/5 농도의 MRS 배지에 holo-lactoferrin을 4, 2, 1, 그리고 0.5 mg/mL를 첨가하여 Lc. lactis subsp. cremoris FC의 생장을 측정한 결과이다. Holo-lactoferrin을 첨가한 모든 시험구는 대조구(무첨가구)에 비하여 생장이 촉진되었다. 가장 현저한 생장을 보여준 첨가 시험구는 native-lactoferrin의 결과와 동일하게 농도 1 mg/mL 시험구에서 보여주었다. 다음으로는 농도 0.5 mg/mL를 첨가한 시험구가 생장 촉진효과를 나타내었다. 그리고 농도 2와 4 mg/mL를 첨가한 시험구는 동일한 생장 효과를 나타내었으며, 농도 1 mg/mL 시험구에 비하여 현저히 낮은 생장촉진 효과를 나타내었다. 따라서 Lc. lactis subsp. cremoris FC의 생장에 holo-lactoferrin의 첨가효과는 native-lactoferrin의 결과와 같이 농도 1 mg/mL에서 가장 현저한 생장 촉진 효과를 나타내었다.
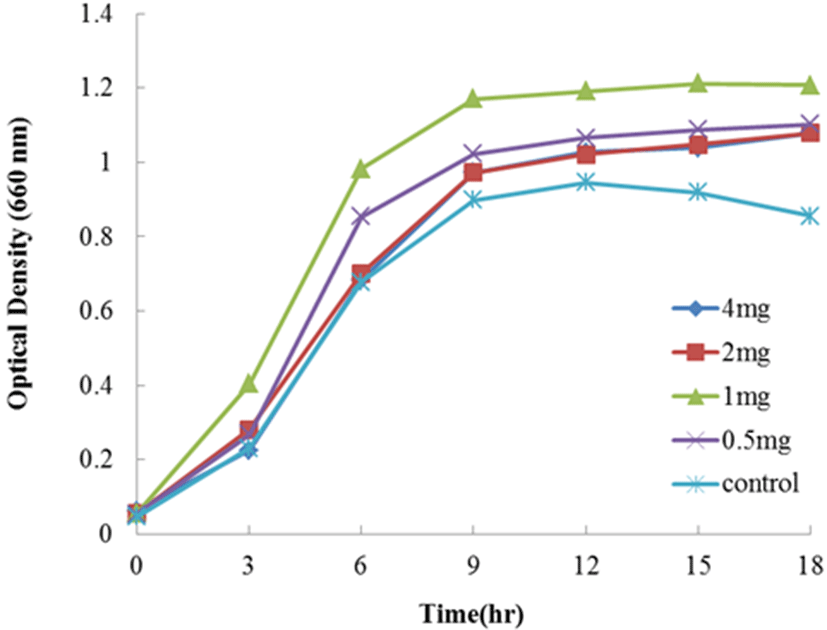
Apo-lactoferrin을 1/5 농도의 MRS 배지에 4, 2, 1, 그리고 0.5 mg/mL를 첨가하여 Lc. lactis subsp. cremoris FC의 생장을 측정한 결과는 Fig. 3에 나타내었다. 현저한 생장촉진 효과를 나타난 농도는 0.5 mg/mL 첨가한 시험구였으며, 농도 1 mg/mL 첨가한 시험구역시 대조구(무첨가구)에 비하여 약간의 생장 촉진효과를 보여주었다. 그러나 농도 2와 4 mg/mL를 첨가한 시험구에서는 오히려 대조구(무첨가구)보다 생장 억제효과를 보여 주어 native-와 holo- lactoferrin과 다른 결과를 나타내었다.
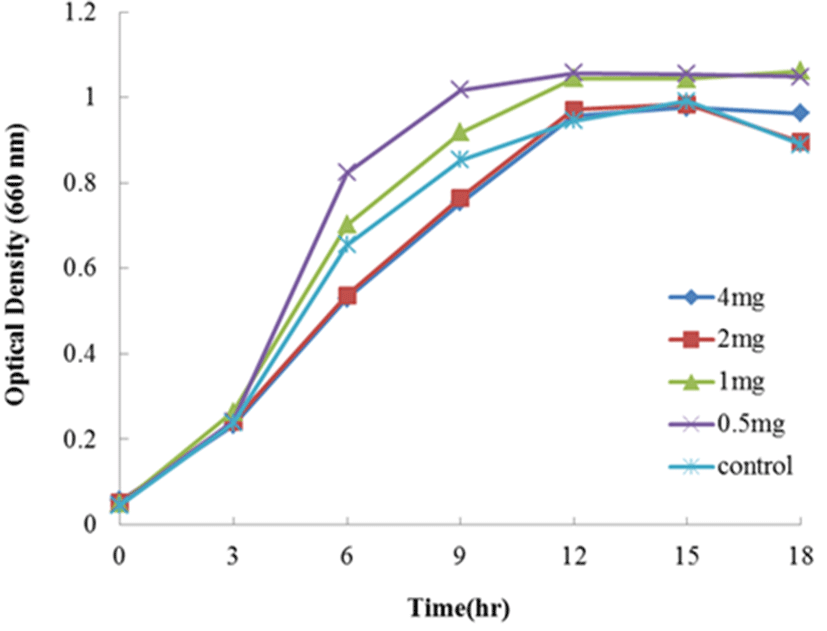
Fig. 4는 1/5 농도의 MRS 배지에 holo-transferrin을 4, 2, 1, 그리고 0.5 mg/mL를 첨가하여 Lc. lactis subsp. cremoris FC의 생장을 측정한 결과이다. Holo-transferrin을 첨가한 모든 시험구는 대조구(무첨가구)에 비하여 우수하게 생장이 촉진되었다. 가장 현저한 생장을 보여준 농도는 0.5, 1, 그리고 2 mg/mL를 첨가한 시험구였다. 농도 4 mg/mL는 대조구(무첨가구)에 비하여 미약한 생장촉진효과를 나타내었다. 따라서 Lc. lactis subsp. cremoris FC의 생장에 holo-transferrin의 첨가효과는 농도 0.5 또는 1.5 mg/mL 를 첨가하는 것이 생장 촉진에 좋은 효과를 나타내는 것으로 사료된다.
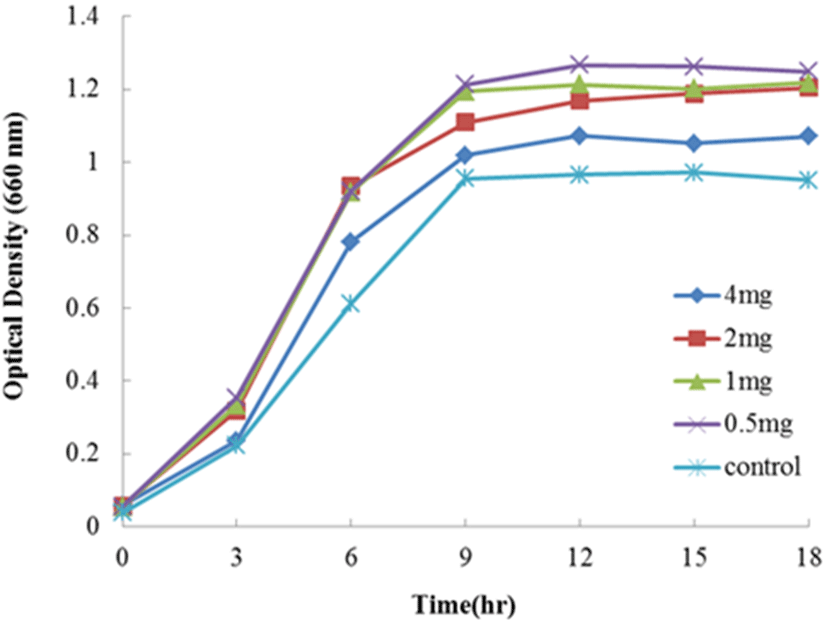
Fig. 5는 1/5 농도의 MRS 배지에 apo-transferrin을 4, 2, 1, 그리고 0.5 mg/mL를 첨가하여 Lc. lactis subsp. cremoris FC의 생장을 측정한 결과로 있다. Apo-transferrin을 첨가한 모든 시험구는 대조구(무첨가구)에 비하여 우수하게 생장이 촉진되었다. 배양 3시간에서는 농도 1>0.5>2>4 mg/mL의 순으로 생장이 촉진하였으며, 이후 농도 0.5와 1 mg/mL 첨가 시험구는 같은 생장 촉진을 보여주었다. Apo-transferrin 역시 holo-transferrin과 같이 농도가 낮은 시험구에서 높은 생장촉진효과를 나타내었다. 따라서 Lc. lactis subsp. cremoris FC의 생장에 apo-transferrin의 첨가효과는 농도 0.5 또는 1 mg/mL를 첨가하는 것이 생장 촉진에 좋은 효과를 나타내었다. Kitazawa 등(1991)은 스칸디나비안 점질산유인 “viili”로부터 Lc. lactis subsp. cremoris를 분리하고, 이 균으로부터 항종양활성을 조사하였는데, 증식종양억제 능력이 확인되었다. 이러한 효과는 종양에의 직접적인 영향보다는 숙주 면역의 증강을 통하여 유도되었다고 하였다. Toda 등(2005)은 Lc. lactis subsp. cremoris를 이용한 발효유를 고령자(평균 67.1±4.8세)에게 4개월간 투여한 결과는 배변량이 증가하였고, 변의 형태, 색 및 배변감이 확실히 좋아졌다고 하였다. 또한 변속의 Clostridium perfringens의 검출이 감소하였고, 대신 Bifidobacterium의 수가 증가하였다고 보고하였다. Kosaka 등(2012)은 Lc. lactis subsp. cremoris FC의 면역조절 효과를 연구하였는데, IL-12와 IL-18을 통한 NK와 T cell로부터 INF-γ의 생산을 현저히 유도하였다고 보고하였다. INF-γ와 INF-γ 생산 세포는 알레르기, 감염 및 종양과 같은 다양한 질병에 대하여 중요한 방어 작용을 한다고 알려져 있다(Chesler and Reiss, 2002; Ikeda et al., 2002). 따라서 Lc. lactis subsp. cremoris FC의 투여는 상피 내 NK세포와 T cell을 직접 자극한다고 할 수 있고, 질병을 예방하는 유용한 유산균으로 기대할 수 있다(Leon et al., 2003; Kosaka et al., 2012). 마우스에 있어서 Lc. lactis subsp. cremoris FC의 경구 투여는 influenza virus(IFV)의 감소와 만성 피부 염증성 질환을 예방하는 효과가 있다고 하였다(Maruno et al., 2012; Gotoh et al., 2017).
알레르기 질환과 장내세균과의 관계가 처음으로 거론된 것은 1990년경으로 알레르기질환 소아에 있어서는 건강한 소아에 비하여 Lactobacillus, Enterococci, Bifidobacterium의 수가 적고, 포도상구균이 증가하는 것으로 알려져 있다(Björkstén et al., 1999, 2001). 소아기에 있어서 알레르기의 원인은 항균제 투여에 의한 장내 세균 총에 대한 나쁜 영향 때문이다. 따라서 장내 세균총의 균형을 유지시켜 알레르기를 억제하기 위해서는 probiotics의 투여가 필요하다. Probiotics는 염증성 장질환(Gionchetti et al., 2000), 과민성 대장증후군(Niedzielin et al., 2001), 맹낭염(Gionchetti et al., 2003), 그리고 로타바이러스 및 항생제유래 설사(Isolauri et al., 1991; Majamaa et al., 1995)의 치료에 이용되고 있다. 그러나 probiotics에 의한 알레르기질환 억제 효과는 유아기처럼 비교적 조기에 투여할 경우, 그 효과가 있지만 청소년 및 성인에게는 효과가 미약하다고 보고되어 있다(Helin et al., 2002). 한편 Sziksz 등(2012)는 식이섬유 및 난소화성 성분으로 있는 올리고당과 같은 Prebiotics도 알레르기 질환치료에 효과가 있을 가능성을 제시하였다.
우리는 이전 bifidobacteria와 Lactobacillus acidophilus에 lactoferrin을 배양 배지에 첨가하였을 때 생장촉진 여부를 연구하였다. Lactobacillus acidophilus은 holo-lactoferrin에서 현저한 생장 증식효과를 나타낸 반면 apo-lactoferrin은 아무런 영향을 나타내지 않았다고 보고하였다(Kim et al., 2004). 한편, bifidobacteria에서는 Bifidobacterium(B.) longum을 제외한 B. bifidum, B. breve, 그리고 B. infantis는 apo-와 holo-lactoferrin 모두에서 생장을 촉진하였다고 보고하였다. 본 실험 결과, 적당량의 lactoferrin group과 transferrin group의 배양 배지 내 첨가는 Lc. lactis subsp. cremoris FC의 생장을 촉진시켰다. 따라서 lactoferrin과 transferrin은 장내 투여된 Lc. lactis subsp. cremoris FC의 장내 생존을 유지시켜주는 prebiotics의 효과로서 기대되고 있다.
요약
Lactococcus lactis subsp. cremoris FC는 카스피해 요구르트의 명칭으로 강한 점성을 가지는 것을 특징으로 하는 코카커스 지방 유래의 발효유로부터 분리된 균주로 있다. 본 연구는 Lc. lactis subsp. cremoris FC의 생장에 대한 lactoferrin group(native-lactoferrin, apo-lactoferrin, 그리고 holo-lactoferrin)과 transferrin (apo-transferrin과 holo-transferrin)의 첨가가 생장에 미치는 영향을 알아보기 위하여 수행하였다. Lc. lactis subsp. cremoris FC의 생장에 lactoferrin과 transferrin의 첨가효과는 0.5 또는 1 mg/mL의 농도로 첨가하는 것이 생장 촉진에 좋은 효과를 나타내는 것으로 조사되었다.
