서론
인류 건강에 영향을 미치는 장내 미생물균총 연구는 미생물학 연구에 획기적인 주제가 되었다. 배양에 의존하는 기술을 사용한 선구적 연구에서 현재의 오믹스 방법, 장내 미생물균총의 조성 및 기능성까지 광범위한 연구들이 평가되었다(Lagier et al., 2015). 복잡한 미생물 균총과 질병의 예방 및 저감 역할과의 관계는 많은 연구의 주요 초점이 되었다(Turnbaugh et al., 2009; Qin et al., 2010; Karlsson et al., 2013). 비피도박테리아 속은 사람에서 아주 흔하게 존재하며(Biavatti and Mattarelli, 2006) 출생시부터 장 건강에 중요한 역할을 하는 것으로 확인되었다. 비피도박테리아는 전통적으로 생균제로 관심이 높아 심도있게 연구되었고, 종 조성 변화, 다양성 또는 상대적 풍부성이 인생의 단계와 여러 가지 질병에서 연구되었다. 비피도박테리아는 유년에서 노년까지 연령에 따라 존재하는 종에 변화가 있다(Arboleya et al., 2016). Bifidobacterium longum, B. breve, 그리고 B. bifidum은 일반적으로 유아에서 우점인 반면, B. catenulatum, B. adolescentis와 B. longum은 성인에서 우점한다. 비피도박테리아 섭취가 건강에 미치는 유용한 효과는 감염에 대한 보호부터 장내외적 긍정적 작용까지 인체건강 증진에 대한 증거가 증가하고 있다. 게다가, 비피도박테리아는 단쇄지방산, CLA(conjugated linoleic acid), 그리고 박테리오신을 포함하는 다양한 건강증진 대사물질 생산과 관련되어 있다. 본 고에서는 비피도박테리아와 연령 및 질병과 관련한 다양한 연구를 소개하고자 한다.
본론
장내 미생물균총은 인류의 건강에 중요한 역할을 하며 대사, 보호, 그리고 영양(Guarner and Malagelada, 2003) 같은 기능과 관련이 있으며, 최근에는 장-뇌 또는 간-장 연결과 관련된 기능이 알려지고 있다(Clarke et al., 2014). 현재 염기서열 분석과 다른 ‘오믹스’ 접근법의 급증으로 장내 미생물 균총에 대한 깊은 지식을 얻을 수 있다.
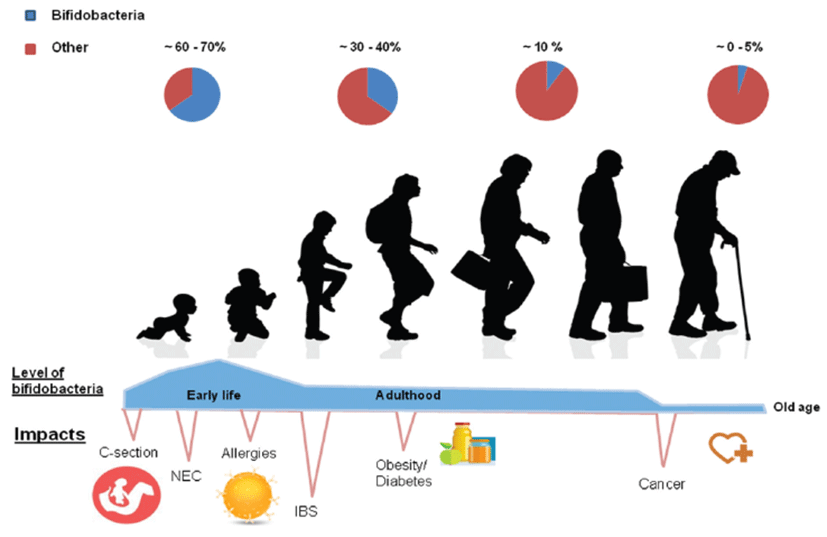
장내 균총의 확립은 처음에는 출생시 발생하는 것으로 생각되었으나, 태반이나 양수에 미생물이 존재한다(Collado et al., 2016)는 것은 일차적인 태아 정착을 제안한다. 게다가, 진행과정은 미생물 항상성에 영향을 미치는 다른 요인에 의해 결정된다(Penders et al., 2006; Faa et al., 2013). Actinobacteria, Proteobacteria, 그리고 Firmicutes가 어릴적 주요 균종이고 낮은 다양성과 복잡성이 특징이다(Koenig et al., 2011; Turroni et al., 2012). 장내 세균총 조성의 주요 변화는 상대적으로 안정성을 얻는 1~2살 때에 첫 번째로 일어난다(Voreades et al., 2014). 장내 미생물균총이 성인 같은 구조는 3년차 이후에 일어나는 것으로 생각되고(Koenig et al., 2011; Yatsunenko et al., 2012), 박테리아, 진핵생물, 바이러스와 고생물류를 합쳐 미생물수가 총 1014에 도달한다(Mihajilovski et al., 2010; HMP, 2012). 문(phylum) 수준에서, 장내 균총은 80~90% Firmicutes와 Bacteroidetes이다. 성인에서는 종(species)과 스트레인 수준에서 다양성이 매우 높고 개인간 다양성이 높은 특징이 있다(HMP, 2012). 그런데, 장내 균총의 기능과 대사는 매우 변화가 없다(Qin et al., 2010). Imahori(1992)에 따르면 노화는 “세월의 진행에 의해 동반되는 생리적 기능의 회귀”로 정의된다. 그것은 위장관(GIT, gastrointestinal tract) 변화, 면역력 약화, 영양실조를 수반하는 자연적 과정이다(Woodmansey, 2007; Biagi et al., 2012). 게다가, 생활습관, 식이 및 투약의 변화는 노인 미생물균총 조성과 기능에 반드시 영향을 미친다(Biagi et al., 2012; Claesson et al., 2012). 미생물 다양성은 연령에 따라 감소되나, Bacteroidetes와 Firmicutes는 우세함을 유지하고 몇몇 다른 종류가 상대적으로 풍부해지는데, 대부분 Proteobacteria(Biagi et al., 2012; Odamaki et al., 2016)이다.
비피도박테리아는 Actinobacteria 문에 속하는 장관계의 정상적 미생물이다. 통성 혐기성 미생물에 의해 산소가 소진된 후에 비피도박테리아는 건강한 유아 장내에서 가장 풍부한 균종이다(Favier et al., 2002). 성년기 동안 상당히 감소되나, 상대적으로 안정적으로 유지되었다가 노년기에 다시 감소(Odamaki et al., 2016 ; Fig. 1)한다. 비피도박테리아의 특정 스트레인은 프로바이오틱으로 널리 사용되며, 안전성은 발효유의 오랜 역사적 소비와 비피도박테리아의 생리학 및 유전체에 대한 지식 증가로 지지된다(Arboleya et al., 2016; O’Callaghan과 van Sinderen, 2016). 비피도박테리아 속은 차단 효과, 면역 체계 자극, 유익한 건강 효과와 관련하여 중요한 역할을 보인다(Pacard et al., 2005). 비피도박테리아의 최초 정착은 여러 가지 외부요인에 달려 있으며, 여러 가지 연구에서 비피도박테리아의 전이는 엄마의 생식기, 장관, 모유, 태반 및 양수에서 유아로 이전과 연관된다(Makino et al., 2013; Collado et al., 2016). 탄생기에 특히 제왕절개에 비해 자연분만한 유아에서 비피도박테리아가 증가한 것은 이러한 초기정착에 중요한 영향이다(Dominguez-Bello et al., 2010). 태아기간은 유아 소화기에 대한 영향의 관점에서, 조산아는 많은 연구에서 Clostridium과 Staphylococcous의 증가, 낮은 수준의 Actinobacteria와 함께 Proteobacteria의 우점으로 특징지어진다. 반면에, 임신기간을 다 채운 유아의 장은 훨씬 많은 수준의 비피도박테리아와 Bacteroides와 상관이 있다(Arboleya et al., 2012; Barrett et al., 2013; Arboleya et al., 2015).
모유와 조제유의 급여 효과를 연구하는 많은 연구에서 식이와 관련있는 특정 비피도박테리아 종들을 확인하였다(Roger et al., 2010). 배양 및 분자학적 방법을 모두 사용한 연구에서 B. breve, B. bifidum, B. longum ssp. longum, 그리고 B. longum ssp. infantis가 모유나 조제유 섭취 유아에서 모두 발견되었다(Mevissen- Verhage et al., 1987; Klaassens et al., 2009). 그런데, B. longum ssp. infantis는 모유영양아에서 더 일반적인 반면(Guaraldi와 Salvatori, 2012), 성인에서 주로 발견되는 B. adolescentis는 조제유 영양아에서만 발견되었다(Klaassens et al., 2009). 많은 연구에서 유아 장내 미생물균총에 영향을 미치는 비피도박테리아 생장인자에 초점을 맞췄다(Musilova et al., 2014). 모유에서 발견되는 특정 글라이칸(glycans)이 비피도박테리아에 이용되는 것으로 알려졌으나, fucose를 글라이칸으로 전환하는데 관여하는 효소 FUT2(Fucosyltransferase 2) 유전자가 불활성화된 엄마를 가진 유아에서 비피도박테리아 정착이 지연되었다(Lewis et al., 2015). 유사하게, 비피도박테리아는 모유 올리고당(HMOs)의 분해에 중요한 역할을 하며(Garrido et al., 2013), 엄마, 유아, 그리고 미생물종 사이에 명확한 진화적 연관을 창조한다. 실제로, B. longum ssp. infantis는 여러 가지 모유 올리고당을 소화하는 능력에 대해 연구되었다(Sela et al., 2008). 이 종은 또한 항염증 특성과 장내 투과성을 감소하는 능력과도 관련이 있다(Underwood et al., 2015).
종의 관점에서 B. longum, B. breve, 그리고 B. bifidum이 유아에서 가장 풍부하다(Favier et al., 2002; Gueimonde et al., 2007; Turroni et al., 2012; Table1). 최근의 연구에서 일란성 쌍둥이(완전히 B. breve 우점)와 그들의 형제간(좀더 높은 다양성을 보임)의 생후 1개월에서 비피도박테리아 종에 대한 기술이 있었다(Murphy et al., 2015; Table 1).
성년기에 비피도박테리아 수준은 더 낮지만 안정함을 유지한다(Odamaki et al., 2016). Gueimonde 등(2007)은 q-PCR 기술을 사용하여 성인보다 유아에서 비피도박테리아가 유의적으로 높은 수준임을 확인했으며, 다른 연구와 마찬가지로 B. longum이 가장 풍부한 종이라고 주장했다(Gavini et al., 2001; Matsuki et al., 2004). 그런데, Matsuki 등(2004)은 성년에서 B. adolescentis와 B. catenulatum이 높은 수준이란 것을 관찰하였다. Chaplin 등(2015)은 연령과 함께 B. bifidum과 B. breve가 감소하며 B. adolescentis가 증가하는 경향을 보고하였다. 현재, 고연령 특이 장내 균총 프로파일은 개인 간 변이가 심하고, 식이 및 생활습관이 다르며 “장년”의 정의가 불명확하기 때문에 합의되지 못하고 있다. 그런데, 다양한 기술을 사용한 여러 가지 연구에서 확인된 장년층에서 비피도박테리아 감소같은 몇 가지 경향이 반복적으로 관찰되고 있다(Mitsuoka et al., 1974; Mitsuoka, 1992; Gavini et al., 2001; Hopkins et al., 2001; Gueimonde et al., 2010; Biagi et al., 2012; Salazar et al., 2013). Woodmansey 등(2004)은 연령과 함께 비피도박테리아 감소는 종 다양성 감소를 동반한다고 보고하였다. 이러한 감소는 장 점막 부착 감소와 관련이 있으나 장내균총 변화 때문인지, 점막 구조 변화 때문인지는 명확하지 않다(He et al., 2001).
백세 인구에서 비피도박테리아 조성도 몇몇 연구에서 보고되었으나 결과는 다소 일관적이지 못하다. 유럽 사람들은 백세 인구의 미생물 조성이 성인과 유사하나(Biagi et al., 2010), 중국의 백세 인구에서 비피도박테리아 비율이 높다는 것이 발견되었다(Zhao et al., 2011). 종 수준에서(Table1) B. longum이 이탈리아 백세인구에서 가장 풍부하고, 그 다음으로 B. adolescentis와 B. bifidum이나 중국 백세인구에서는 B. dentium이 우점종이다(Wang et al., 2015).
노화와 간접적으로 관련된 다른 외적인 요인도 비피도박테리아 조성에 영향을 미친다. 노인에서 항생제의 과다 사용은 분명히 장내 균총 조성에 막대한 영향을 미쳐 비피도박테리아를 감소시킨다(Woodmansey et al., 2004; O’Sullivan et al., 2013). 항생제가 필수적 의료 수단으로 유지되는 동안 장내 균총 재건 목적의 치료가 탐색되는데, 특히, 항생제 치료 후 장내 미생물총을 변화시키고, 비피도박테리아 불균형을 교정하기 위해 프로바이오틱스가 사용된다(Rondanelli et al., 2015). 노쇠의 관점에서 van Tongeren 등(2005)은 높고 낮은 노쇠 범주로 나눈 그룹 사이에서 비피도박테리아의 차이를 발견하지는 못했으며, Bartosch 등(2004)은 지역사회에 거주하는 사람들과 입원한 사람들 사이에 같은 경향을 관찰하였다.
| (A) Human population | Bifidobacterium spp. | Techniques | Reference |
|---|---|---|---|
| Infants | |||
| Breast-fed, 22~24 days of age | B. breve a | PCR | Matsuki et al., 1999 |
| B. longum ssp. longum, B. longum ssp. infantisb | |||
| Breast- and formula fed, | B. longum ssp. infantis | PCR | Haarman and Knol, 2005 |
| 28~90 days of age | B. breve, B. longum ssp. longum | ||
| Breast-fed, 1 month of age | B. longum | PCR | Gronlund et al., 2007 |
| B. bifidum, B. animalis, B. brebe | |||
| Breast-fed, 3~6 weeks of age | B. breve | PCR | Mikami et al., 2009 |
| B. longum ssp. longum, B. longum ssp. infantis | |||
| Full-term, 1 month of age | B. longum | q-PCR | Grzeskowiak et al., 2015 |
| Preterm, CS, 1 month of age | B. longum, B. lactis | ||
| Preterm, Vaginal, 1 month of age | B. longum, B. bifidum | ||
| Twins, 1 month of age | B. breve | 16S Metagenomics | Murphy et al., 2015 |
| Fraternal infant, 1 month of age | B. breve, B. longum | ||
| B. dentium, B. adolescentis | |||
| Adults | |||
| 23~54 years old, Japanese | B. catenulatum | PCR | Matsuki et al., 1999 |
| B. longum, B. adolescentis | |||
| 25~59 years old, Japanese | B. longum | q-PCR | Matsuki et al., 2004 |
| B. adolescentis, B. catenulatum | |||
| ≤57 years old, Russian | B. adolescentis | MALDI-TOF | Chplin et al., 2015 |
| 20~40 years old, Finnish | B. longum | q-PCR | Gueinmonde et al., 2007 |
| B. catenulatum | |||
| 18~39 years old, lean subjects(BMI=19.83±0.94 kg/m2) | B. longum | q-PCR | Mayorga Reyes et al., 2016 |
| Elderly | |||
| 69~89 years old, French | B. adolescentis | DNA-DNA hybridization | Gavini et al., 2001 |
| B. longum | |||
| 67~75 years old, Scottish | B. angulatum | Culture-based analyses | Woodmansey et al., 2004 |
| B. longum | |||
| >70 years old, Finish | B. catenulatum | q-PCR | Gueimonde et al., 2007 |
| B. longum, B. bifidum | |||
| 77~95 years old, Spanish | B. longum | q-PCR | Salazar et al., 2013 |
| B. bifidum, B. pseudocatenulatum | |||
| Centenaries | |||
| 100~104 years old, Italian | B. longum | Culture-based analyses | Drago et al., 2012 |
| B. adolescentis, B. bifidum | |||
| 80~108 years old, Chinese | B. dentium | q-PCR | Wang et al., 2015 |
| B. longum | |||
| (B) Disease in human population | Bifidobacterium spp. | Techniques | Reference |
| Infants | |||
| Allergic mothers | ↑B. adolescentis | q-PCR | Gronlund et al., 2007 |
| Coeliac disease(Non-active) | ↓B. longum;↑B. dentium | q-PCR | Collado et al., 2008a |
| Celiac disease | ↓B. longum | q-PCR | Palma et al., 2012 |
| Allergic disease | ↓B. longum | Culture-based | Akay et al., 2014 |
| ↑B. pseudocatenulatum, | analyses | ||
| B. catenulatum | |||
| Adults | PCR-DGGE | Stsepetova et al., 2007 | |
| Allergy | ↑B. adolescentis | q-PCR | Kerchhoffs et al., 2009 |
| IBS | ↓B. catenulatum | q-PCR | Lyra et al., 2009 |
| IBS | ↓B. catenulatum/pseudocatenulatum | HITChip phylogenetic | Rajilic-Stojanovic et al., 2009 |
| IBS | ↓B. pseudocatenulatum, B. gallicum | microarray | |
| IBS | ↑B. adolescentis | 16S Metagenomics | Jeffery et al., 2012 |
| Hepatitis B virus-related cirrhosis | ↑B. dentium | PCR-DGGE and q-PCR | Xu et al., 2012 |
| ↓B. catenulatum, B. longum | |||
| Obesity | ↓B. animalis | q-PCR | Million et al., 2013 |
| Cystic fibrosis | ↓B. catenulatum/pseudocatenulatum | PCR-DGGE | Duytschaever et al., 2013 |
| B. longum, B. adolescentis | |||
| Long-term asthma | ↑B. adolescentis | 16S Metagenomics | Hevia et al., 2016 |
장내 외 질병은 모두 장관 미생물 조성 및 기능 변경과 관련이 있다(Wu and Lewis, 2013). 비록 ‘잠재적으로 변경된 형태’에 대한 자세한 기술은 없지만, 몇몇 연구자는 장내 미생물의 변경은 광범위한 질병의 전조라고 주장하고 있다(Putignani et al., 2014).
비피도박테리아가 프로바이오틱으로 광범위하게 사용된 후에, 여러 가지 질병에서 비피도박테리아 조성, 다양성, 상대적 풍부성의 변화 등이 집중적으로 연구되었다. 비만은 아이들과 어른 모두에 영향을 미치는 세계적인 질병이고, 일반적으로 미생물총 변경과 관련되어 있다. 몇몇 연구는 비만아에서 enterobacteria나 Staphylococcus 우점과 관련하여 비피도박테리아가 낮은 수준임을 보였다(Kalliomaki et al., 2008; Gao et al., 2015). 임신중 체중이 증가한 여성이 건강한 임산부보다 낮은 비피도박테리아 수준을 보인 것은 흥미롭다(8.36 vs. 9.10 log 유전체 당량/g 분변; Santacruz et al., 2010). 이러한 결과는 엄마가 임신 중 유의적인 체중 증가를 보인 아기에서 비피도박테리아 수준이 감소한 것과 관련이 있다(Collado et al., 2008b). 알레르기 관점에서 Hevia 등(2016)은 장기 천식 환자에서 비피도박테리아 수준이 낮음을 관찰하였다. 동일 연구에서 장단기 천식 환자의 B. adolescentis 우점을 보였으며 이는 이전 연구들과 일치하였다(Stsepetova et al., 2007). 이 종은 알레르기가 있으며 모유에 비피도박테리아 수준이 낮은 엄마의 유아에서만 발견된다(Gronlund et al., 2007). 한 특별한 터키 연구에서 알레르기 질병이 있는 어린이와 비교하여 건강한 어린이에서 통계적으로 유의한 B. longum 수준 증가를 보였으며, 이는 B. longum이 질병에 유익한 역할을 하며 알레르기 예방을 위한 프로바이오틱으로 사용될 수 있음을 제안하였다(Akay et al., 2014). 다른 연구는 장내세균총과 과민성 대장 증상(IBS)의 발병과의 관계에 초점을 맞추어 세균총 변경이 IBS 환자와 비피도박테리아 속의 감소와 관련이 있음을 보였다(Taverniti and Guglielmetti, 2014).
장년의 장내균총에서 Hopkins와 Macfarlane(2002)은 Clostridium difficile 관련 설사의 영향에 집중하여 건강한 대조구에 비해 감염으로 고통받는 장년층에서 비피도박테리아 수의 감소를 보고하였다. 비피도박테리아 수의 감소는 낭포성 섬유종, B형 간염, 그리고 I형 및 II형 당뇨 같은 질병에서도 관찰되었다(Wu et al., 2010; Xu et al., 2012; Duytschaever et al., 2013; Murri et al., 2013). 전체적으로 일반적 질병 상태와 낮은 비피도박테리아 사이에는 반복적인 경향이 있어 건강에서 비피도박테리아의 역할을 추측할 수 있다.
많은 건강 증진 효과는 질병 상태를 교정하기 위한 개입전략에서 프로바이오틱으로 사용한 비피도박테리아 속의 스트레인에 기인한다. 알레르기, celiac disease(소장에서 일어나는 알레르기), 비만, 설사, 배앓이, 감염 또는 신생아 괴사성장염같은 질병에서 매우 좋은 결과를 얻었다(Di Gioia et al., 2014). 성인과 장년에서도 장관 및 순환기 질환에 집중적으로 사용되고 있다(Biagi et al., 2012; Malaguarnera et al., 2012; Tojo et al., 2014). 이상지질혈증이 있는 어린이의 혈액에서 발견되는 지방단백질(lipoprotein) 불균형을 회복시키기 위해 Guardamagna 등(2014)은 담즙염 가수분해효소 활성으로 선발한 비피도박테리아를 포함하는 프로바이오틱의 효과를 설명하였고, 총 콜레스테롤과 LDL 콜레스테롤 감소를 발견하였다. 뇌 장애와 관련하여 많은 연구는 비피도박테리아 사용으로 실험동물(BALB/c mice)의 스트레스와 조울증 같은 행동 감소에 정신적 효과(psychobiotic effects)를 설명하였다. 관찰된 행동 효과는 비록 작용기작은 알 수 없지만, 면역 체계에 대한 영향으로 부분적으로 설명된다(Savignac et al., 2014). 게다가, B. longum의 특별한 스트레인은 비감염성 장염 모델에서 불안 완화효과를 보였다(Bercik et al., 2011).
비피도박테리아는 특정 암 부위에 정착하는 능력에 대해서도 연구되었다(Nakamura et al., 2002). Cronin 등(2010)은 B. breve UCC 2003이 특정 암세포를 갖고 있는 실험동물에서 암세포를 공격할 수 있다는 것을 보였으며, 암세포 특이 T-세포 반응에 영향을 미친다는 것도 보여졌다(Sivan et al., 2015). 비피도박테리아 종은 인류 건강에 유익한 효과를 가져올 수 있으나, 비피도박테리아와 건강에 대한 강력한 관련이 있다면 미래에는 질환의 원인이 되는 바이오마커를 제공할 수 있을 것이다. 게다가 비피도박테리아는 혐기적 성질때문에 암치료제 투여를 위한 운반체로 사용하는 것도 매우 유망하고 안전할 것이다.
비피도박테리아는 건강한 유아 장내에 가장 풍부하고, 건강한 성인의 일생을 통해 미생물 균총의 중요한 부분을 대표하며, 장내 항상성과 건강에 중요한 역할을 한다. 성년기 후반과 여러 가지 질병동안 비피도박테리아 수와 다양성이 감소한다. 최근에 건강과 노화의 관계는 부인할 수 없으나, 원인과 결과의 관계인지는 결론 나지 않았다. 건강한 삶의 다양한 단계에서 비피도박테리아가 우점되고, 많은 건강증진 요인이 그와 관련되면 이들 박테리아가 인류 건강 유지와 보호에 중요한 역할을 한다는 것은 의문의 여지가 없으며, 장래에는 특정 질병에 대한 매우 중요한 바이오마커를 제공할 것이다.
