서 론
Bifidobacterium 속은 인체 장내 우점균으로 모유 수유아 분변의 최대 90%, 성인에서는 3~5%를 차지한다(Harmsen et al., 2002; Harmsen et al., 2000). Bifidobacterium 속에는 32종이 알려져 있고(Balleste and Blanch, 2011). 이들 중 Bif. longum은 모유 수유아의 우점종으로 알려져 있다(Favier et al., 2003; Favier et al., 2002). Bif. longum, Bif. infantis, 그리고 Bif. suis는 Bif. longum으로 통합이 주장되었으나(Sakata et al., 2002), Mattarelli 등(2008)은 subspecies를 사용하여 Bif. longum subsp. longum, Bif. longum subsp. infantis, 그리고 Bif. longum subsp. suis로 분류할 것을 주장하였다. 비피도박테리아는 대장에서 바람직한 변화를 유발하기 때문에 프로바이오틱스로 간주되고 있다. 비피도박테리아는 유기산을 생산하여 병원균을 억제하는 수준으로 대장의 pH를 낮춘다(Ballongue, 1998). 또한, 여러 가지 독성 화합물의 독성을 제거할 수 있고(Ballongue, 1998; Hartemink et al., 1996), 대장 점막에 부착하여 병원균 부착과 대장암 발생을 방지한다(Ballongue, 1998; Gallaher and Khil, 1999; Hartemink et al., 1996; Van Laere et al., 1999). 최근 비피도박테리아에 대한 관심 증가는 비피도박테리아의 존재가 건강한 미생물 균총과 관련이 있는 여러 가지 건강 기능성 때문이며, 이러한 건강증진 박테리아를 기능성 식품에 활용하는데 많은 관심이 있다(Rezzonico et al., 2007). 비록 많은 건강 주장이 과학적으로 확증되지 않았지만, 몇몇 연구는 비피도박테리아의 섭취가 건강에 유익할 수 있다고 제안한다. 유익한 효과를 얻기 위해서는 소비시에 식품내에 높은 수자가 살아있어야 한다. 일본에서 발효유와 유산균 협회는 제품 1그람당 최소 107 생균수를 권장한다(Mc Brearthet al., 2001). 비피도박테리아 관련 잠재적 건강주장은 스트레인에 따라 다르며(Roy, 2005), 스트레인이 제품의 제조공정과 유통기한동안 살아남는 것이 중요하다. 비피도박테리아가 유제품에 프로바이오틱스로 사용될 때 산소 노출, 기계적 교반, 온도 변화, 그리고 pH 변화와 같은 스트레스를 받게 된다. 최종 제품에서 비피도박테리아의 생존은 비피도박테리아의 스트레인, 저장 온도, 그리고 보존 방법에 따라 달라진다(Blanchette et al., 1995). 냉장온도에서 유제품 내 비피도박테리아의 생존성 유지는 많은 발효유제품에서 문제가 되고 있다(Corbo et al., 2001). 비피도박테리아가 강화된 치즈의 생산은 발효유보다 적절하고 가능성 있는 대안이 될 것이라 제안한바 있다(Stanton et al., 1998). 비피도박테리아를 치즈 제조에 활용하면 가공 및 숙성중 비피도박테리아의 장기 생존에 바람직한 pH, 지질 함량, 산소 수준, 그리고 저장 조건이 되어 생존성이 개선될 수 있다(Dinakar and Mistry, 1994; Stanton et al., 1998; Boylston et al., 2004). 게다가, 숙성 중 치즈는 거의 산소가 없는 상태가 되어 비피도박테리아와 같은 혐기성 미생물의 생존에 좋은 조건이 될 수 있다고 하였다(van den Tempel et al., 2002). 본 고에서는 한국인 신생아에서 분리한 Bif. longum subsp. longum KACC 91563(Ham et al., 2011)의 기능성을 소개하고, 비피도박테리아를 이용한 치즈 제조 관련 연구를 고찰하고자 한다.
본 론
케이신과 유청 단백질과 같은 우유 단백질이 유산균의 단백질분해 시스템에 의해 생리활성 펩타이드를 생산하는 전구 단백질이라는 것은 잘 알려져 있으며, 유산균에 의한 우유 유래 생리활성 펩타이드 생산은 잘 보고되어 있다(Hayes et al., 2007; Sadat-Mekmene et al., 2011; Chang et al., 2012; Miclo et al., 2012). 생리활성 펩타이드 중에서 항산화 특성은 활성산소 수준 증가가 암, DNA 손상, 당뇨, 심혈관질환, 알레르기 및 노화를 일으키므로 중요하다(Wolff et al., 1991; Beckman and Ames, 1998; Agerholm-Larsen et al., 2000). 비피도박테리아에 의한 생리활성 펩타이드는 거의 보고되지 않았다. Bif. animalis ssp. lactis strain Bb12로 발효시킨 케이신 분해물과 Bif. psedocatenulatum G4(또는 Bifidobacterium longum BB536) 함유 요구르의 콜레스테롤 저감효과가 보고된바 있으며">Alhaj et al., 2010; Al-Sheraji et al., 2012), Chang 등(2013)이 Bif. longum KACC 91563의 발효에 의해 케이신에서 항산화 펩타이드 생산 가능성을 보고하였다. Bif. longum KACC 91563을 케이신 단백질과 배양시 3 kDa 이하 분획에서 높은 항산화 활성을 나타내어 다양한 펩타이드를 동정하였다(Table 1). 이중 VLSLSQSKVLPVPQK와 VLSLSQSKVLPVPQKAVPYPQRDMPIQA이 β-케이신에서 유래한 항산화 펩타이드로 동정되었다.
Bif. longum Bl 536의 생리활성 펩타이드가 In vitro ACE (Angiotensin I-converting enzyme) 억제 활성을 나타내었다고 보고된바 있으나(Donkor et al., 2007), 펩타이드는 동정되지 않았다. ACE가 angiotensin I에서 angiotensin II로의 전환이나 bradykinin 가수분해에 의해 혈압을 증가시키므로(Gobbetti et al., 2000; Miguel et al., 2009; Petrillo and Ondetti, 1982), ACE 활성의 억제는 고혈압 환자의 치료에 중요한 요소로 간주되고 있다. 최근에 LVYPFP를 포함하는 새로운 ACE 억제 펩타이드가 Bif. bifidum에서 발견되었고(Gonzalez-Gonzalez et al., 2013), Bif. longum KACC 91563에 대하여 Ha 등(2015)이 보고하였다. Bif. longum KACC 91563으로 환원 탈지유를 발효시 3 kDa 이하 분획에서 62.3%의 ACE 억제 활성을 나타내어 Bif. longum Bl 536(Donkor et al., 2007)의 63.7%와 유사한 활성을 나타내었으며, 3 kDa 이하 분획에서 3개의 ACE 억제활성 펩타이드(YQEPVLGPVRGPFPIIV, QEPVLGPVRGPFPIIV, GPVRGPFPIIV)(Yamamoto et al., 1994; Gobbetti et al., 2002; Gomez-Ruiz et al., 2002)가 동정되었다. 높은 ACE 억제활성을 갖는 펩타이드는 C-terminal 말단에 Trp, Phe, Tyr, 또는 Pro, N-terminal 말단에 Ala, Val, Ile 및 Ser을 함유한다는 보고(Jao et al., 2012)에서와 같이 이들 펩타이드가 함유되어 있었다. 또한, 기존에 보고된 항산화 펩타이드 서열을 함유하여 ACE 억제 활성을 나타낼 가능성이 있는 수 있는 15개의 펩타이드를 동정하였다(Table 2). 이중 SDIPNPIGSENSEKTTMPLW는 우유내에 자연적으로 존재하는 항고혈압 펩타이드로 보고된바 있다(Islam et al., 2014).
| Sequence | Fragment | Peptides obtained from the fermentates | References | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| LNVPGEIVE | β-CN(f6-14) | f1-14, RELEELNVPGEIVE | Gobbetti et al., 2000 | |||||||||
| YQEPVLGPVR | β-CN(f193-202) | f193-206, YQEPVLGPVRGPFP | Rokka et al., 1997 | |||||||||
| GPVRGPFPIIV | β-CN(f199-209) | f195-209, EPVLGPVRGPFPIIV | Gomez-Ruiz et al., 2002 | |||||||||
| β-CN(f199-209) | f196-209, PVLGPVRGPFPIIV | |||||||||||
| β-CN(f199-209) | f197-209, VLGPVRGPFPIIV | |||||||||||
| β-CN(f199-209) | f198-209, LGPVRGPFPIIV | |||||||||||
| TTMPLW | αs1-CN(f194-199) | f176-199, APSFSDIPNPIGSENSEKTTMPLW | Maruyama and Suzuki, 1982;Pihlanto-Leppälä et al., 1998 | |||||||||
| αs1-CN(f194-199) | f178-199, SFSDIPNPIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f179-199, FSDIPNPIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f180-199, SDIPNPIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f181-199, DIPNPIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f182-199, IPNPIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f185-199, PIGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f186-199, IGSENSEKTTMPLW | |||||||||||
| αs1-CN(f194-199) | f188-199, SENSEKTTMPLW | |||||||||||
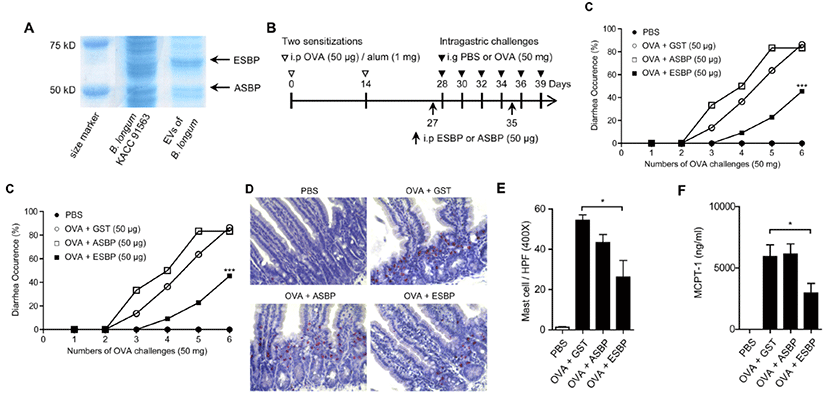
식품 알레르기는 식품이나 식품 첨가물에 비정상적 면역 반응에 의해 발생되는 잠재적으로 심각한 질환으로 최근 식품 알레르기로 인한 병원 방문이 급격히 증가하고 있다(Branum and Lukacs, 2009). 비록 땅콩, 우유, 조개류, 그리고 밀 등이 식품 알레르기를 유발한다는 것은 오래전부터 알려졌지만, 발생 요인들은 명확하게 구명되지 못했다(Sicherer and Sampson, 2009). 알레르기 발생식품의 회피가 가장 널리 사용되는 치료법이나(Sampson, 1999), 프로바이오틱스에 의한 치료도 시도되고 있다(Bermi et al., 2012). 최근 연구에서 프로바이오틱 박테리아는 숙주 면역체계에 영양을 미쳐 염증과 알레르기 반응을 억제한다고 제안한다. 예를 들어, Bif. breve는 IL-10 생산 TRl 세포 유도를 통해 장내 항상성을 증진하고, 8종의 유산균을 혼합한 VSL#3는 면역반응을 TH2에서 TH1으로 전환하여 식품알레르기를 억제한다고 보고되었다(Schiavi et al., 2011). 그런데, Kim 등(2016)은 Bif. longum KACC 91563을 약 한 달간 급여 시 알레르기 발생이 감소하였는데, 이는 Bif. longum KACC 91563의 EV(extracellular vesicles)가 활성화된 비만세포(Mast cell)의 사멸(apoptosis)을 일으켰기 때문이며, EV에서 분리한 ESBP(Family 5 extracellular solute- binding protein)을 2회 주사 시 알레르기 발생이 40% 감소함을 보고하였다(Fig. 1).
유제품은 프로바이오틱스를 인체에 공급하는 이상적인 식품 체계로 고려된다(Ross et al., 2002). 치즈 제조에 프로바이오틱스를 강화하려는 시도로 페타(Kailasapathy and Masondole, 2005), 베야즈(터키식 백색 치즈)(Gursoy and Kinik, 2010; Ozer et al., 2009; Yilmaztekin et al., 2004)와 이란식 백색 치즈(Mahmoudi et al., 2012) 등 백색염지 치즈(white brined cheese)에서 많은 연구가 있었다. Dinakar와 Mistry(1994)는 체다치즈에 비피도박테리아를 첨가하여도 단백질분해 패턴에 영향이 없었고, 고다 치즈 제조 시에는 비피도박테리아에 의한 아세트산 생성으로 치즈 풍미에 부정적인 영향이 있다고 보고된바 있다(Gomes et al., 1995; Gomes and Malcata, 1998). 여러 가지 형태의 치즈에서 비피도박테리아의 생존성 평가 시 Bif. bifidum과 Bif. longum은 가공 및 저장중 좋은 생존성을 나타내었다(Boylston et al., 2004). Gursoy 등(2014)은 백색 염지 치즈의 90일 숙성 시 Bif. longum은 치료용 최소 수준(106~ 107 cfu/g 치즈)보다 높은 수준(>107 cfu/g 치즈)으로 생존할 수 있었고, 상업용 치즈 스타터에 포함된 Streptococcus spp.치즈의 생존에 부정적 영향이 없어 Bif. longum을 첨가한 백색 염지 치즈가 Bif. longum 섭취에 적절한 식품이라고 주장하였다.
결 론
비피도박테리아 속은 인체 장내 우점균으로 모유 수유아 분변의 최대 90%, 성인에서는 3~5%를 차지한다고 알려지고 있으며, 유기산을 생산하여 병원균을 억제하는 수준으로 대장의 pH를 낮춘다. 또한, 여러 가지 독성 화합물의 독성을 제거할 수 있고, 대장 점막에 부착하여 병원균 부착과 대장암 발생을 방지한다고 알려지고 있다. 최근에 한국인 신생아에서 분리한 Bif. longum subsp. longum KACC 91563은 ESBP (Family 5 extracellular solute-binding protein)를 생산하여 식품알레르기를 저감할 뿐만 아니라, 우유 단백질을 분해하여 항산화, 항고혈압 펩타이드를 생산하는 기능성을 나타내었다. 유제품은 프로바이오틱스를 인체에 공급하는 이상적인 식품 체계로 고려되며, 특히 치즈는 상대적으로 높은 pH, 지방함량, 버퍼 완충능 등으로 위장 통과 시 프로바이오틱 미생물 보호효과가 기대되므로 Bif. longum subsp. longum KACC 91563을 이용한 치즈 제조를 진행 중이다.
