ARTICLE
Sialic Acid를 지표성분으로 하는 유청가수분해단백분말의 기능성식품 개발연구 - Ⅲ. 효소분리로 7% Siailc Acid가 표준적으로 함유된 유청가수분해단백분말의 미생물복귀돌연변이시험 연구 -
김희경1,*, 노혜지2, 조향현1, 고홍범3
Development and Research into Functional Foods from Hydrolyzed Whey Protein Powder with Sialic Acid as Its Index Component - III. Bacterial Reverse Mutation Testing of Hydrolyzed Whey Protein Powder Containing Normal Concentration of Sialic Acid (7%) with Enzyme Separation Method -
Hee-Kyong Kim1,*, Hye-Ji Noh2, Hyang-Hyun Cho1, Hong Bum Koh3
1HANILBIOMED Co., Gwangju 67024, Korea
2MEDINUTROL Co., Yeonggwang 57024, Korea
3College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea
*Corresponding Author : Hee-Kyong Kim, HANILBIOMED Co., Gwangju 67024, Korea. Tel: +82-61-352-2166, Fax: +82-61- 352-2167, E-mail :
mulsambong@naver.com
ⓒ Copyright 2016, Korean Society of Milk Science and Biotechnology. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 1, 2016 ; Revised: Jun 20, 2016 ; Accepted: Jun 24, 2016
Published Online: Jun 30, 2016
Abstract
The ultimate research goal of the current study was a development of hydrolyzed whey protein powder (7%-GNANA) manufactured with normal content of sialic acid, a marker compound, that is naturally occurring at 7% concentration in GMP obtained from the milk protein. GMP is a safe food, used worldwide in infant and baby foods, etc. The test substance was prepared using (7% sialic acid containing) GMP as a raw material, and then using alcalase, an enzyme approved as a food additive, after separation of sialic acid with 100% efficiency and 7%-GNANA (containing 7% sialic acid and protein; product name: HELICOBACTROL-7) provided by MEDINUTROL Inc. (Korea). Bacterial reverse mutation (Ames) test was conducted in accordance with GLP Guideline using the test substance specified above. To identify its mutagenic potential against microorganisms, histidine auxotrophic strains of Salmonella Typhimurium, TA98, TA100, TA1535, and TA1537, and tryptophan auxotrophic strain of Escherichia coli, WP2uvrA, were used. The bacterial reverse mutation (Ames) test was performed by dividing the test substances into five different concentration groups (0, 61.7, 185, 556, 1,670, 5,000 μg/plate). Results of this experiment did not reveal repetitive increase of colony generating values or positive criteria for reverse mutagenicity for any concentration of test substances in any of the five strains, regardless of the presence of a metabolic activation system, and no dose-dependency was identified. In conclusion, the safety of 7%-GNANA test substance was verified by bacterial reverse mutation test conducted before registration of 7%-GNANA as a food additive.
Keywords: glycomacropeptide; sialic acid; bacterial reverse mutation test; base substitution; frameshift
서 론
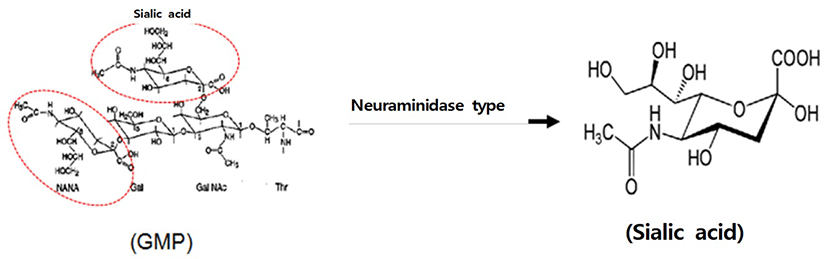
GMP(Glycomacropeptide)는 수용성 유청단 백질의 일종이고, 현재 영유아 식품 등에 식품첨가제로 제품화 및 판매되고 있다. GMP는 우유 속 단백질의 일종인 κ-casein에 chymosin의 작용으로 105번 Phe와 106번 Met 사이의 펩타이드 결합이 절단되어 생성되는 C-말단 63개의 펩타이드를 일컫는다(Yoon et al., 2000). 또한 효소에 의하여 κ-casein의 phenylalanine- methione peptide bond가 절단되면 친수성의 GMP가 유리되는데, N-acetylneuraminic acid(sialic acid), galactose(gal) 그리고 N-acetylgalactosamine(GalNAc)의 3개의 당이 3개 또는 4개가 연결된 형태로 Thr나 Ser 잔기에 연결되어 있다(Brody, 2000). Sialic acid는 다양한 기능성을 보유하고 있는데, 이를 이용하기 위해서는 효소가 반드시 필요한데, neuraminidase라고 한다(Fig. 1)(Moon et al., 2005). Sialic acid는 nine-carbon sugar family에 속하는 단당으로 세포나 수용성 단백질에 당사슬 형태로 부착되어 있으며, 고등동물의 세포나 미생물에서 glucose로부터 복잡한 과정을 거쳐 생성된다(Wang and Brand-Miller, 2003). Sialic acid는 수용기의 인지, 신경 신호전달, 뇌의 ganglioside의 구조와 기능에 역할을 하는 구성 물질이고(Wang and Brand-Miller, 2003; Springer-Verlag, 1984; Wang et al., 2001), 뇌 발달과 인지능력에 중요한 역할을 하는 필수 성분으로 영아기에 섭취는 기억과 학습 능력 향상에 역할을 하는 것으로 알려져 있다(Wang et al., 2001; Wang, 2009; Wang et al., 2007; Gorog and Kovacs, 1978). Sialic acid는 현재 대부분 재조합 E. coli에서 합성되거나 E. coli로부터 생산된 효소를 이용해 N-acetyl-D-glucosamine으로 부터 합성되며, 일부가 화학적 합성방법으로 생산되고 있다(Iijima et al., 2004). Sialic acid는 대부분 의료용 소재로 활용되고 있으며, 유청 단백질에서 분리한 sialic acid를 식품산업에 적용된 예는 국내외적으로 아직까지는 없다. 건강기능성 식품원료 등록을 위하여 필수적으로 수행되는 항목인 미생물복귀돌연변이시험에서 일반적으로 살모넬라균(Salmonella typhimurium) 또는 대장균(Escherichia coli)을 이용하는데, 살모넬라균은 히스티딘 요구성의 변이를, 대장균은 트립토판 요구성의 변이를 지표로 한다. 이들 균주는 유전독성유발물질에 대해 높은 감수성을 나타내는 유전적 형질을 가지고 있어 유전독성시험에 널리 이용되고 있다(Maron and Ames, 1983). 따라서, 본 연구에서는 안전식품 및 식품첨가물로 사용되고 있는 GMP 내 지표성분인 sialic acid를 식품소재로 활용성을 높이기 위하여, 시험물질로서 유청가수분해단백(이하 7%-GNANA)을 미생물복귀돌연변이시험용 공시균주를 이용하여 GLP 가이드라인 기준에 준하는 안전성을 평가하였다.
재료 및 방법
1. 시험물질 준비
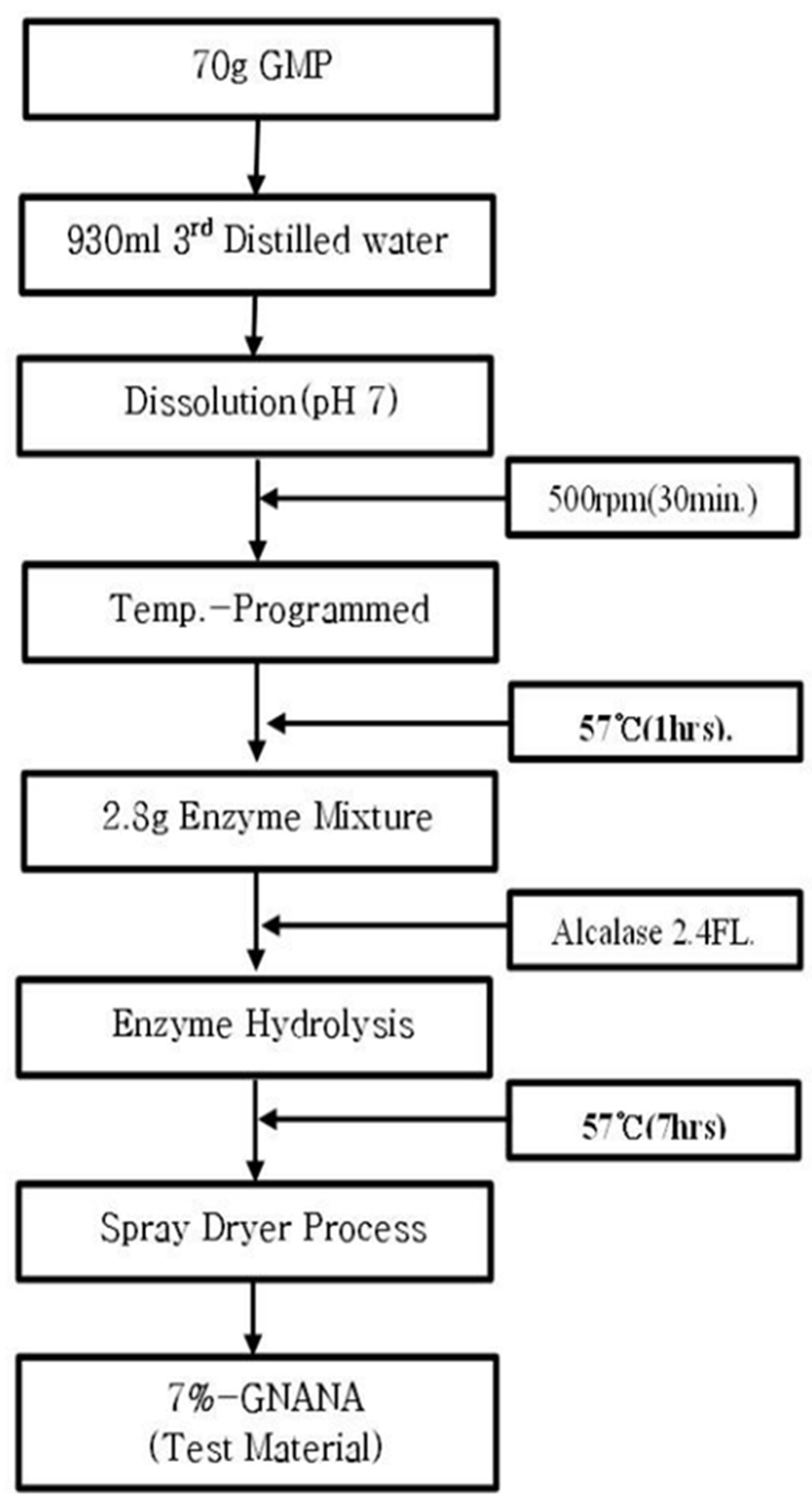
GMP는 sialic acid가 7%가 결합된 형태로 판매되는 NatraPep GMP(Murry Goulburn Co-Operative Co., Australia)을 구입하여 시험물질 제조를 위한 원료로 사용하였다. 시험물질 제조는 정제수에 7%(w/v)되게 GMP를 우선 용해시킨 후 Alcalase 2.4FL(Novozymes Co., Denmark) 효소를 기질 대비 0.2%(w/v)로 혼합 및 57℃에서 1시간 동안 가수분해시킨 용액을 동결분말로 제조한 7%-GNANA(제품명: HELICOBACTROL-7)을 한일바이오메드사(한국)로 공여 받아 시험물질로 사용하였다(Fig. 2). 시험물질 내 지표성분인 sialic acid의 분리 여부 및 함유량 검정을 위한 표준체 sialic acid는 Sigma-Aldrich 사(A2090)에서 구입하여 0.1 ppm(w/w), 1 ppm 및 10 ppm 되게 희석하여 분석간 표준용액으로 사용하였다.
Fig. 2.
Manufacturing process diagram for 7%-GNANA, a test substance containing 7% sialic acid, through the enzyme (Alcalase 2.4 FL) separation mechanism of sialic acid, the marker compound having the Glycomacropeptide (GMP) as a substrate.
Download Original Figure
2. 시험물질 내 지표성분 Sialic acid 분리 및 함유량 검정
10 mM sodium acetate buffer 용액에 시험물질인 7%-GNANA를 완전히 용해시킨 후, 에탄올 8 mL에 희석액 2 mL를 혼합한 후 Sonication(25℃) 및 원심분리(3,000 rpm × 20 min, 25℃) 과정을 거쳐 상등액만을 0.22 μm membrane으로 여과 후, 이를 최종 HPLC System(Agilent 1260, USA) 시료로 사용하였다(Table 1). 분석간 검출허용 표준편차는 90~110% 범위 내에서 평가하였다(Table 1, Fig. 1).
Table 1.
HPLC operation conditions for analysis of sialic acid
|
1. HPLC system(Agilent 1260) |
2. Analysis conditions |
․Pump: G1311C
․Auto sampler: G1329B
․Column: G1316A
․UV detector: G1314F |
․Wavelength: 205 nm
․Column: Aminex® HPX-87H Ion Exclusion Column(300×7.8 mm, 9 μm, Bio-Rad Co.)
․Mobile phase: 10 mM H2SO4
․Running time: 20 min
․Flow rate: 0.5 mL/min
․Injection volume: 10 μL
․Temperature: 40℃
․Standard sol.(w/w): Silaic acid 0.1 ppm, 1 ppm, 10 ppm |
Download Excel Table
3. 미생물복귀돌연변이시험
1) 시험용 균주 준비
표준균주로 Salmonella typhimurium 계열의 돌연변이 균주인 TA98, TA100 및 TA1535, TA1537을, 그리고 Escherichia coli의 돌연변이 균주인 WP2uvrA를 전체 시험간 이용하였으며, MOLTOXTM(USA)으로 부터 구입하여 전체 시험간 사용하였다.
2) 시험용 균주 시험용 배지조성
Plate 배지는 Top Agar와 Vogel-Bonner 최소 Glucose 한천배지를 Maron 및 Ames의 방법(Maron and Ames, 1983)의 시험법에 준하여 제조 및 사용하였다.
3) 시험균주의 유전형질 확인
시험균주는 Maron 및 Ames의 방법(Maron and Ames, 1983)에 따라 아미노산 요구성, UV 민감도, rfa 돌연변이 및 R-factor 유지 여부 등의 확인 시험을 수행하여 유전형질이 잘 유지되고 있음을 시험 전에 확인하였다.
4) 양성대조물질 조성 및 처리조건
표준균주별 감수성 평가를 위한 양성대조물질로서는 sodium azide(NaN3), 9-aminoacridine(9-AA), 4-nitroquinoline-N-oxide (4-NQO) 및 2-aminoanthracene(2-AA)와 용매로서는 dimethyl sulfoxide(Sigma-Aldricd Co., USA)를 사용하였다. 대사활성계 부재조건에서 양성대조물질은 2-AA를 공시균종에 따라 0.5~10 μg/plate 범위에서 농도처리를 다르게 하였다. 대사활성계 존재조건에서 Sal. typhimurium TA98와 E. coli WP2uvrA 균주는 4-NQO를 0.5 μg/plate 그리고 Sal. typhimurium TA100과 TA1535는 NaN3를 1.5 μg/plate, Sal. typhimurium TA1537 균주는 9-AA를 80 μg/plate로 양성대조물질을 처리하는 조건으로 실시하였다(Table 2).
Table 2.
Name and applied concentration of positivity comparison substance used in the evaluation of bacterial reverse mutation for 7%-GNANA holding the sialic acid as a marker compound
|
Bacteria name |
S9 Mix(+) |
S9 Mix(-) |
|
Positive control |
Concen-tration(μg/plate) |
Positive control |
Concen-tration(μg/plate) |
|
Sal. typhimurium TA98 |
4-NQO |
0.5 |
2-AA |
0.5 |
|
Sal. typhimurium TA100 |
NaN3
|
1.5 |
2-AA |
1.0 |
|
Sal. typhimurium TA1535 |
NaN3
|
1.5 |
2-AA |
2.0 |
|
Sal. typhimurium TA1537 |
9-AA |
80 |
2-AA |
2.0 |
|
E. coli WP2uvrA |
4-NQO |
0.5 |
2-AA |
10 |
Download Excel Table
5) S9 Mixture 조성
대사활성계 존재 시 미생물복귀돌연변이시험을 위하여, Sprague Dawley male rat에 유도물질인 Aroclor 1254을 도살 5일 전 단회복강투여 후 간조직을 적출 및 균질화 한 후 -20℃에서 보관된 S9(MOLTOX사, USA)을 구입하여 시험에 사용하였다. S9 mixture의 조성은 Table 3과 같이 제조하였다.
Table 3.
S9 Mixture spectrum table for evaluation of standard susceptibility with the treatment of 7%-GNANA by each concentration level, a test substance, effecting on bacterial reverse mutation
|
S-9 |
1 |
3 |
|
S-9 (mL) |
2.1 |
2 |
6.3 |
5.5 |
|
20 mM HEPES (mL) |
6 |
|
15 |
|
|
50 mM MgCl2 (mL) |
3 |
|
7.5 |
|
|
330 mM KCl (mL) |
3 |
18 |
7.5 |
49.5 |
|
50 mM G-6-P (mL) |
3 |
|
7.5 |
|
|
40 mM NADPㆍNa (mL) |
3 |
|
7.5 |
|
|
Diatilled water (mL) |
3 |
|
7.5 |
|
|
SUM (mL) |
|
20 |
|
55 |
Download Excel Table
6) 시험군 구성
시험물질을 미생물복귀돌연변이시험에 일반적으로 고려되고 있는 최고투여농도인 5,000 μg/plate를 최고농도로 설정하고, 대사활성계 존재 및 부재조건에서 공비 2로 하여, 5단계 농도군(0, 312, 625, 1,250, 2,500 그리고 5,000 μg/plate)에서 예비적으로 농도결정시험 결과, 모든 균주의 모든 농도에서 복귀돌연변이 집락수의 증가 또는 명백한 세포독성이 나타나지 않았다(Table 4). 따라서 OECD Guideline(Organization for Economic Cooperation and Development(OECD), 1993; OECD, 2008)에 따라 역시 동일하게 대사활성계 존재 및 부재조건에서 5,000 μg/plate를 최고농도로 설정하고, 공비 3으로 5단계의 농도군(0, 61.7, 185, 556, 1,670, 5,000 μg/plate)을 본 시험에 적용하였다(Table 5).
Table 4.
The result of concentration range setting test conducted to evaluate the effect on increase & decrease of reverse mutation colonies by the addition of 7%-GNANA, a test substance, under the presence and absence conditions of metabolic activation system
|
With and without metabolic activation |
Test materials conc.(μg/plate) |
Number of revertant colony (cfu/plate) |
|
Base substitution types |
Frameshiftm types |
|
TA100* |
TA1535* |
WP2uvrA*
|
TA98*
|
TA1537*
|
|
S9 Mix(-) |
0 |
109.0±3.61#
|
19.0±2.65#
|
32.0±2.00#
|
46.0±2.00#
|
12.7±3.06#
|
|
61.7 |
105.7±7.51 |
20.3±4.73 |
31.0±1.00 |
46.0±4.36 |
12.7±1.15 |
|
185 |
115.3±9.29 |
21.0±2.00 |
36.0±2.00 |
44.7±4.16 |
11.0±1.00 |
|
556 |
116.0±9.54 |
19.7±2.52 |
31.0±3.61 |
44.3±4.04 |
14.0±1.73 |
|
1,670 |
105.7±7.77 |
21.3±1.15 |
31.0±1.73 |
46.7±4.93 |
15.3±1.15 |
|
5,000 |
114.3±6.03 |
21.0±4.00 |
34.0±2.00 |
42.7±1.15 |
11.7±1.53 |
|
S9 Mix(+) |
0 |
117.0±20.22 |
21.0±2.65 |
29.7±3.06 |
43.0±5.20 |
13.0±3.00 |
|
61.7 |
113.0±11.36 |
18.7±3.79 |
33.3±4.04 |
46.3±3.06 |
13.0±1.00 |
|
185 |
121.0±11.53 |
20.7±4.04 |
30.0±2.65 |
50.0±1.00 |
14.3±2.08 |
|
556 |
126.0± 6.56 |
21.3±4.62 |
32.3±4.73 |
44.0±3.46 |
12.7±0.58 |
|
1,670 |
133.3± 9.87 |
21.0±4.00 |
31.0±3.61 |
41.7±2.89 |
12.3±1.15 |
|
5,000 |
133.7±11.93 |
19.7±3.21 |
35.0±3.46 |
45.3±3.06 |
14.7±1.15 |
|
Positive control |
S9 Mix(-) |
Materials |
NaN3
|
NaN3
|
4-NQO |
4-NQO |
9-AA |
|
Conc. (μg/plate) |
1.5 |
1.5 |
0.5 |
0.5 |
80 |
|
cfu/plate |
327.7±23.97 |
228.7±15.04 |
220.7±18.90 |
269.3±31.50 |
151.0±11.53 |
|
S9 Mix(+) |
Materials |
2-AA |
2-AA |
2-AA |
2-AA |
2-AA |
|
Conc. (μg/plate) |
1.0 |
2.0 |
10 |
0.5 |
2.0 |
|
cfu/plate |
441.7±17.95 |
189.3±13.50 |
258.3±3.06 |
265.3±21.55 |
218.0±34.70 |
Download Excel Table
Table 5.
The result of evaluation (main study) conducted to evaluate the effect on increase & decrease of reverse mutation colonies by the addition of 7%-GNANA, a test substance, under the presence and absence conditions of metabolic activation system
|
With and without metabolic activation |
Test material conc.(μg/plate) |
Number of revertant colony (cfu/plate) |
|
Base substitution types |
Frameshiftm types |
|
TA100*
|
TA1535*
|
WP2uvrA*
|
TA98*
|
TA1537*
|
|
S9 Mix(-) |
0 |
124.3± 2.31#
|
25.7±2.31#
|
24.7±1.53#
|
32.0±1.73#
|
13.7±2.08#
|
|
61.7 |
111.3± 7.77 |
25.7±2.08 |
26.0±5.00 |
34.0±2.65 |
13.0±1.00 |
|
185 |
115.7±12.66 |
25.0±2.00 |
27.3±2.08 |
35.3±1.53 |
13.7±0.58 |
|
556 |
132.0±13.00 |
27.7±2.08 |
26.7±3.21 |
39.0±1.00 |
14.7±2.89 |
|
1,670 |
119.3± 7.51 |
26.0±5.00 |
26.7±3.79 |
36.7±0.58 |
13.3±0.58 |
|
5,000 |
128.7±10.97 |
28.3±2.89 |
24.0±1.00 |
37.3±2.08 |
13.3±0.58 |
|
S9 Mix(+) |
0 |
134.7± 0.58 |
24.0±1.73 |
25.3±1.53 |
35.7±1.53 |
14.7±2.52 |
|
61.7 |
120.0± 2.65 |
23.3±3.21 |
25.0±6.93 |
38.3±2.08 |
13.7±1.53 |
|
185 |
117.7± 1.15 |
24.0±3.61 |
25.7±3.79 |
37.0±2.65 |
12.7±3.06 |
|
556 |
109.7± 8.96 |
22.0±1.00 |
28.0±4.00 |
37.0±3.61 |
13.0±1.00 |
|
1,670 |
125.7± 7.77 |
23.3±4.93 |
29.3±1.53 |
33.7±4.73 |
13.0±1.00 |
|
5,000 |
125.7±13.20 |
27.0±2.65 |
29.7±4.16 |
36.7±2.52 |
13.7±0.58 |
|
Positive control |
S9 Mix(-) |
Materialds |
NaN3
|
NaN3
|
4-NQO |
4-NQO |
9-AA |
|
Conc. (μg/plate) |
1.5 |
1.5 |
0.5 |
0.5 |
80 |
|
cfu/plate |
442.3±10.26 |
237.0±13.53 |
241.3±25.01 |
287.3±15.14 |
272.7±9.87 |
|
S9 Mix(+) |
Materialds |
2-AA |
2-AA |
2-AA |
2-AA |
2-AA |
|
Conc. (μg/plate) |
1.0 |
2.0 |
10 |
0.5 |
2.0 |
|
cfu/plate |
406.7±3.51 |
241.0±14.11 |
344.7±9.50 |
265.7±17.62 |
290.0±23.43 |
Download Excel Table
8) 평가기준
표준균주별 정상 생장범위를 Sal. typhimurium TA98는 15~60 cfu/plate, TA100는 60~200 cfu/plate, TA1535는 10~40 cfu/plate, TA1537는 5~20 cfu/plate 그리고 E. coli WP2uvrA 경우는 10~40 cfu/plate 범위 내에서 집락수를 나타내는 경우를 시험물질에 대하여 안전성을 보이는 정상범위로 평가하였다. 시험물질에 대한 복귀돌연변이 평가는 대사활성계 존재 유무에 관계없이 최소 1개 균주에서 플레이트 당 복귀된 집락수에 있어서 1개 이상의 농도에서 재현성 있는 증가를 나타낼 때 양성으로 판정하였다.
결 과
1. 시험물질 내 지표성분 함유량 평가
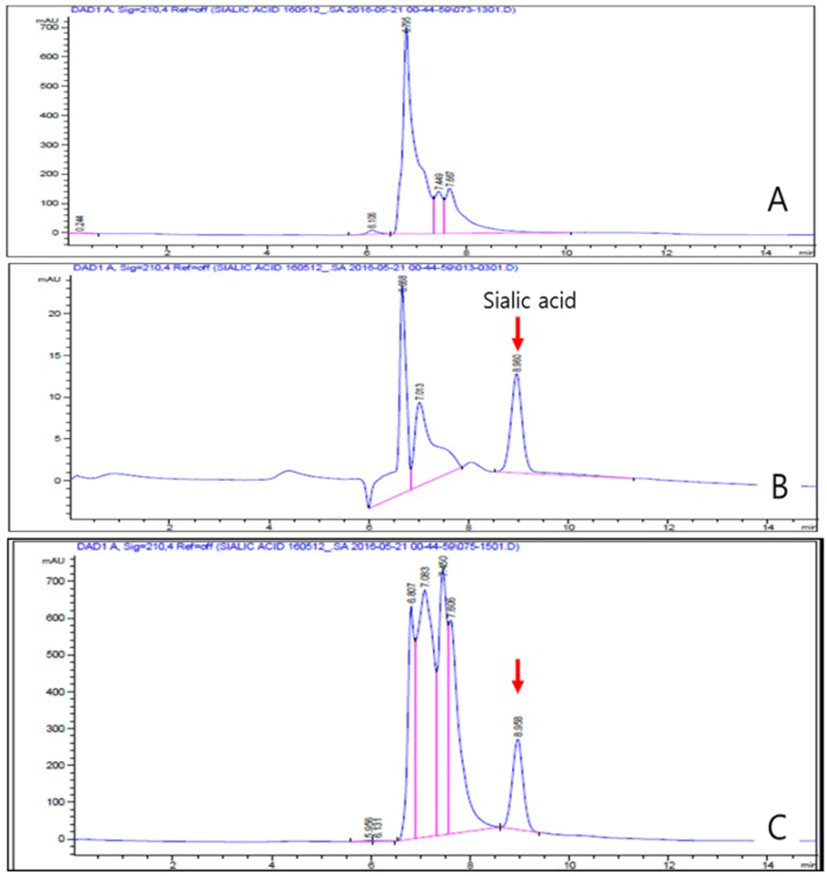
시험물질 내 sialic acid의 분리 및 함유량을 HPLC 분석법을 적용하여 평가한 결과, GMP 내 결합되어 있던 sialic acid는 100% 효율로 분리(Fig. 3)되었으며, 7.43±0.28%의 sialic acid와 GMP 유래의 단백질로 구성되어 있었다(Fig. 1).
Fig. 3.
Result of evaluation for separation and content of sialic acid in hydrolyzed whey protein (7%-GNANA), a test substance, vs. the standard sialic acid applying the HPLC analysis method.
A: Non-enzymatically modified GMP, B: Standard sialic acid (25 ppm), C: Result of sialic acid detection in 7%-GNANA. was prepared through the ethanol enriching process and final hot air drying process after treating the 0.2% (v/v) Alclase for 1 hour (40℃) versus GMP.
Download Original Figure
2. 시험물질의 미생물복귀돌연변이 평가
1) 사전 실험농도 설정 평가시험
양성대조물질처리에 따른 표준균주들에 대한 표준 감수성을 검정한 후, 본 시험을 위해 시험물질을 5,000 μg/plate를 최고농도로 하여 0, 312, 625, 1,250 그리고 2,500 μg/plate에서 모든 균주에서 유의한 생육저해가 없었기 때문에, 이를 기준으로 본 시험은 5,000 μg/plate을 최고농도로 설정하였다(Table 4).
2) 미생물복귀돌연변이 평가
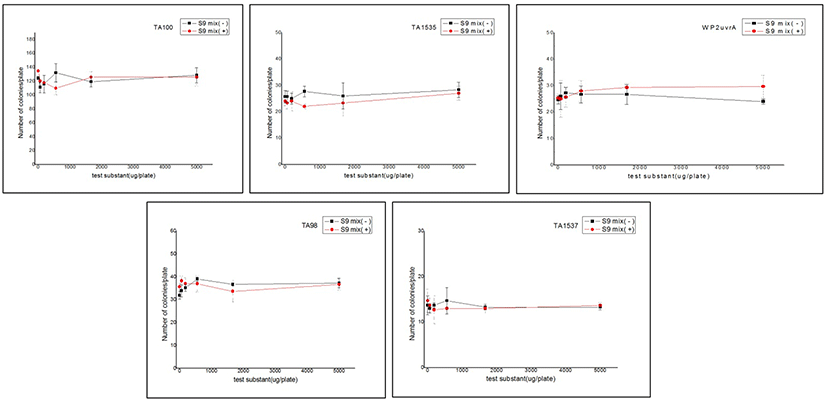
전체 균주에 대하여 양성대조물질 처리를 통한 표준 감수성을 확인한 결과, 대사활성계 미처리의 경우 TA100, TA1535, WP2uvrA, TA98 및 TA1537 균주는 각각 442.3±10.26 cfu/ plate, 237.0±13.53 cfu/plate, 241.3±25.01 cfu/plate, 287.3±15.14 cfu/plate 및 272.7±9.87 cfu/plate로 나타났으며, 대사활성계 처리 조건에서는 406.7±3.51 cfu/plate, 241.0±14.11 cfu/plate, 344.7±9.50 cfu/plate, 265.7±17.62 cfu/plate 및 290.0±23.43 cfu/ plate로 나타나, 정상적인 감수성을 보였다. 음성 대조군 대비 시험물질을 5단계의 농도에서 처리한 본 시험 중 대사활성계 부재의 경우에서 복귀돌연변이에 미치는 결과를 살펴보았더니, Sal. typhimurium TA100 균주는 최저 111.3±7.77 cfu/plate에서 최대 128.7±10.9 cfu/plate의 범위의 수치를 나타냈으며, TA1535 균주는 25.0±2.00 cfu/plate에서 최대 28.3±2.89 cfu/ plate, E. coli WP2uvrA 균주는 최저 24.0±1.00 cfu/plate에서 최대 27.3±2.08 cfu/plate, TA98 균주의 경우는 최저 32.0±1.73에서 최대 39.0±1.00 cfu/plate 범위의 수치를 보였고, Sal. typhimurium TA1537 균주는 최저 13.0±1.00 cfu/plate에서 최대 14.7±2.89 cfu/plate의 범위로 나타나, 전체 균주에서 정상적인 수준의 결과치를 보였다(P<l0.01). 대사활성화계 존재의 경우에서 Sal. typhimurium TA100 균주는 최저 109.7±8.96 cfu/ plate에서 최대 134.7±0.58 cfu/plate 범위의 수치를 보였으며, TA1535 균주는 최저 22.0±1.00 cfu/plate부터 최대 27.0±2.65 cfu/plate, E. coli WP2uvrA 균주는 최저 25.0±6.93 cfu/mL에서 최대 29.7±4.16 cfu/plate, Sal. typhimurium TA98 균주는 최저 35.7±1.53 cfu/plate에서 최대 38.3±2.08 cfu/plate를 보였으며, TA1537 균주는 12.7±3.06 cfu/plate에서 최대 14.7±1.53 cfu/plate 범위의 수치를 나타내었다. 이러한 결과는 표준 균주별로 안전성 관련 허용 범위 내에서의 수치였으므로 시험물질은 농도와 상관없이 안전한 것으로 평가되었다(P<0.01). 따라서, 전체 표준균주에 대하여 시험물질인 7%-GNANA를 농도별로 처리시 미생물복귀돌연변이 평가에서는 안전한 것으로 확인되었다(Table 5, Fig. 4).
Fig. 4.
The result of evaluation conducted to evaluate the effect on increase & decrease of reverse mutation colonies by the addition of 23% -GNANA, a test substance, under the presence and absence conditions of metabolic activation system versus the solvent control group.
TA98 (Sal. typhimurium TA98), TA100 (Sal. typhimurium TA100), TA1535 (Sal. typhimurium TA1535), TA1537 (Sal. typhimurium TA1537), WP2uvrA (E. coli WP2uvrA), S9 Mix(-) : without metabolic activation, S9 Mix(+) : with metabolic activation
Download Original Figure
고 찰
우유 및 유제품에 함유된 카제인 유래 생리활성 peptide가 생체 내에서 심혈관계, 신경계, 면역계 및 영양계에 걸쳐 중요한 기능을 한다는 사실이 밝혀진 이래로 현재까지 이에 대한 여러 연구가 진행되어 왔다. 유단백질 중 영양학적인 관점에서 본 생리활성 peptide로는 CPP와 GMP를 들 수 있는데, GMP는 분자량이 크기 때문에 그 자체로 흡수될 수 없어서 분자량이 작은 peptide로 분해된 후 흡수되어야 한다. GMP의 아미노산 구성성분은 방향족 아미노산이 부족한 반면, 측쇄 아미노산(UAL, ILU)과 낮은 MET 함량을 갖는 독특한 아미노산 조성은 phenylketonurine 환자의 diet 소재와 간 질환의 치료(Marshall, 1991) 및 Hypoallegic Food 등으로 개발이 가능하다고 할 수 있다(Takahashi, 1992). GMP는 칼슘, 철 및 아연의 흡수에 도움을 주는 것으로 알려져 있는데, Kelleher 등(2003)이 Rh(Rhesus) 인자를 가진 어린 원숭이에게 GMP와 조제용 분유의 α-lactalbumin 성분을 보충했을 때에 나타나는 변화를 관찰하였는데, 양쪽 모두에서 아연 흡수의 증가를 관찰하였다. 영양적인 측면 이외에도 충치 예방(Aimutis, 2004)에 있어 유제품에 포함된 생리활성 peptide에 관한 기능성 연구가 진행되어 왔다. 본 연구에서는 식품첨가물로 등재가 되어 있으며, Endo-protease인 Alcalase를 사용하여 GMP 내 지표성분인 sialic acid를 분리시킴과 동시에 아미노산 형태로 가수분해함으로써 이들의 기능성을 동시에 제품개발에 활용하고자 하였다. 본 연구가 유청가수분해단백분말(7% G-NANA) 소재의 기능성 유제품으로 개발을 위하여 sialic acid를 분리 및 정제 등의 인위적인 원료 GMP의 변형 유발과 기능성 식품으로 개발을 목표로 하고 있기 때문에 관련법규에 준하는 해당 시험물질의 안전성 평가는 필수적이다라고 할 수 있다. 이에 따라 본 연 연구에서는 GMP를 원료로 하여 제조된 시험물질인 7%-GNANA에 대한 발암성 유발 유․무 판단에 기초자료를 얻기 위하여 유전독성시험 중 미생물복귀돌연변이시험을 실시하였다. 시험에는 Sal. typhimurium의 돌연변이 균주인 TA100, TA1535과 E. coli의 WP2uvrA의 염기치환형, Sal. typhimurium의 돌연변이 균주인 TA198과 TA1537의 경우는 Frameshift를 복귀돌연변이 유발 여부 평가를 위한 항목으로 정하였다. 시험물질인 7%-GNANA의 유전독성시험 중 미생물복귀돌연변이시험을 실시한 결과, 대사활성계 존재 유무에 관계없이 모든 균주는 모든 농도에서 재현성 있는 증가를 나타내지 않았으며, 용량의존성도 확인되지 않았음에 따라 GMP를 원료로 제조한 7%-GNANA는 복귀돌연변이 유발원이 아닌 것으로 판정되었다. 따라서, 본 시험의 목표인 안전식품인 GMP를 원료로 7% sialic acid를 분리 및 이를 고농도로 함유토록 제조된 7%-GNANA는 단지 원료인 GMP 수준의 안전한 식품소재임이 확인되었다.
요 약
본 시험은 GMP 내 기본적으로 7%로 결합되어 있는 sialic acid의 함유량을 그대로 보유하도록 제조한 유청단백가수분말(시험물질명: 7%-GNANA)을 기능성 식품 원료 개발함에 최종 연구목표를 두었다. 시험물질은 GMP(7% sialic acid 함유)를 원료로 하고, 여기에 식품첨가물로 허용된 효소인 Alcalase를 사용하여 지표성분인 sialic acid를 100% 효율로 분리시킨 후, 동결 건조한 7%-GNANA(7% sialic acid와 GMP 단백질로 구성, 제품명: HELICOBACTROL-7)을 ㈜한일바이오메드사(한국)에서 공여 받아 GLP 가이드라인에 따라 미생물복귀돌연변이시험을 실시하였다. 미생물에 대한 돌연변이 유발성 유무를 검색하기 위해 히스티딘 요구성 균주인 Sal. typhimurium TA98, TA100, TA1535 및 TA1537과 트립토판 요구성 균주인 E. coli WP2uvrA를 이용하였다. 미생물복귀돌연변이시험은 시험물질을 5단계의 농도군(0, 61.7, 185, 556, 1,670, 5,000 μg/plate)으로 하여 평가하였다. 본 시험을 통한 평가결과, 대사활성계 존재 유무와 관계없이 모든 균주에서 시험물질의 각 농도에 의한 복귀돌연변이 유발원 양성기준인 콜로니 생성수치가 재현성 있는 증가를 나타내지 않았으며, 용량의존성도 확인되지 않았다. 결론적으로, 시험물질인 7% G-NANA의 식품첨가물로서 등록을 위하여 수행한 미생물돌연변이시험에서 안전성이 확인되었다.
감사의 글
본 연구는 농림축산식품부(기질 특이적 유기태화-미네럴 류 제조법 확립을 통한 다기능성 사료첨가제 개발 및 수출용 기능성 미네럴 강화란 대량생산시스템 정립, 고부가가치식품 개발산업, 제 113024-3호)에 의해 이루어진 것임.
References
Iijima, R., Takahashi, H., Namme, R., Ikegami, S. and Yamazaki, M. (2004). Novel biological funtion of sialic acid (N-acetylneuraminic acid) as a hydrogen peroxide scavenger. FEBS Letters 561:163-166 .


Korea Food and Drug Administration(KFDA). 2014. The above study was conducted in accordance with the Ministry of Food and Drug Safety. KFDA Notice No. 2014-136 (Jul. 30.) .

Korea Food and Drug Administration(KFDA). 2015. Guidelines for toxicity tests in drugs, etc. KFDA Notice No. 2014-67 (Feb. 12) .

Maron, D. M. and Ames, B. N. 1983. Revised methods for the Salmonella mutagenicity test. Mutation Res. 113:173- 215 .


Marshall, S. C. 1991. Casein macropeptide from whey. A new product opportunity. Food Res. Quar. 15:86-91 .

Moon, Y.-I., Lee, W. and Oh, S. 2005. Glycomacropeptide hydrolysed from bovine κ-casein: Ⅱ. Chromatographic changes of κ-casein macropeptide as related to trichloroacetic acid concentration. Korean J. Food Sci. Ani. Resour. 25: 478-482 .

Organization for Economic Cooperation and Development. 1993. OECD guideline for the testing of chemicals, 'Guidelines for the management of non-clinical studies' OECD Test guidelines (No. 473) and GLP Center Standard Operating Procedures .

Organization for Economic Cooperation and Development. 2008. OECD Guidelines 408 for the testing of chemicals: Repeated Dose 90-day Oral Toxicity Study in Rodents .

Springer-Verlag, R. S. 1984. Sialic acids: Chemistry, metabolism and function. Carbohydrate Research 129:c5-c7 .


Takahashi, N., Asakawa, S., Shunichi, D. and Tadashi, I. 1992. Hypoallergenic nutritive composition. Freench Pat. Appl. Fr. 2667 850A1 .

Wang, B., Yu, B., Karim, M., Hu, H., Sun, Y., McGreevy, P., Petocz, P., Held, S. and Brand-Miller, J. 2007. Dietary sialic acid supplementation improves learning and memory in piglets1-3. Am. J. Clin. Nutr. 85:561-569 .



Yoon, Y. C., Cho, J. K., Song, C. H., Lee, S. and Chung, C. I. 2000. Purification of the glycomacropeptide from cheese whey. Korean J. Food Sci. Ani. Resour. 20:159- 165 .